經直腸取標本腹腔鏡低位直腸癌術后排便功能的影響因素
張純博,李俊蒙,白軍偉,張 超
(河南大學人民醫院,河南省人民醫院胃腸外科,河南 鄭州,450003)
隨著腹腔鏡技術的飛速發展,微創技術取得了前所未有的進步,腹腔鏡手術在結直腸腫瘤的外科治療中得到了快速推廣與普及[1-2]。腹腔鏡全直腸系膜切除術已成為外科醫生治療直腸癌的首選,但傳統腹腔鏡手術仍無法避免用于取出標本的腹壁輔助切口,切口相關并發癥仍然存在,經自然腔道取標本手術(natural orifice specimen extraction surgery,NOSES)是結直腸外科的一種新探索,利用腹腔鏡完成腹腔內操作,通過自然腔道取出手術標本,達到真正的無輔助切口[3-4]。經直腸取出標本無需額外切口,是目前直腸癌NOSES手術的首選方案,而關于經直腸取標本腹腔鏡直腸癌術后肛門功能的國內研究尚少[5]。本研究中NOSES手術均采用經直腸取出標本,現評價其治療后患者術后排便功能,分析相關影響因素。
1 資料與方法
1.1 臨床資料 采用回顧性分析的方法,收集2017年1月至2019年12月我院收治的經直腸取標本腹腔鏡直腸癌根治術的112例患者的臨床資料,其中男76例,女36例,45~75歲,中位年齡59歲。腫瘤TNM分期Ⅰ~Ⅱ期78例,Ⅲ期34例。腫瘤病理學分期T1~2期71例,T3期41例。手術均由同一主刀醫師完成。本研究通過本院醫學倫理委員會批準,患者及家屬均知情同意。
1.2 納入與排除標準 納入標準:(1)符合一般腹腔鏡手術的要求;(2)術前腸鏡及病理學檢查為惡性腫瘤;(3)BMI<30 kg/m2;(4)術前CT檢查證實無肝臟、肺部及腹膜轉移,腫瘤分期為T1~3NxM0期;(5)腫瘤環周徑≤5 cm;(6)腫瘤下緣距齒狀線2~5 cm行Dixon保肛術;(7)包含完整的術中及術后病歷資料。排除標準:(1)合并嚴重心、肺疾病及其他手術禁忌證;(2)BMI≥30 kg/m2;(3)術前檢查證實腫瘤已有轉移或周圍器官浸潤;(4)腫瘤環周徑>5 cm;(5)合并急性腸梗阻;(6)術前肛門功能差或失禁;(7)行預防性造口;(8)病歷資料不完整。
1.3 手術方法 112例患者均行腹部無輔助切口經肛門取標本的腹腔鏡下低位直腸前切除術。手術由同一主刀醫師完成。采用氣管插管全身麻醉,患者取截石位,常規術區消毒鋪無菌巾,采用五孔法,氣腹壓力維持在12 mmHg,臍內穿刺10 mm Trocar,置入腹腔鏡,右下腹(右側髂前上棘與臍連線中外1/3偏下)穿刺12 mm Trocar為術者主操作孔,臍水平左右腹直肌外緣、左下腹(臍與左髂前上棘連線中外1/3處)穿刺5 mm Trocar為輔助操作孔。游離乙狀結腸內外側腹膜。妥善保護左側輸尿管,在腹主動脈下方距左右髂總動脈3~4 cm處分離出腸系膜下動脈,于腸系膜下動脈的外上方2 cm處游離出腸系膜下靜脈,分別于根部用可吸收夾夾閉、切斷。遵循全直腸系膜切除的原則,向下方銳性分離直腸后間隙,游離系膜達盆底,注意保護腹下及盆底神經。充分游離直腸前壁,并游離直腸兩側后切斷直腸兩側韌帶,分離直腸兩側壁直至齒狀線水平。標本取出及消化道重建按照NOSES Ⅰ式B法[6],直線切割閉合器在預切線處切割閉合裸化的腸管,碘伏紗布條消毒斷端。卵圓鉗經肛門伸至直腸斷端,夾持直腸殘端及腸壁外翻拉出肛門外,外翻后切開腸壁,經外翻的腸壁將抵釘座送入盆腔(圖1)。腫瘤下緣1~2 cm處切割閉合器切斷直腸,移除標本。鏡下用3-0薇喬縫線行荷包縫合,近端腸管斷端置入抵釘座,鏡下收緊荷包(圖2、圖3)。經肛置入吻合器,完成端端吻合。檢查吻合口,放置引流管,解除氣腹,關閉腹壁切口,完成手術(圖4)。
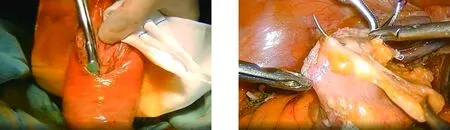
圖1 經外翻腸壁置入抵釘座 圖2 腔鏡下做荷包縫合
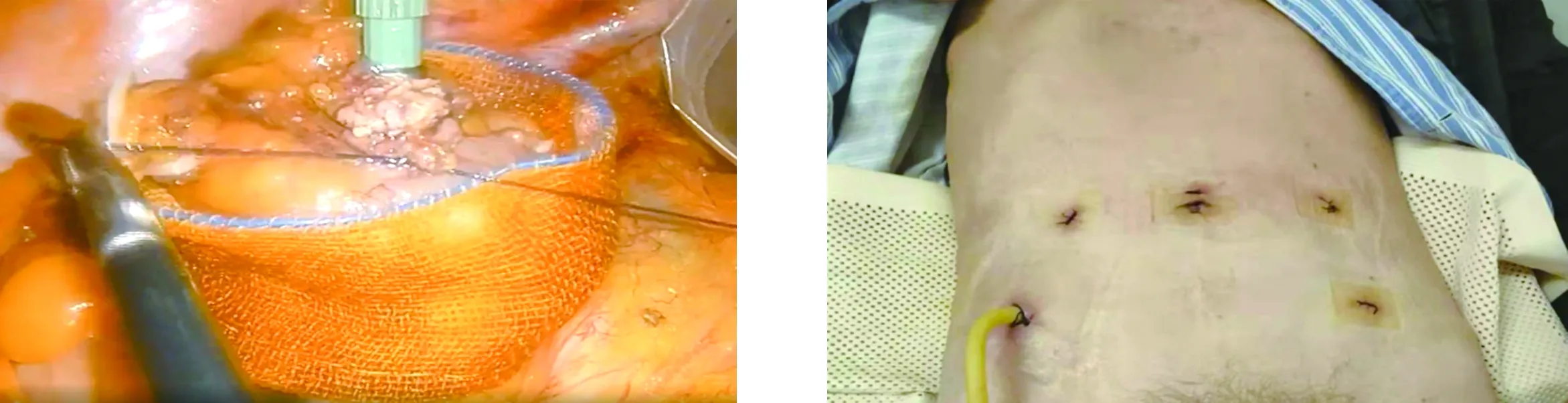
圖3 置入抵釘座后收緊荷包 圖4 術后腹壁切口
1.4 觀察指標與評價標準 觀察指標:(1)手術及術后情況:手術時間,術中出血量,腫瘤直徑,術后尿管拔除時間,吻合口距齒狀線距離,術后吻合口漏發生情況。(2)隨訪情況:隨訪例數、時間及并發癥發生情況。(3)影響患者術后排便功能相關因素分析:術后3個月排便功能相關影響因素,包括年齡、性別、BMI、術前新輔助化療、腫瘤直徑、吻合口距齒狀線距離、病理T分期、病理N分期、腫瘤TNM分期、手術時間、術中出血量、術后尿管拔除時間、吻合口漏。評價標準:采用Wexner[7]評分系統對肛門失禁進行評分:包括5項內容,每項0~4分,總計0~20分,肛門功能正常0分,術后肛門功能較好≤10分,術后肛門功能欠佳>10分,完全失禁20分。
1.5 隨訪 采用門診及電話的形式進行問卷調查隨訪。了解患者術后3個月內并發癥發生情況,隨訪截至2020年3月。
1.6 統計學處理 采用SPSS 25.0軟件進行數據分析。正態分布的計量資料以均數±標準差表示,組間比較采用兩獨立樣本t檢驗或修正方差齊性后的t’檢驗;計數資料以百分比表示,兩樣本比較采用χ2檢驗;多因素分析采用logistic回歸模型,P<0.05為差異有統計學意義。
2 結 果
2.1 手術及術后情況 112例患者均行腹部無輔助切口經直腸取標本的腹腔鏡低位直腸前切除術,無中轉開腹。手術時間(139.7±17.7)min,術中出血量(113.8±31.8)mL,腫瘤直徑(3.0±0.9)cm,術后尿管拔除時間(3.2±0.4)d,吻合口距齒狀線距離(4.2±1.4)cm。術后10例發生吻合口漏,6例經抗感染、改善營養狀況、反復骶前引流沖洗后好轉;4例行回腸末端造口,2個月后還納。
2.2 隨訪情況 112例患者術后3個月均完成隨訪,填寫Wexner排糞失禁量表。14例發生肛門失禁。
2.3 影響患者術后排便功能相關因素分析 單因素分析結果顯示,術前新輔助化療、術后吻合口漏、術后吻合口距齒狀線距離及腫瘤直徑是影響患者術后肛門排便功能的相關因素(P<0.05)。患者年齡、性別、BMI、病理T分期、病理N分期、腫瘤TNM分期、手術時間、術中出血量、術后尿管拔除時間不是影響術后排便功能的相關因素(P>0.05)。見表1。多因素分析結果顯示,新輔助化療、術后吻合口漏、術后吻合口距齒狀線距離<3 cm及腫瘤直徑>3 cm是影響患者術后排便功能的獨立危險因素(P<0.05)。見表2。
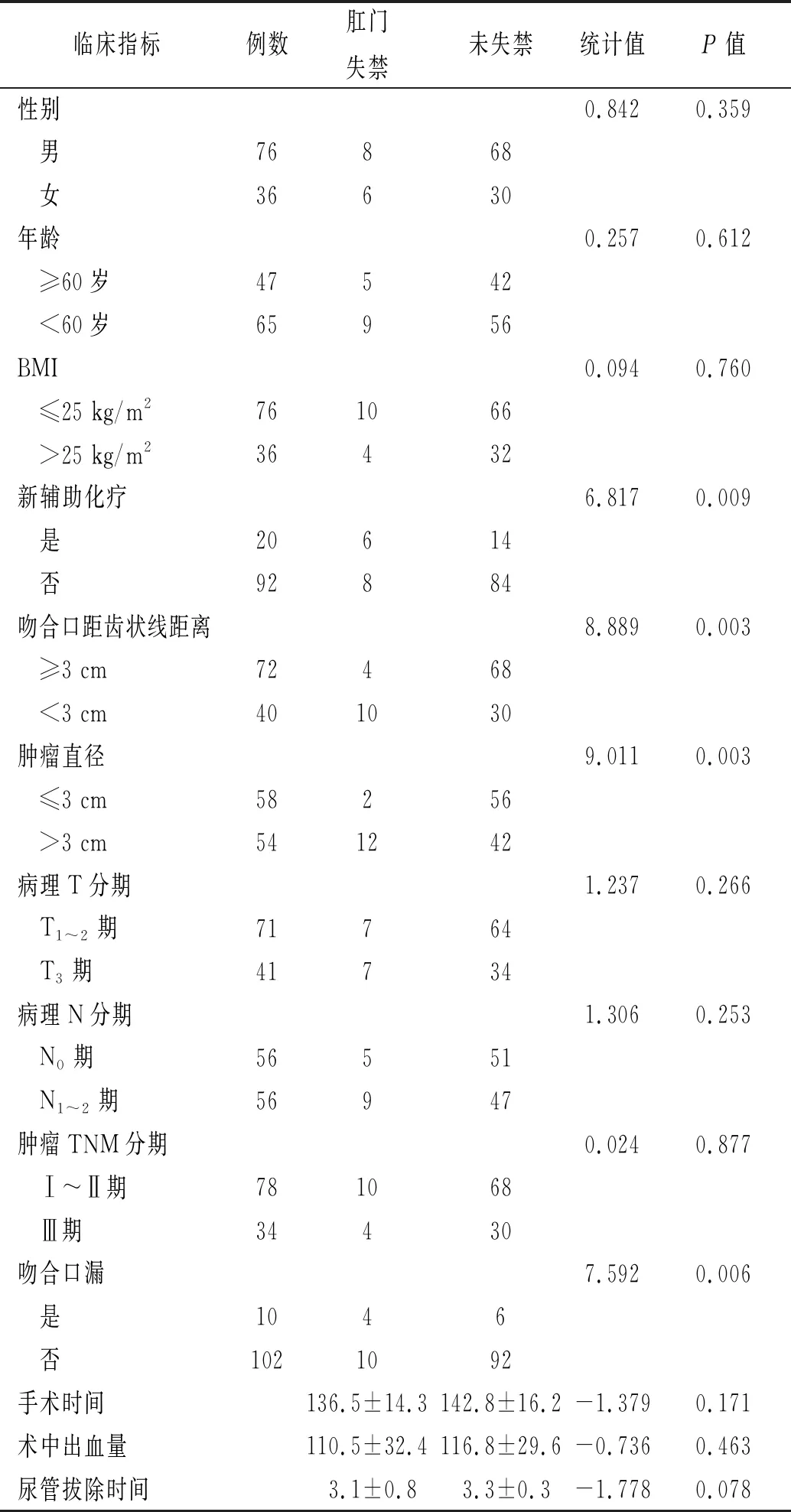
表1 影響經直腸取標本腹腔鏡直腸癌根治術后發生肛門失禁的單因素分析
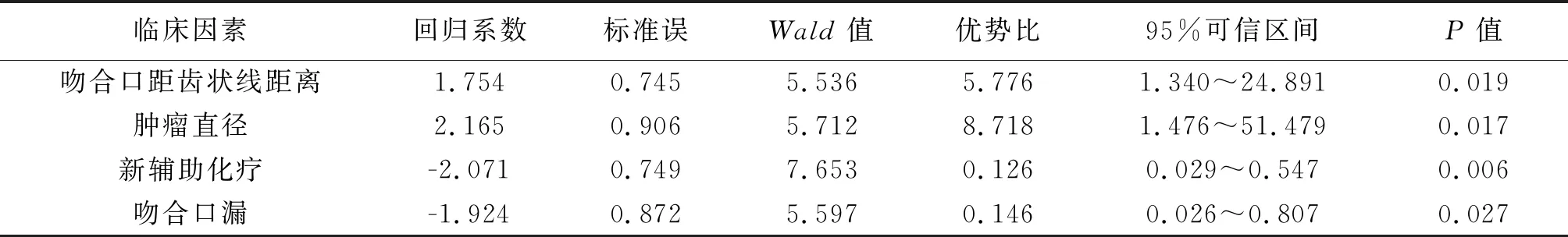
表2 影響經直腸取標本腹腔鏡直腸癌根治術后發生肛門失禁的多因素分析
3 討 論
隨著微創外科的發展,腹腔鏡結直腸癌手術逐漸普及,這是目前外科領域的總體趨勢。但其仍無法避免手術切口感染、切口疝等并發癥的發生,無法避免手術瘢痕與疼痛,NOSES的出現改變了人們的微創理念,其最大程度地發揮了微創手術的優勢[8-10]。在各種NOSES的手術方式中,經直腸取標本與經陰道取標本兩種術式因易行且安全而被廣泛接受。由于直腸手術往往需要開放直腸且肛門括約肌具有良好的彈性,借助直腸這一自然孔道完成標本取出更符合微創手術的要求,因此NOSES直腸癌根治術多采用經直腸取標本途徑[11-12]。
國外文獻報道,NOSES創傷小,康復快,并發癥少,且美容效果好,可作為直腸癌根治的首選術式[13-15]。但也有國內學者指出NOSES經直腸取標本手術會損傷患者肛門括約肌,影響患者術后生活[16]。本研究納入的NOSES低位直腸癌根治術后肛門功能障礙發生率為12.5%,國內文獻報道[17],NOSES術后肛門功能障礙發生率約為1.5%,本研究中發生率較高,可能與本組納入病例均為低位直腸癌有關。
影響經直腸取標本術后肛門功能的臨床因素是復雜的。腫瘤直徑是影響經直腸取出標本的重要因素,最新的結直腸腫瘤經自然腔道取標本手術專家共識2019版[18]認為,NOSES經肛門取標本適應證最大環周直徑為<5 cm。本研究中,腫瘤最大直徑>3 cm是肛門失禁的獨立危險因素(OR=8.718,95%CI:1.476~51.479,P=0.017)。這可能與腫瘤直徑大、經肛門外翻切除及吻合時位置過低,或游離直腸下端系膜時損傷部分盆底神經叢有關。吻合口位置也是影響肛門功能的危險因素。吻合口位置高可盡可能地避免損傷肛門括約肌及盆底神經叢等影響肛門功能的結構。本研究中,吻合口距齒狀線距離<3 cm是影響肛門功能的獨立危險因素(OR=5.776,95%CI:1.340~24.891,P=0.019),且吻合口距齒狀線距離<3 cm及≥3 cm術后肛門失禁發生率分別為25%與5.6%,表明吻合口位置<3 cm的患者術后更容易出現肛門功能障礙。多因素分析還發現術前行新輔助化療也是影響肛門功能的獨立危險因素(OR=0.126,95%CI:0.029~0.547,P=0.006),可能由于術前化療導致組織水腫或導致肛門括約肌、肌間神經叢損傷有關。吻合口漏的發生原因很多,全身因素包括營養不良、長期應用糖皮質激素、術前行放化療、伴糖尿病等慢性疾病,但更重要的是吻合口血運障礙、吻合口周圍感染等。我國79家中心[17]開展的NOSES研究顯示,NOSES術后吻合口漏發生率為3.5%,行NOSES不增加吻合口漏的發生。本研究納入病例均為低位直腸癌,吻合口漏發生率為8.9%,且多因素分析結果顯示,術后吻合口漏為影響肛門功能的獨立危險因素(OR=0.146,95%CI:0.026~0.807,P=0.027),發生吻合口漏后,不論保守治療抑或二次行造瘺手術,腸管局部的炎癥反應均會引起直腸肛管的順應性下降,并使肛管直腸功能長期受損,進而影響術后患者肛門功能。
本研究單因素分析提示,患者年齡、性別、BMI、病理T分期、病理N分期、腫瘤TNM分期、手術時間、術中出血量、術后尿管拔除時間不是影響術后排便功能的相關因素。但其中仍存在一定局限性。目前國內NOSES指南規定BMI≥30 kg/m2為NOSES的相對禁忌證,并未明確推薦BMI,本研究單因素分析顯示BMI與術后排便功能無相關性,可能因納入病例BMI均<30 kg/m2,尚不能說明BMI沒有意義。此外,一般而言分期更早,腫瘤浸潤腸壁深度越淺,經直腸肛門外翻更容易,操作時帶來的直腸及周圍組織創傷越小,術后肛門功能越好。本研究顯示腫瘤分期不是影響術后排便功能的相關因素,可能是樣本量較小所致,仍需更大樣本量的研究予以證實。關于低位直腸癌是否行預防性造口,已有多篇文獻[19-20]報道其并不降低吻合口漏發生率,且NOSES不增加術后吻合口漏發生率,因此筆者團隊不提倡對所有患者均行預防性造口。預防性造口回納前遠端直腸的曠置可能引起肛門功能的退化,進而影響術后肛門功能。由于本研究納入的患者中并無行預防性造口的患者,關于預防性造口與術后肛門功能有無相關性,仍有待進一步研究證實。
綜上,低位直腸癌行經直腸取標本的腹腔鏡直腸癌根治術,腫瘤直徑、術后吻合口漏、術后吻合口距齒狀線距離及術前新輔助化療是影響患者術后排便功能的獨立因素。但本研究隨訪時間有限,患者術后6個月、1年以上肛門功能情況因數據不完整難以分析。且本研究為單中心研究,樣本量有限,可能導致結果的偏倚,這有待進一步大樣本前瞻性研究驗證。

