帕瑞昔布超前鎮痛聯合胸段硬膜外鎮痛在食管癌根治術患者中的應用
史亞榮,曾 毅,吳志新
食管癌是臨床常見的消化道腫瘤,多為鱗癌與腺癌,我國食管癌的發病率位居世界前列,每年食管癌新發病例約占全世界的50%[1]。目前食管癌治療主要是外科手術,抑制癌灶進展,控制遠處擴散。超前鎮痛是在傷害性刺激作用于機體之前給予鎮痛藥物,阻止外周損傷沖動向患者中樞傳遞,減少傷害性刺激帶來的疼痛,可加快患者術后恢復,近年來被應用于各類手術[2]。阿片類鎮痛藥是目前臨床上鎮痛效果最強的麻醉藥物類型之一,但其有惡心嘔吐、呼吸抑制等不良反應。非甾體抗炎藥物具有鎮痛、解熱作用,是臨床上一種較為理想的輔助鎮痛藥物,然而由于傳統藥物類型的該類藥物抗血小板凝集作用較強,有可能增加術后切口出血的發生風險,從而限制了其臨床應用[3]。帕瑞昔布鈉是一種新型的特異性環氧合酶-2(COX-2)選擇性抑制劑,無抗血小板作用,不會增加術后出血風險,臨床上可用于中度或重度手術。本研究對比分析了兩種不同麻醉方式對食管癌根治術患者的影響,旨在探討超前鎮痛麻醉的臨床價值。現報告如下。
1 資料與方法
1.1一般資料 選取本院2017年2月—2018年11月行食管癌根治術的患者90例為研究對象。①納入標準:符合《食管癌規范診治指南》中食管癌相關診斷標準[4],于本院擇期行食管癌根治術;術前美國麻醉醫師協會(ASA)分級為Ⅰ或Ⅱ級;術前未進行化療或放療;意識清楚,無認知相關功能障礙;患者及家屬對研究知情同意并簽字,本研究經醫院倫理委員會批準。②排除標準:不能耐受手術或麻醉者;合并不能控制的高血壓或糖尿病者;合并凝血功能不全者;合并中樞神經系統病變者;脊柱畸形或脊柱部位損傷者;圍術期使用激素類藥物者及臨床資料不全者。按術前麻醉誘導用藥分為觀察組和對照組,每組45例。對照組男24例,女21例;年齡55~76(65.41±5.96)歲;體重49~78(63.38±4.57)kg;ASA分級:Ⅰ級16例,Ⅱ級29例。觀察組男25例,女20例;年齡54~75(65.30±6.06)歲;體重50~77(63.89±4.02)kg;ASA分級:Ⅰ級17例,Ⅱ級28例。2組性別、年齡、體重、ASA分級比較差異無統計學意義(P>0.05),具有可比性。
1.2方法 麻醉誘導前30 min,觀察組給予注射用帕瑞昔布鈉(輝瑞制藥有限公司,國藥準字J20080045)40 mg靜脈注射,對照組給予等量生理鹽水靜脈注射。2組術前30 min均給予苯巴比妥鈉0.1 g、阿托品0.5 mg肌內注射,并常規監測患者的血壓、心率(HR)等。于T6~7間隙行硬膜外腔穿刺置管,置管后注入1%利多卡因注射液3 ml,并于5 min后測試麻醉平面;給予咪達唑侖0.05 mg/kg、芬太尼3 μg/kg、維庫溴銨0.08 mg/kg、丙泊酚 1.5 mg/kg行麻醉誘導。切開皮膚前靜脈注射芬太尼4~8 μg/kg,術中每隔1~1.5 h硬膜外腔注入2.5 ml/L的羅哌卡因5 ml,持續靜脈輸注丙泊酚3~6 mg/(kg·h)以及維庫溴銨0.05~0.08 mg/(kg·h)。2組氣管插管后接麻醉機行間歇正壓通氣,多功能監測儀連續監測生命體征,維持呼吸與循環的穩定,并于手術結束前30 min,給予芬太尼50 μg靜脈注射;待患者蘇醒后,給予電子鎮痛泵行靜脈自控鎮痛(枸櫞酸舒芬太尼2 μg/kg加入生理鹽水至100 ml)負荷量為10 ml,背景劑量為2 ml/h,每次自控追加劑量為0.5 ml,鎖定時間15 min。
1.3觀察指標 對比2組入室后靜臥5 min(T0)、帕瑞昔布或生理鹽水注射即刻(T1)、插管前(T2)、插管后(T3)、手術切皮時(T4)、手術結束后(T5)、術后2 h(T6)、術后12 h(T7)、術后24 h(T8)、術后48 h(T9)不同時間點的臨床指標變化。
1.3.1應激反應:記錄2組T0、T1、T2、T3、T4、T5時間點HR與平均動脈壓(MAP)水平。
1.3.2術后鎮痛情況:于T6、T7、T8、T9時間點通過視覺模擬評分法(VAS)[5]評價術后疼痛,該量表將疼痛用0~10表示,0代表無痛感,10代表痛感最強。患者依照自身疼痛狀態,從11個數字中選擇1個數字代表疼痛程度;0分代表無痛,≤3分代表痛感輕微,尚可忍受,不影響到睡眠狀態;4~6分代表疼痛較嚴重,影響到睡眠,但仍可忍受;7~10分代表強烈痛感,甚至影響到食欲與睡眠,達到難以忍受的程度。比較2組術后舒芬太尼用量。
1.3.3T淋巴細胞亞群:分別于T6、T7、T8、T9時抽取2組外周靜脈血,真空采血管抗凝處理,常溫下離心處理10 min,轉速為3000 r/min,流式細胞儀測定CD4+、CD8+、CD4+/CD8+水平。
1.3.4蘇醒質量:記錄2組意識恢復時間、自主呼吸恢復時間、清醒時間、拔管時間。
1.3.5不良反應:比較2組術后心動過緩、惡心、咳嗽、躁動發生情況。
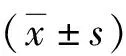
2 結果
2.1血液動力學指標比較 2組T0、T1、T2、T3、T4、T5時HR、MAP水平比較差異無統計學意義(P>0.05)。見表1。
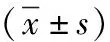
表1 2組食管癌根治術患者不同時間點血液動力學指標比較
2.2VAS評分與術后舒芬太尼用量比較 觀察組T6、T7、T8時VAS評分低于對照組(P<0.05),2組T9時VAS評分比較差異無統計學意義(P>0.05)。觀察組T8、T9時術后舒芬太尼用量均少于對照組(P<0.05)。見表2。
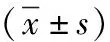
表2 2組食管癌根治術患者術后不同時間點VAS評分與術后舒芬太尼用量比較
2.3T淋巴細胞亞群水平比較 觀察組T6、T7、T8、T9時的CD4+、CD4+/CD8+水平高于對照組(P<0.05);2組T6、T7、T8、T9時CD8+水平比較差異無統計學意義(P>0.05)。見表3。
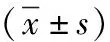
表3 2組食管癌根治術患者不同時間點T淋巴細胞亞群水平比較
2.4蘇醒質量比較 2組意識恢復時間、自主呼吸恢復時間、清醒時間、拔管時間比較差異無統計學意義(P>0.05)。見表4。

表4 2組食管癌根治術患者蘇醒情況比較
2.5不良反應發生情況比較 2組不良反應總發生率比較差異無統計學意義(P>0.05)。見表5。

表5 2組食管癌根治術患者不良反應發生情況比較
3 討論
我國食管癌發病率高但缺乏大規模食管癌篩查,因此該病早期確診存在一定困難。食管癌首選手術治療,現階段腔鏡手術因為切口小、術后恢復快的優勢被廣泛應用于臨床[6-7]。超前鎮痛指在傷害性刺激對機體造成傷害之前,采取抑制手段,減少手術對機體造成的影響。近年來超前鎮痛被廣泛應用于各類手術治療;疼痛帶來的不良反應及免疫抑制也可通過超前鎮痛有效抑制,可進一步削弱炎癥反應,加快患者術后恢復[8]。既往臨床多采用阿片類藥物進行超前鎮痛,雖鎮痛效果較好,但伴隨著大量呼吸抑制、惡心嘔吐、皮膚瘙癢等不良反應,引起患者術后不適,降低了醫療質量[9]。與此同時,阿片類藥物有成癮性,大量使用可引起藥物依賴性。常規的非甾體類藥物雖具有抗炎鎮痛的作用,但也可帶來胃腸道與呼吸道的不良反應,臨床應用受限。帕瑞昔布作為COX-2選擇性抑制劑,可通過抑制COX-2 活性來阻斷花生四烯酸向前列腺素(PG)轉化,發揮抗炎鎮痛效果[10]。帕瑞昔布鈉起效快、鎮痛效果持久,單次靜脈注射40 mg后7~13 min 即出現鎮痛作用,并在2 h內達到最大效果;帕瑞昔布鈉單次給藥鎮痛時間長達6 h以上,效果優于嗎啡等藥物[11-13]。
目前關于帕瑞昔布鈉超前鎮痛術后鎮痛效果研究較多,但觀點不盡相同。任磊等[14]研究報道,帕瑞昔布鈉超前鎮痛可以減少術后嗎啡用量,患者疼痛程度相對較低。本研究結果顯示,2組MAP和HR比較差異無統計學意義,觀察組T6、T7、T8時VAS疼痛評分低于對照組,T8、T9時術后舒芬太尼用量均少于對照組,與其研究結果一致。帕瑞昔布鈉超前鎮痛在減少阿片類藥物用量的同時具有較好的鎮痛效果,體現了術后多模式鎮痛的優越性。分析其可能機制為:帕瑞昔布鈉具有細胞膜穩定作用,可以抑制病理性COX,從而減少PG的釋放,PG介導的化學或機械感受器增敏性也被抑制,從而實現預防中樞與外周敏感化,實現超前鎮痛[15-16]。另外,帕瑞昔布鈉可將機體內大量花生四烯酸轉變為脂氧化酶產物,增強阿片類藥物中鉀通道功能,放大阿片類藥物鎮痛作用[17]。帕瑞昔布鈉與阿片類藥物可協同鎮痛,可減少術后阿片類藥物用量且鎮痛效果好。
依照免疫學研究結果表明,組織受損時,巨噬細胞、單核細胞、成纖維細胞、血管內皮細胞等多種細胞均被激活[18]。細胞免疫在機體抗炎與抗腫瘤中具有重要價值,T淋巴細胞是細胞免疫中的重要成員,不同亞群數量及功能的異常可能會對細胞免疫功能造成嚴重影響[19]。CD4+為輔助性T細胞,CD8+ 為抑制性T細胞,正常情況下CD4+/CD8+處于動態平衡狀態,麻醉及手術操作可造成原本免疫平衡被破壞,直接表現為CD4+/CD8+水平降低[20-21]。本研究結果顯示,觀察組T6、T7、T8、T9時CD4+、CD4+/CD8+水平高于對照組,提示帕瑞昔布超前鎮痛聯合胸段硬膜外鎮痛對免疫功能具有一定的保護作用,有利于患者預后。帕瑞昔布不對芬太尼或舒芬太尼的藥物動力學造成明顯影響,不影響丙泊酚等藥物的藥效特性。本研究結果同時顯示,2組術后清醒時間及術后麻醉相關不良反應發生率比較差異無統計學意義,說明帕瑞昔布鈉對COX-1不具備抑制作用,因此對患者的胃腸道黏膜及凝血功能均不造成明顯影響,不會增加相關不良反應的發生,安全性較高。
綜上所述,帕瑞昔布超前鎮痛聯合胸段硬膜外鎮痛可有效減輕術后T淋巴細胞亞群下降的程度,加強術后鎮痛效果,安全性較高。

