宮頸癌組織lncRNA FOXD2-AS1、miR-506-5p表達變化及其臨床意義
李敏,趙妍麗,杜國波
川北醫學院附屬醫院,四川南充637000
宮頸癌是女性第四大常見惡性腫瘤,全球每年新發病例約52.8萬例,死亡達26.6萬例[1]。隨著宮頸癌篩查手段和技術不斷提高,部分患者能夠得以早期診斷和治療,但在中低收入國家宮頸癌的發病率和病死率仍然較高[2]。目前,宮頸癌發病的分子機制尚不明確。因此,深入探索與宮頸癌發病相關的分子,尋找潛在的診斷標志物和治療靶點具有重要意義。近年研究發現,細胞內無蛋白編碼功能的非編碼RNA分子有可能通過調控基因的表達,進而參與人類多種疾病的發生、發展,有望成為疾病的診斷標志物和治療靶點[3]。長鏈非編碼RNA(lncRNA)FOXD2-AS1基因定位于人染色體1p33,是一種與惡性腫瘤相關的lncRNA。lncRNA FOXD2-AS1通過與其他非編碼RNA分子結合,從而對基因的表達進行精細調控,繼而參與細胞的生長、發育、分化及物質代謝等過程[4]。近年有研究報道,lncRNA FOXD2-AS1在喉癌、食管癌組織中均存在異常表達現象;lncRNA FOXD2-AS1可能通過影響β-鈣黏素、Akt、E2F轉錄因子1等下游癌基因表達,促進腫瘤細胞惡性增殖和遷移[5-6]。miR-506-5p編碼基因定位于人染色體Xq27.3,其能與下游基因信使RNA的3′非翻譯區結合,通過改變信使RNA的穩定性而調控基因的表達,繼而影響細胞增殖、凋亡等生物學過程[7]。LI等[8]研究發現,miR-506-5p具有抑癌基因作用,其在乳腺癌、肺癌組織中低表達,通過上調細胞增殖相關基因的表達,如細胞周期素激酶4、Ras,導致腫瘤惡性進展。但目前lncRNA FOXD2-AS1、miR-506-5p表達與宮頸癌的關系尚不清楚。2015年4月—2016年4月,本研究分析了宮頸癌組織lncRNA FOXD2-AS1、miR-506-5p表達變化并探討其臨床意義。現報告如下。
1 資料與方法
1.1 臨床資料 以同期川北醫學院附屬醫院診治的91例宮頸癌患者為研究對象。納入標準:①經組織病理學檢查明確診斷為宮頸癌;②接受根治性子宮切除術或改良根治性子宮切除術;③入院前未行放化療、免疫或生物治療。排除標準:①合并其他宮頸疾病者;②既往有其他器官或系統腫瘤史者;③伴心、肺、腎等臟器功能衰竭者。患者年齡30~72(45.2±7.1)歲,其中≥45歲42例、<45歲49例;病理類型:腺癌13例,鱗癌78例;FIGO分期[9]:Ⅰ、Ⅱ期50例,Ⅲ期41例;組織分化程度:低分化31例,高中分化60例;浸潤深度:深肌層52例,淺肌層39例;淋巴結轉移:有53例,無38例。本研究符合《赫爾辛基宣言》,經川北醫學院附屬醫院倫理委員會審核,患者或其家屬知情同意并簽屬知情同意書。
1.2 lncRNA FOXD2-AS1、miR-506-5p表達檢測 取宮頸癌組織與癌旁組織(距腫瘤組織邊緣>2 cm且經組織病理檢查明確為正常宮頸組織),-80 ℃冰箱保存。待組織成批后,分別取50 mg,TRIzol法提取總RNA,經NanoDrop 2000超微量分光光度計鑒定,提取的總RNA濃度、純度和完整性符合后續實驗要求。然后將總RNA反轉錄為cDNA,-20 ℃保存。反轉錄條件:37 ℃ 1 h,85 ℃ 5 s。以cDNA為模板進行PCR擴增。引物序列由北京睿博科技有限公司設計合成。lncRNA FOXD2-AS1上游引物5′-AATGGACAGAAGCTATCCAGGC-3′、下游引物5′-AGTTGAAGGTGCACACACTG-3′,miR-506-5p上游引物5′-CCTTGGCACCCTTCTGTAGA-3′、下游引物5′-TGATGGGTTGTAGAGGCATCC-3′,內參U6上游引物5′-GCGAGATCGCACTCATCATCT-3′、下游引物3′-TCAGTGGTGGACCTGACC-5′。lncRNA FOXD2-AS1 PCR擴增體系20 μL:SYBR Green preMix 10 μL,上下游引物各0.5 μL,cDNA模板1 μL,ddH2O 8 μL;反應條件:95 ℃ 5 min,95 ℃ 30 s、60 ℃ 20 s、70 ℃ 20 s共40個循環。miR-506-5p PCR擴增體系20 μL:SYBR Green preMix 10 μL,上下游引物各1 μL,cDNA模板1 μL,ddH2O 7 μL;反應條件93 ℃ 15 min,93 ℃ 30 s、58 ℃ 20 s、72 ℃ 40 s共40個循環。收集各樣本閾值循環數(CT)值。以U6為內參,以2-ΔΔCT計算目的基因相對表達量。
1.3 隨訪 以獲得病理診斷結果作為隨訪起點,隨訪方式采取門診復查形式,每3個月隨訪1次,隨訪截至2019年4月。以隨訪期間患者死亡或至隨訪截至時間為隨訪終點,統計患者生存情況。
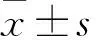
2 結果
2.1 宮頸癌組織與癌旁正常組織lncRNA FOXD2-AS1、miR-506-5p表達比較 宮頸癌組織與癌旁正常組織lncRNA FOXD2-AS1相對表達量分別為1.117±0.305、0.924±0.297,miR-506-5p相對表達量分別為1.213±0.311、1.742±0.321。與癌旁正常組織相比,宮頸癌組織lncRNA FOXD2-AS1表達升高,miR-506-5p表達降低(t分別為4.325、11.291,P均<0.01)。
2.2 宮頸癌組織lncRNA FOXD2-AS1表達與miR-506-5p表達的關系 相關分析顯示,宮頸癌組織lncRNA FOXD2-AS1表達與miR-506-5p表達呈顯著負相關關系(r=-0.621,P<0.01)。
2.3 宮頸癌組織lncRNA FOXD2-AS1、miR-506-5p表達與患者臨床病理特征的關系 見表1。

表1 宮頸癌組織lncRNA FOXD2-AS1、miR-506-5p表達與患者臨床病理特征的關系
2.4 宮頸癌組織lncRNA FOXD2-AS1、miR-506-5p表達與患者預后的關系 所有患者隨訪3~48個月,中位隨訪時間31.3個月,隨訪期間死亡34例。以宮頸癌組織lncRNA FOXD2-AS1相對表達量的平均數(1.101)為截斷值,將患者分為lncRNA FOXD2-AS1高表達者46例、lncRNA FOXD2-AS1低表達者45例。lncRNA FOXD2-AS1高表達者3年總生存率為34.6%(15/46),lncRNA FOXD2-AS1低表達者為82.5%(37/45)。lncRNA FOXD2-AS1高表達者3年總生存率低于lncRNA FOXD2-AS1低表達者(χ2=22.864,P<0.05)。見圖1a。
以宮頸癌組織miR-506-5p相對表達量的平均數(1.245)為截斷值,將患者分為miR-506-5p高表達者47例、miR-506-5p低表達者44例。miR-506-5p高表達者3年總生存率為78.7%(37/47),miR-506-5p低表達者3年總生存率為34.1%(15/44)。miR-506-5p高表達者3年總生存率高于miR-506-5p低表達者(χ2=18.485,P<0.05)。見圖1b。

圖1 宮頸癌組織不同lncRNA FOXD2-AS1、miR-506-5p表達者的生存曲線
3 討論
我國每年宮頸癌新發病例約13.2萬例,死亡達5.3萬例,已成為當前嚴重威脅我國女性健康的重要疾病之一[10]。宮頸癌早期通過手術、放化療等手段即可獲得良好的治療效果,但對于局部晚期或復發、轉移患者,治療效果較差。近年來,隨著分子生物學技術不斷發展,靶向治療逐漸應用于臨床并初見成效。但由于宮頸癌發病的分子機制目前還不清楚。因此,探索宮頸癌發病的分子機制,尋找新的診斷標志物和治療靶點具有重要的臨床價值。
lncRNA是由200~300個核苷酸組成的單鏈RNA分子,能夠與蛋白質、非編碼RNA等結合形成復合物,使特定的基因激活或失活,或通過分子支架結合細胞內其他分子,從而調控靶基因的表達,繼而參與個體發育、衰老等生物學過程。有研究報道,lncRNA異常表達是腫瘤發生、發展的分子基礎。lncRNA FOXD2-AS1的編碼基因位于人染色體1p33。CHEN等[11]研究報道,lncRNA FOXD2-AS1在胃癌組織中表達上調,lncRNA FOXD2-AS1可通過影響下游癌基因表達,如β-鈣黏素、Akt、E2F1等,促進腫瘤細胞的惡性增殖。本研究發現,宮頸癌組織lncRNA FOXD2-AS1表達明顯上調,表明lncRNA FOXD2-AS1可能參與宮頸癌的發生、發展。目前lncRNA FOXD2-AS1的促癌機制尚不清楚,可能與促進lncRNA FOXD2-AS1表達的轉錄因子表達升高有關。有研究報道,lncRNA FOXD2-AS1表達受E2F1調控,E2F1能夠結合到lncRNA FOXD2-AS1的啟動子區域,并促進其表達[12]。進一步研究發現,宮頸癌組織lncRNA FOXD2-AS1表達與腫瘤FIGO分期、組織分化程度有關,表明lncRNA FOXD2-AS1異常表達能夠參與宮頸癌的惡性進展,其機制可能是lncRNA FOXD2-AS1參與活化Notch信號通路,導致腫瘤細胞上皮間質轉化,提高腫瘤細胞的增殖和遷移能力,而敲除lncRNA FOXD2-AS1后腫瘤細胞的增殖和遷移能力明顯下降[13]。本研究還發現,lncRNA FOXD2-AS1高表達者3年總生存率低于lncRNA FOXD2-AS1低表達者。提示lncRNA FOXD2-AS1表達上調可導致宮頸癌患者預后不良,有希望成為預測患者預后的分子標志物。
miRNA是一類長度為19~23個核苷酸的非編碼RNA分子,在結構上具有典型的短發夾結構,能夠調控細胞發育、分化、凋亡等生物學過程。miRNA基因首先在RNA聚合酶的作用下轉錄為初始miRNA,進而在RNA聚合酶Ⅱ的作用下形成miRNA前體,然后在Dicer酶的作用下轉化為成熟miRNA,通過形成RNA誘導沉默復合物與靶基因信使RNA特異性結合,在轉錄后水平調控靶基因的表達。近年研究發現,腫瘤組織中存在多種miRNA異常表達現象,并且相同的miRNA在不同腫瘤組織中發揮的生物學作用可能不同[5-7]。miR-506-5p的編碼基因定位于人染色體Xq27.3。有研究表明,miR-506-5p在乳腺癌、肺癌組織中低表達;在體外基礎研究中證實,上調miR-506-5p表達能夠抑制腫瘤細胞增殖、侵襲、遷移等生物學行為[8]。因此,miR-506-5p可作為一種抑癌基因,其在腫瘤組織中低表達可促進乳腺癌和肺癌的發生、發展。本研究發現,宮頸癌組織miR-506-5p表達降低,表明miR-506-5p可能參與宮頸癌的發病,其機制與腫瘤發生時miR-506-5p基因的啟動子區域甲基化沉默有關。有研究報道,miR-506-5p在腫瘤中發揮抑癌基因作用,其啟動子區的表觀遺傳學修飾導致其表達顯著降低,而其下游癌基因表達則顯著升高[14]。進一步研究發現,FIGO分期高、組織分化程度低的宮頸癌患者腫瘤組織miR-506-5p表達較低。提示miR-506-5p異常低表達與宮頸癌的惡性進展有關,其機制可能是腫瘤發生時miR-506-5p表達降低,導致CDK4表達升高,促進腫瘤細胞周期G1期向S期轉換,導致腫瘤細胞獲得無限增殖的潛能[15]。本研究分析了miR-506-5p表達與宮頸癌患者預后的關系,結果發現miR-506-5p低表達的宮頸癌患者3年總生存率較低,提示miR-506-5p低表達與宮頸癌患者預后不良有關。早期檢測宮頸癌組織miR-506-5p表達有助于判斷患者預后。
王婷等[16]研究發現,lncRNA FOXD2-AS1能夠作為分子支架結合miR-506-5p并抑制miR-506-5p表達和生物學功能,從而促進腫瘤細胞增殖并抑制其凋亡,繼而促進腫瘤惡性進展。本研究還發現,在宮頸癌組織中lncRNA FOXD2-AS1表達與miR-506-5p表達呈負相關關系,提示在宮頸癌中lncRNA FOXD2-AS1可能通過負向調控miR-506-5p參與腫瘤的發生、發展。
綜上所述,宮頸癌組織lncRNA FOXD2-AS1高表達、miR-506-5p低表達,二者表達呈負相關關系;宮頸癌組織lncRNA FOXD2-AS1、miR-506-5p表達與腫瘤FIGO分期、組織分化程度和患者預后有關,但二者能否成為宮頸癌早期診斷的生物標志物和治療的潛在靶點仍需深入研究。

