山茱萸籽粕亞臨界水降解動力學及多糖性質研究
何坤明,陳蘭轉,孫光友,譚旺橋,白新鵬,*
(1.海南大學食品科學與工程學院,熱帶多糖資源利用教育部工程研究中心,海南海口 570228;2.海南雅葆天維實業股份有限公司,海南海口 570000;3.海南大白康健醫藥股份有限公司,海南海口 570000)
山茱萸(CornusofficinalisSieb.et Zucc.)屬于山茱萸科山茱萸屬植物,產于河北、河南等地。山茱萸果肉中含有山萸甙、沒食子酸、皂甙、熊果酸等活性成分,維生素、氨基酸和礦物質種類也十分豐富,應用于六味地黃丸的研制[1]。山茱萸籽是山茱萸果剝去山茱萸果肉剩下的果核,其栲膠、油脂、蛋白、糖類物質含量相當豐富[2-4]。
近年來植物多糖已成為實驗研究的熱點,多糖提取、純化[5-6]及抗氧化、抗腫瘤[7]等研究較多。山茱萸籽中的糖類物質相當豐富,大量的山茱萸籽中的糖類物質未得到合理的利用,造成植物多糖資源的浪費;廢物資源再利用一方面可以獲得多糖等副產品,一方面促進種植戶增收。故本實驗對山茱萸籽多糖進行提取,并對其理化性質進行研究。
多糖提取是基于相似相溶原理將多糖從生物體里分離出來的過程。常用的多糖提取方法有水提取法[8]、超聲波輔助提取法[9]、酸堿提取法等。水提取法提取率低、耗時長,酸堿提取法則易破壞多糖的空間結構及其生物活性[10]。而亞臨界水提取法則具有綠色環保、得率高、省時、產物結構穩定等優點。
亞臨界水是指溫度在沸點和臨界溫度之間,維持在適當壓力狀態的水[11]。亞臨界水提取技術作為一種新型綠色提取技術,目前在多糖、多酚、黃酮和花青素等天然產物提取得到廣泛應用[12]。杜曉靜等[13]利用亞臨界水降解脫脂椰蓉制備可溶性膳食纖維發現,與酶-化學法、超聲-化學法對比,亞臨界水提取具有較高的得率。李振梅等[14]利用亞臨界水同步提取茶籽油及茶皂素的工藝,通過氣相色譜-質譜法分析發現,與索氏提取法相比,實驗提取的茶籽油不飽和脂肪酸含量更高,表明亞臨界水法提取的茶籽油品質更優,進一步證實了亞臨界水提取裝置的高效性。馬若影等[15]利用亞臨界水提取紅心火龍果莖多糖發現,對比超聲輔助法提取紅心火龍果莖多糖,亞臨界水提取多糖具有得率高、省時等優點。
本研究以山茱萸籽粕為原料,建立山茱萸籽粕亞臨界水降解動力學模型,得到降解動力學參數,通過亞臨界水提取,進一步分離得山茱萸籽多糖,對其理化性質、形態、結構組成、抗氧化活性等方面進行了初步研究,為山茱萸籽的綜合開發利用提供參考。
1 材料與方法
1.1 材料與儀器
山茱萸籽 購于河南南陽(西峽縣山茱萸種植基地,2018年10月);無水乙醇、葡萄糖、碳酸鈉、石油醚 西隴科學股份公司;沒食子酸、濃硫酸、苯酚 廣州化學試劑廠;福林酚試劑 北京索萊寶科技有限公司;以上試劑均為分析純。
HT-250FC型亞臨界水設備 上海霍桐實驗儀器有限公司;GL-20G-11型高速冷凍離心機 上海安亭科學儀器廠;752N型紫外可見分光光度計 上海儀電分析儀器有限公司;FDU-2100型冷凍干燥機 埃朗科技國際貿易(上海)有限公司;Agilent1100高效液相色譜儀,配DAD檢測器 安捷倫科技有限公司。
1.2 實驗方法
1.2.1 山茱萸籽粕成分測定 山茱萸籽80 ℃烘干、粉碎過60目篩,索氏提取脫脂得山茱萸籽粕,干燥器中保存備用。
水分測定:GB 5009.3-2010,灰分測定:GB 5009.4-2016,纖維素、半纖維素、木質素測定:范式Van Soest分析法[16]。
1.2.2 亞臨界水降解山茱萸籽粕實驗研究 精確稱取山茱萸籽粕5.0 g,量取200 mL蒸餾水,放入亞臨界反應釜中,按照設定的降解溫度、降解時間,對山茱萸籽粕進行亞臨界水降解,降解結束,迅速用冰塊冷卻至常溫,抽濾得殘渣和液態產物,殘渣烘干干燥器保存備用,液態產物于棕色試劑瓶保存備用。
考察不同降解溫度(100、120、140、160、180、200 ℃)和不同降解時間(5、10、20、30、40、50 min)的條件下,固定單因素條件為160 ℃、降解時間20 min,對山茱萸籽粕亞臨界水降解還原糖產率進行實驗研究。
1.2.3 液態產物中還原糖產率測定 采用3,5-二硝基水楊酸法[17]測定液態產物中還原糖濃度,以葡萄糖為標準品,在波長540 nm處測定液態產物的吸光度值,標準曲線為y=11.014x+0.0373(決定系數R2=0.9948,線性范圍在0~0.10 μg/mL)。其還原糖產率計算公式如下:
式(1)
式中:C為還原糖濃度(g/L);m0為山茱萸籽粕中半纖維素含量(g);V為液態產物總體積(mL);n為稀釋倍數。
1.2.4 動力學模型建立 目前,國內外研究學者采用Saeman模型對木質纖維素類進行亞臨界水降解實驗研究[18-20],主要反應過程如下:
半纖維素→低聚糖→單糖→降解物
本實驗探究山茱萸籽粕在亞臨界水中其纖維素、半纖維素類物質降解為小分子還原糖,最終得到降解產物。在動力學方程中,還原糖的量為水解糖的總量,建立一級連串均相反應模型。
山茱萸籽粕(h)→還原糖(s)→降解物(d)
式(2)
式(3)
式中:k1為山茱萸籽粕降解為還原糖的反應速率常數(min-1);k2為還原糖分解的反應速率常數(min-1);Ch為山茱萸籽粕半纖維素濃度(g/L);Cs為山茱萸籽粕還原糖濃度(g/L)。設t=0時,Cs為0,對式(2)和(3)進行積分得:
Ch=Ch0exp(-k1t)
式(4)
式(5)
1.2.5 動力學參數的確定 將山茱萸籽粕降解實驗數據Ch、Cs、Cd代入式(6),通過曲線擬合求解得出100、120、140、160、180、200 ℃的速率常數k1和k2,將k1和k2數值代入Arrhenius方程[21]:
式(6)
式中,Ch0代表山茱萸籽粕降解前的半纖維素濃度(g/L)。
式(7)
式中:Ki0為指前因子(min-1);T為降解溫度(K);R為氣體常數;Eai為反應活化能(kJ/mol)。
式(7)取對數得:lnki=lnki0-Eai/(RT),可以看出lnki與T-1是線性關系,對lnki與T-1作一條擬合的直線,得到擬合直線方程,方程的截距為Ki0,斜率為Eai。
1.2.6 山茱萸籽粕殘渣形態、轉化率及液態產物pH變化 為進一步分析判斷山茱萸籽粕亞臨界水降解程度,對山茱萸籽粕殘渣形態、轉化率及液態產物pH變化進行觀察、測定。采用電鏡掃描觀察在降解溫度100、120、140、160、180、200 ℃及降解時間5、10、20、30、40、50 min降解后殘渣形態的變化,并計算其轉化率。液態產物pH測定采用pH計。
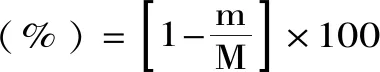
式(8)
式中:m為降解后殘渣質量(g);M為原料質量(g)
1.2.7 液態產物山茱萸籽多糖單糖組成分析 取液態產物濃縮至原體積1/5左右,加入4倍體積的無水乙醇,4 ℃放置12 h,6000 r/min離心5 min,沉淀冷凍干燥得到山茱萸籽多糖[22]。
稱取10 mg多糖樣品于20 mL的鉗口瓶中,加入5 mL的2 mol/L TFA,充N2封管(10 L/min,1 min),100 ℃烘箱中水解2 h;冷卻后打開蓋,取1 mL水解液加入1 mL甲醇后,70 ℃水浴下用N2吹干,如此重復加甲醇并用N2吹干2次,以去除TFA;加入1 mL NaOH(0.3 mol/L)充分溶解殘渣,為多糖水解液,稀釋后衍生測定。
游離單糖的提取:稱取多糖干樣0.4 g、多糖濕樣1.5 g于具塞刻度管中,加入10 mL 80%乙醇,70 ℃下超聲提取30 min;10000 r/min離心,取上清液用80%乙醇定容至10 mL,然后取2 mL加入試管N2吹干,之后加入1 mL NaOH(0.3 mol/L)溶解殘渣。
單糖衍生化:分別取400 μL的混合單糖標準液或多糖水解液于5 mL的具塞試管中,加400 μL PMP甲醇溶液,于70 ℃水浴2 h;取出放置至常溫;加400 μL HCl(0.3 mol/L)于混合液,至pH6~7;加蒸餾水1200 μL,再加等體積的氯仿溶液,渦旋混勻振搖,靜置,分離水相,重復2次以上。采用0.45 μm微孔膜(水系)過濾水相,然后供HPLC進樣分析。
色譜條件:色譜柱C18柱,250 mm×4.6 mm,粒度5 μm;流動相A:100 mmol/L 磷酸鈉緩沖液(pH=6.4);流動相B:乙腈;進樣量20 μL;檢測波長:250 nm;柱溫30 ℃;流速1 mL/min。
1.2.8 傅里葉紅外光譜分析 將山茱萸籽多糖和KBr按比例1∶40混合研磨,壓片機壓片。樣品測試前進行背景掃描去除干擾,500~4000 cm-1范圍內進行空白掃描。
1.2.9 掃描電鏡分析 取1 mg山茱萸籽多糖,粘在掃描電鏡樣品盤上,用吹塵球吹掉多余樣品,噴金,觀察樣品表觀結構。
1.2.10 抗氧化活性分析
1.2.10.1 DPPH自由基清除率測定 參考Vilma等[23]的方法,將3 mL乙醇溶解的DPPH(0.1 mmol/L)溶液加入到不同質量濃度(0、0.2、0.4、0.6、0.8和1.0 mg/mL)的2 mL多糖樣品溶液中。將溶液搖勻,避光水浴30 min,在517 nm處測定吸光值。
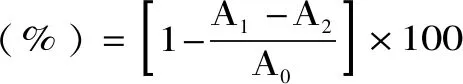
式(9)
式中,A1為樣品或VC+3 mL DPPH溶液的吸光值;A2為待測溶液+3 mL無水乙醇后的吸光值;A0為空白對照,2 mL的蒸餾水+3 mL DPPH溶液的吸光值。
1.2.10.2 羥自由基清除率測定 參考王新等[24]的方法,分別在2 mL不同質量濃度(0、0.2、0.4、0.6、0.8和1.0 mg/mL)多糖樣品溶液中加入1 mL FeSO4(6 mmol/L)溶液和1 mL H2O2(6 mmol/L),靜置10 min,然后加入1 mL無水乙醇(6 mmol/L)溶解的水楊酸,靜置反應30 min,在510 nm處測定吸光值。
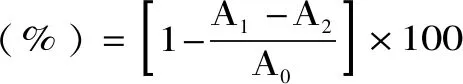
式(10)
式中,A1為樣品或者VC溶液反應后的吸光值;A2為待測溶液+2 mL蒸餾水+1 mL無水乙醇后的吸光值;A0為空白對照,即2 mL的待測溶液換為2 mL的蒸餾水后的吸光值。
1.2.10.3 ABTS自由基清除率測定 參考管瑛等[25-26]的方法,稱取0.384 g ABTS和0.066 g過硫酸鉀,蒸餾水溶解定容至100 mL,然后在室溫下避光靜置12 h。將10 mL ABTS溶液用0.01 mol/L pH7.4 PBS緩沖液稀釋50倍,使其在734 nm處的吸光度值約為0.7。將1 mL不同濃度的樣品溶液轉移到1 mL蒸餾水和2 mL稀釋的ABTS溶液中,搖勻,置于室溫黑暗中靜置6 min,然后在734 nm處測量吸收值。

表1 原料及殘渣的主要成分(%)
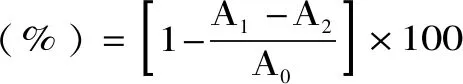
式(11)
式中:A1為樣品或者VC溶液與ABTS溶液反應后的吸光值;A2為待測溶液+3 mL蒸餾水的吸光值;A0為空白對照,即1 mL的待測溶液換為1 mL的蒸餾水后的吸光值。
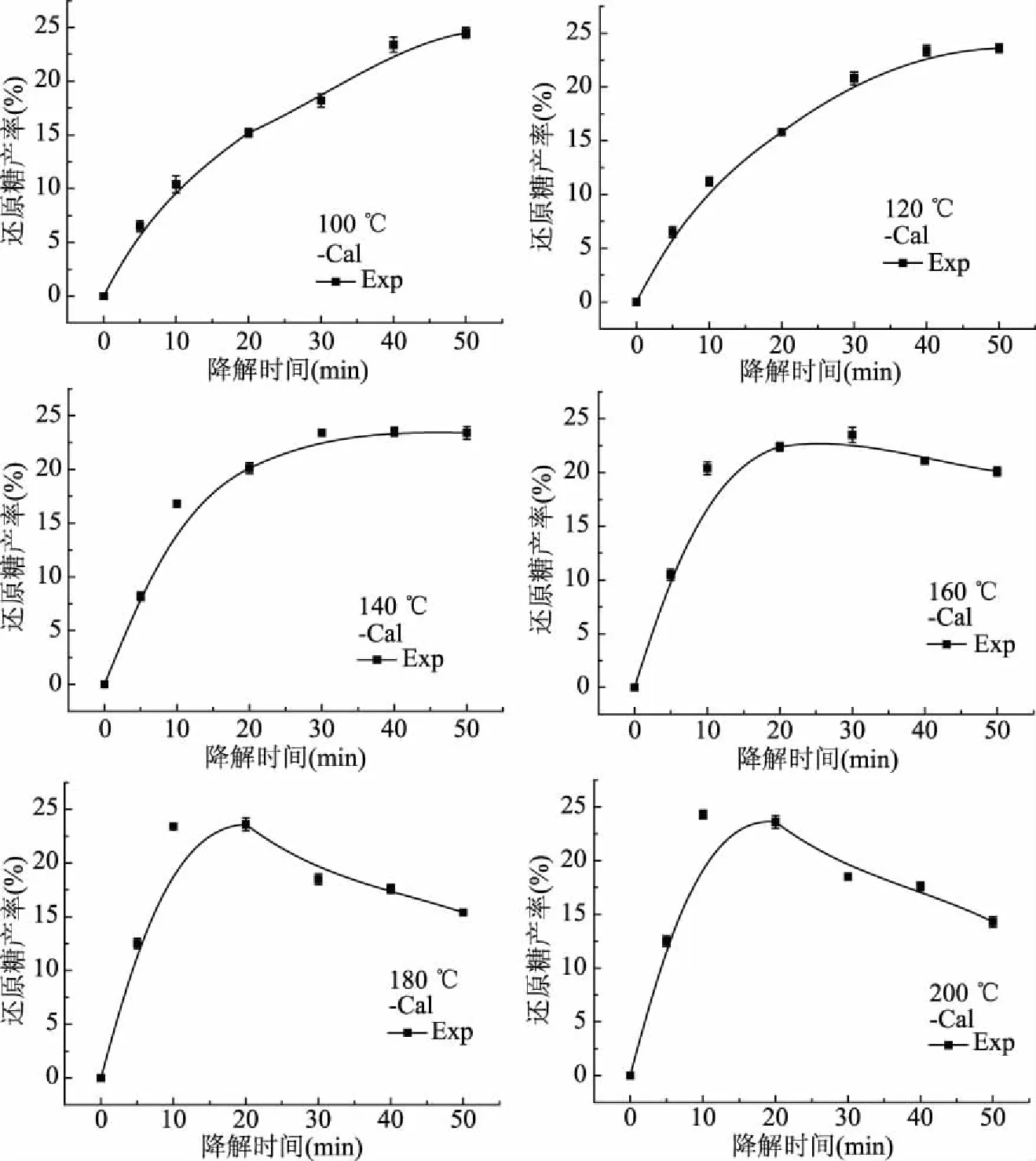
圖1 不同降解溫度下的還原糖產率
1.3 數據處理
采用Excel 2010軟件進行數據統計處理,所有數據為3次重復的平均值和標準差。采用Origin軟件進行繪圖。
2 結果與分析
2.1 原料及降解殘渣主要成分分析
利用范式分析法及國標測定原料(山茱萸籽粕)和160 ℃、20 min降解條件下的殘渣主要成分,結果如表1所示,由表1可知,本實驗降解的主要成分是半纖維素,原因是在亞臨界水條件下(160 ℃、20 min)引起山茱萸籽粕中半纖維素降解為還原糖。纖維素的質量分數由20.34%升至45.10%,原因可能是山茱萸籽粕在亞臨界水降解下,植物細胞壁等結構受到破壞,導致更多的纖維素裸露。
2.2 亞臨界水動力學參數的確定
不同降解溫度、降解時間下,實驗值(Exp)與模型計算值(Cal)見圖1,對于本實驗探究的降解溫度,實驗值與模型計算值較為接近,說明Saeman模型能很好解釋山茱萸籽粕亞臨界水降解過程,其半纖維素降解遵循一級連串降解反應動力學模型。在100、120、140 ℃降解溫度時,隨著時間延長,還原糖產率逐漸增大,當溫度在160 ℃以上時,還原糖產率隨著時間延長呈現先增大后降低趨勢。可能是在高溫狀態下,山茱萸籽粕中的半纖維素在短時間內大部分降解完畢,而還原糖產量下降可能是山茱萸籽粕中的半纖維素基本降解完全,此時的溫度又不足以打斷纖維素的糖苷鍵,因此還原糖生成量低于其降解量[27]。
由圖1可知,180和200 ℃溫度下,還原糖產率達到最大值時,時間太短,然后急劇下降。在100~160 ℃溫度中,相同時間內,160 ℃下還原糖產率較高,故選取降解溫度為160 ℃、降解時間為20 min。
將山茱萸籽粕降解的實驗數據代入式(6),通過擬合得到100~200 ℃下的k1和k2。結果如表2所示,其中R2為曲線擬合決定系數。
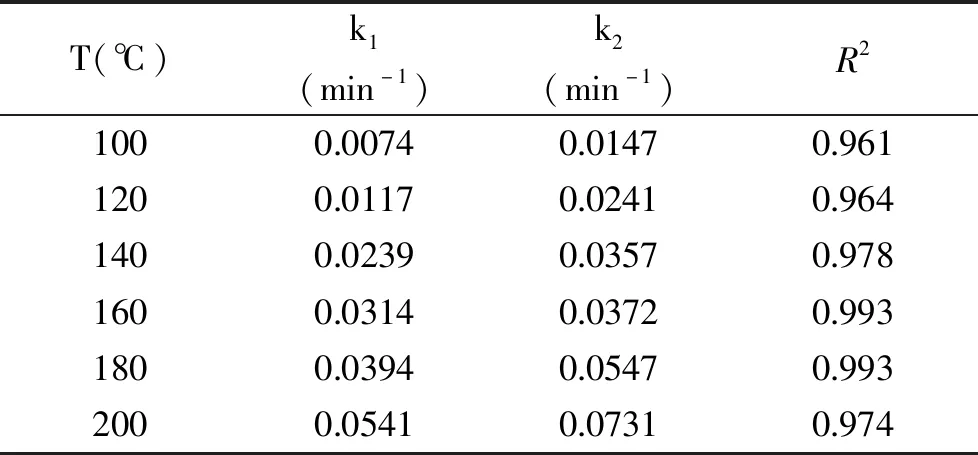
表2 山茱萸籽粕在不同溫度下亞臨界水降解的k1和k2值
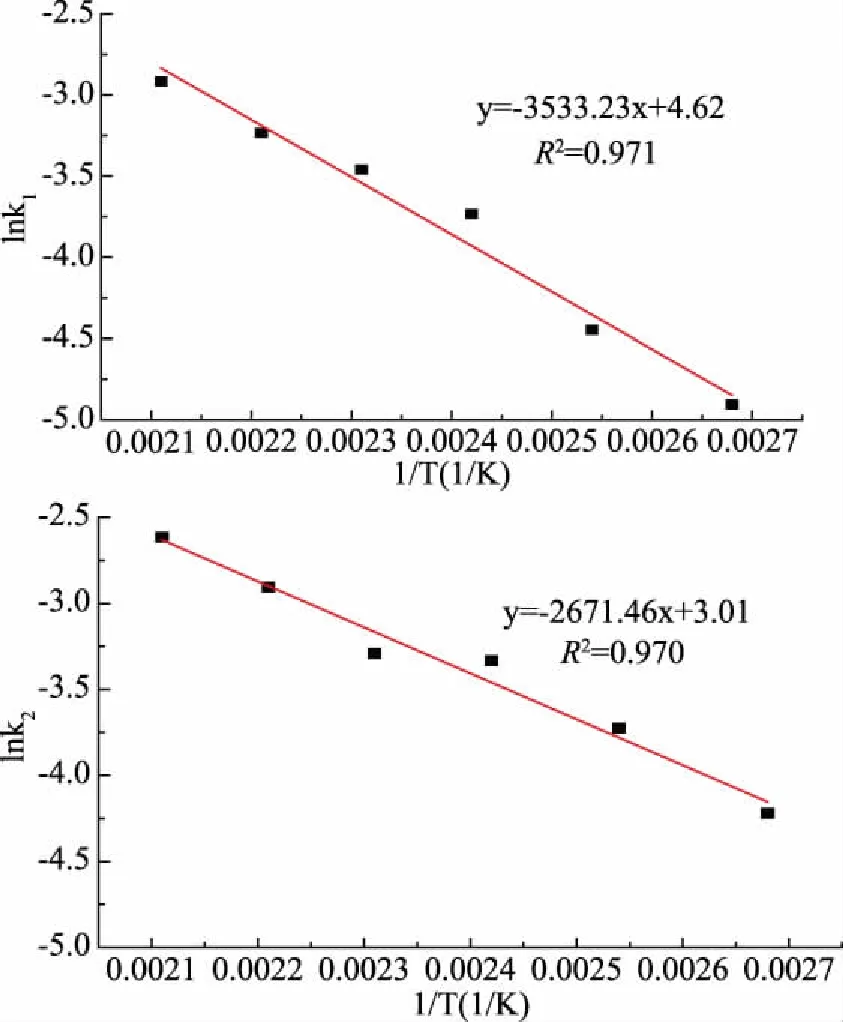
圖2 山茱萸籽粕亞臨界水降解lnk與1/T的關系
取擬合直線方程的截距和斜率分別用于求Ki0和Eai,結果如表3所示:

表3 山茱萸籽粕亞臨界水降解的指前因子和反應活化能
2.3 山茱萸籽粕殘渣形態變化
原料和在降解時間20 min條件下,不同降解溫度下的殘渣掃描電鏡變化如圖3可知,山茱萸籽粕原料堆疊呈無規則顆粒狀,粒徑大小不一的球狀結構物。經100 ℃降解后,結構表面呈多孔狀,覆蓋在表面的球狀物發生脫落,早期骨架形成。120 ℃降解后,殘渣結構出現片狀結構物,覆蓋在結構表面的球狀物完全脫落。140 ℃降解后,殘渣結構呈現多孔狀,但骨架較為緊湊。160~180 ℃降解后,殘渣結構開始出現疏松多孔狀,骨架也出現了斷裂,無規則狀。200 ℃降解后,殘渣結構連接物斷裂,呈稀碎、無規則堆積狀[28]。

圖3 原料和不同降解溫度下的殘渣掃描電鏡圖(2000×)
在降解溫度160 ℃、料液比為1∶40條件下,原料和不同降解時間下的殘渣掃描電鏡變化如圖4可知,與原料相比,不同降解時間,殘渣結構表觀各不相同,5 min時初步生成片狀物,球狀物出現脫落。10 min時骨架基本形成,架構較為緊密。20 min時球狀物基本完全脫落,呈現多孔狀,但骨架較為緊湊。30~50 min時骨架基本斷裂,呈稀碎、無規則堆積狀。

圖4 原料和不同降解時間下的殘渣掃描電鏡圖(2000×)
2.4 山茱萸籽粕轉化率的變化
為進一步分析判斷山茱萸籽粕亞臨界水降解程度,對其不同溫度、不同時間條件下的轉化率進行測定。由圖5可知,降解溫度、降解時間對山茱萸籽粕亞臨界水降解有著顯著的影響,不同溫度下的轉化率在剛開始時差異顯著的原因是在短時間內,隨著降解溫度升高,山茱萸籽粕亞臨界水降解程度增大,山茱萸籽粕結構被破壞程度增大,多糖、蛋白質等大分子發生更大程度溶出。當降解時間為5 min時,降解溫度由100 ℃提高到200 ℃,轉化率由35.20%提高到65.21%,轉化率提高了46.02%。當降解時間為50 min時,降解溫度由100 ℃提高到200 ℃,轉化率由44.90%提高到67.10%,轉化率提高了33.08%。原因可能是隨著降解溫度升高和降解時間延長,山茱萸籽粕空間結構發生變化,由原來堆疊緊密變為疏松多孔狀,其表面的球狀物多糖、蛋白質等分子溶出。
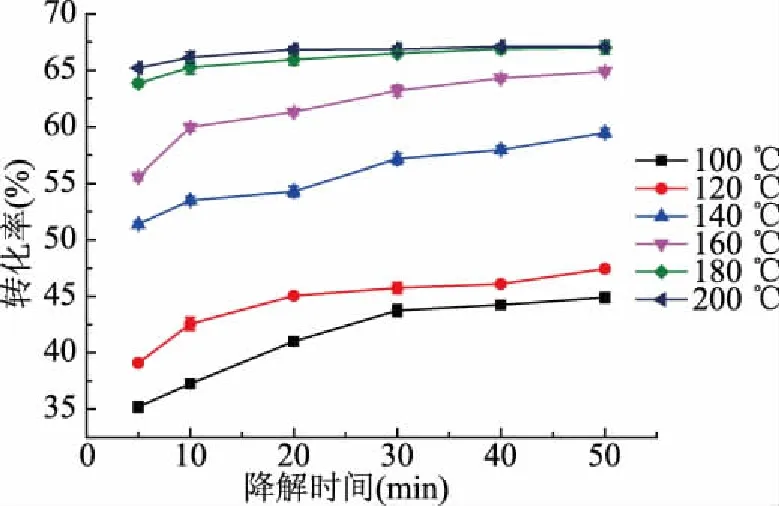
圖5 降解溫度和時間對山茱萸籽粕轉化率的影響
2.5 液態產物pH的變化
液態產物pH測定能進一步判斷山茱萸籽粕亞臨界水降解程度大小。由圖6可知,隨著降解時間的增長,液態產物pH逐漸下降,在前20 min內下降趨勢較顯著,20 min后下降趨勢較為平緩,甚至保持不變。降解溫度越高,pH下降趨勢越顯著,原因可能是在亞臨界水降解下,溫度越高,水分直接相互作用越強烈,從而加速催化降解速率,山茱萸籽粕結構被破壞程度增大,對應還原糖產率略微升高,半纖維素分解速率略微增大。pH下降原因與山茱萸籽粕的半纖維素中含有乙酰基團,反應初期水解產生大量乙酸有關[29-31]。
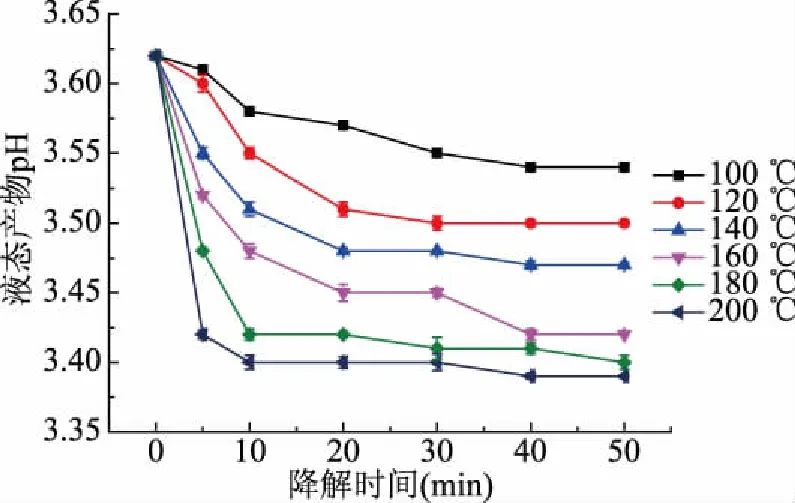
圖6 液態產物pH的變化
2.6 山茱萸籽多糖單糖組成
單糖組成的分析在植物多糖的結構與功效、中藥材的檢測與鑒定等方面有著十分重要的作用[32],為了進一步探究山茱萸籽多糖的結構與功效,對其多糖組成進行進一步分析。多糖標品的高效液相色譜圖見圖7。由表4和圖8可知,山茱萸籽多糖單糖組成中葡萄糖含量最高,含量達33.58%,其次是木糖,含量16.75%,半乳糖含量14.54%。
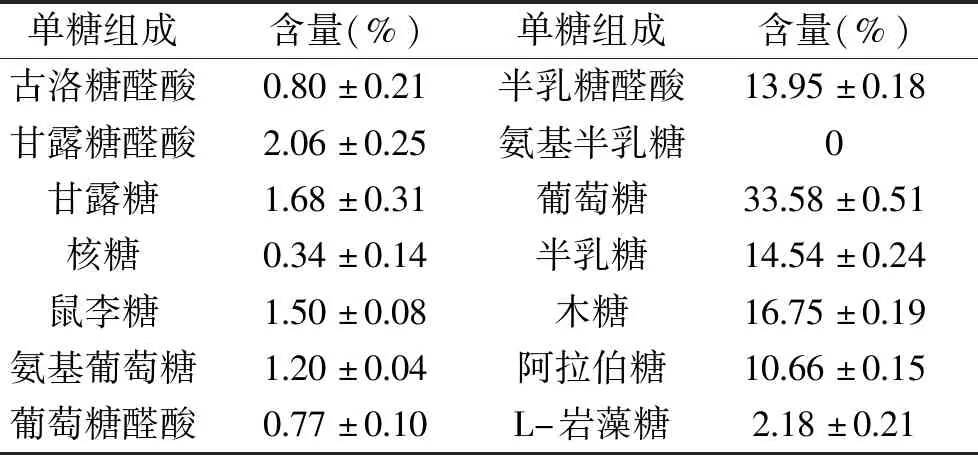
表4 山茱萸籽多糖的單糖組成
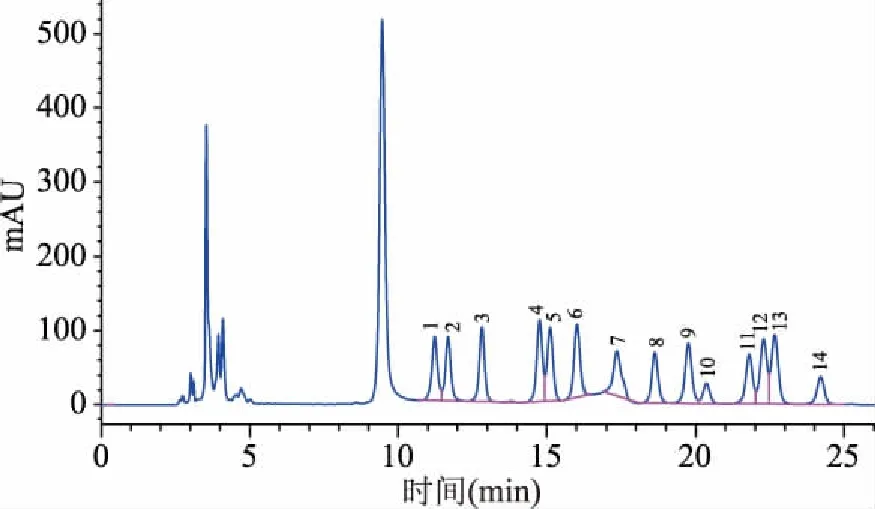
圖7 多糖標品的高效液相色譜圖
圖8 山茱萸籽多糖的單糖組成
2.7 傅里葉紅外光譜分析
從圖9可以看出,山茱萸多糖在4000~500 cm-1區域具有多糖吸收的一般特征。在3424 cm-1處,由于多糖間羥基的O-H伸縮振動,導致吸收峰寬而強。1618.29 cm-1處的弱吸收峰為結合水的多糖水化振動吸收峰。1341.04 cm-1處的弱吸收峰為烷基的C-H變角度振動吸收峰。1150~1050 cm-1的前緣為吡喃糖苷環骨架的C-O可變角度振動吸收峰,說明分子中存在C-O-H和C-O-C結構[33]。757.90 cm-1處出現一個微弱的吸收峰,推測其含有吡喃糖環結構[34],且由單糖組成分析可知,其含有葡萄糖、半乳糖等具有吡喃環結構的糖苷鍵。
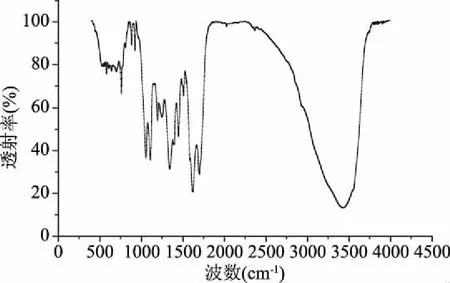
圖9 山茱萸籽多糖的紅外吸收光譜圖

圖10 山茱萸籽多糖掃描電鏡圖(左700×、右2000×)
2.8 掃描電鏡分析
山茱萸籽多糖的微觀結構見圖10,山茱萸籽多糖結構呈表面光滑,無規則顆粒狀,粒徑大小不一的球狀結構物,在山茱萸籽粕掃描電鏡圖中得到證實。其球狀結構物相互堆疊,相互緊靠。掃描電鏡圖表明在亞臨界水降解溫度160 ℃、降解時間20 min情況下,山茱萸籽多糖結構完整。
2.9 抗氧化活性分析
2.9.1 DPPH自由基的清除率測定 如圖11所示,在質量濃度為0.2 mg/mL時,自由基清除率為75.63%,在0.2~1.0 mg/mL范圍內增長較為緩慢,1.0 mg/mL時,清除率達到最大值85.61%。而標準品VC對DPPH自由基的清除率高達96.60%。
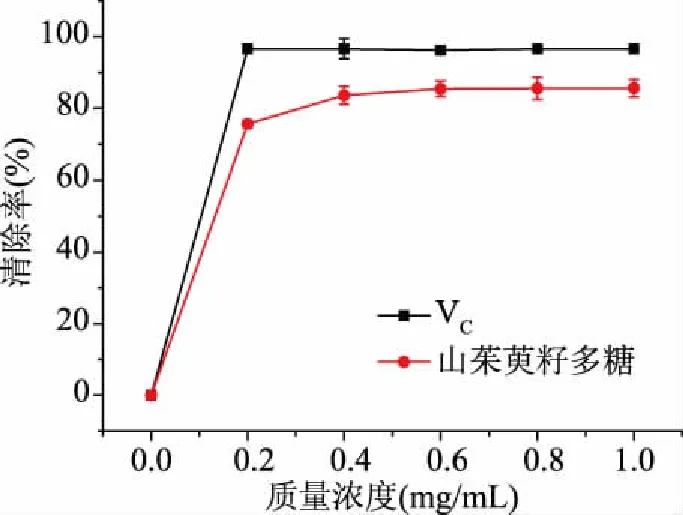
圖11 山茱萸籽多糖清除DPPH自由基的能力
2.9.2 羥自由基的清除率測定 如圖12所示,山茱萸籽多糖對羥自由基清除率隨著質量濃度的增加呈快速增長趨勢,在濃度達到0.8 mg/mL后,增長趨勢較為平緩,在1 mg/mL時清除率達到最大值63.40%。而標準品VC對羥自由基自由基的清除率高達90.21%。
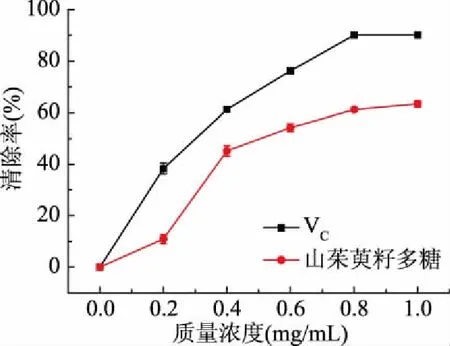
圖12 山茱萸籽多糖清除羥自由基的能力
2.9.3 ABTS自由基清除率測定 如圖13所示,在質量濃度0~1.0 mg/mL范圍內,山茱萸籽多糖對ABTS自由基清除率逐漸增大,在1 mg/mL時達到最大值76.20%。標準品VC對羥基自由基的清除率達97.80%。
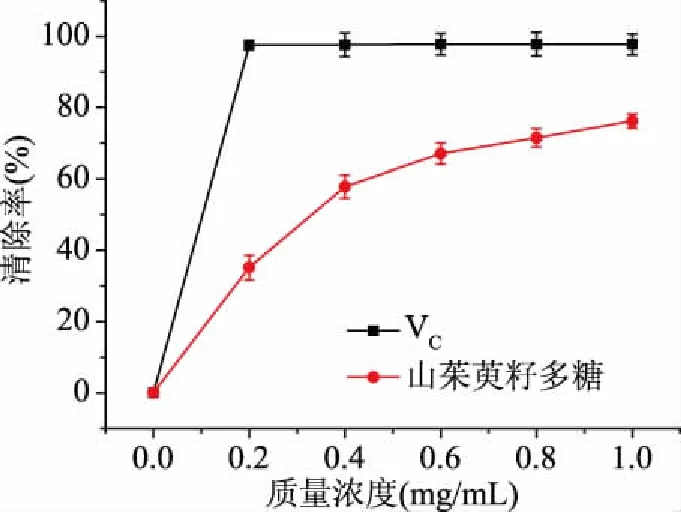
圖13 山茱萸籽多糖清除ABTS自由基的能力
3 結論
經過實驗研究,Saeman模型能較好地反映亞臨界水降解山茱萸籽粕的過程,降解溫度和降解時間是還原糖產率的主要影響因素,在降解溫度160 ℃、降解時間20 min條件下,能得到產量較高的還原糖。單糖組成分析結果表明,主要由、葡萄糖、木糖、半乳糖等組成;結構分析結果表明,山茱萸籽多糖結構呈表面光滑,無規則,粒徑大小不一的球狀結構物,為吡喃型糖苷環骨架,多糖結構完整;抗氧化實驗結果表明,山茱萸籽多糖具有一定的抗氧化活性,隨著多糖濃度的增加,其抗氧化活性逐漸增強。試驗結果為山茱萸籽多糖的進一步分離純化和理化特性、形態結構的分析提供了參考。

