亞臨界流體萃取富集金盞花中葉黃素工藝優化
李 冰,劉小波,張曉雪,于長青,賈鴻震,張小燕,張 輝
(甘肅省輕工研究院有限責任公司,甘肅蘭州 730030)
金盞花(CalendulaofficinalisL.)又名金盞菊,為菊科金盞菊屬植物。其原產歐洲,18世紀后期傳入我國,現已成為我國重要草本花卉之一[1]。金盞花不僅含有碳水化合物、脂肪、氨基酸等成分,而且含有類胡蘿卜素、三萜皂甙和揮發油等活性成分[2-3]。其中葉黃素和葉黃素酯(維生素A原)為金盞花的主要成分,能夠在人機體內通過轉化產生可直接吸收的維生素A,可有效地預防和改善現代人長時間注視電腦、手機、電視所造成的眼疲勞[4-7]。葉黃素,又稱植物黃體素,是一種廣泛存在于蔬菜、花、水果和某些藻類生物中的天然色素,是目前廣泛使用的食品色素之一,具有優良的抗氧化劑效果[8]。研究表明,它不僅是天然的著色劑,還具有保護視力、預防白內障、預防機體衰老引發的冠心病和癌癥、防止動脈硬化及增強免疫力等重要作用[9-13]。葉黃素分子式為C40H56O2,由于葉黃素有多種同分異構體,人工合成工藝復雜,至今尚未成功,生產上只能從天然植物中提取得到[14-16]。
從天然植物中提取葉黃素主要采用傳統的溶劑提取法[17]、超臨界CO2流體萃取法[18-19]和微波輔助提取法[3]等,然而這些萃取方法大多有缺陷,難以實現規模化生產。近年來,亞臨界溶劑萃取作為一種新型的提取方法,由于其溶劑殘留低,且提取效率高,而被廣泛應用于天然活性物質的提取。它與傳統的溶劑法相比,克服了油脂提取后的精煉工藝,保留了有效成分的營養價值,提高了有效成分得率[20]。此外,與超臨界CO2流體萃取法相比,亞臨界流體萃取操作壓力低,減少了設備投資和操作成本。同時1,1,1,2-四氟乙烷(R134a)的臨界溫度為101.1 ℃,臨界壓力為4.06 MPa,對極性物質具有強的溶解能力,同時擴散系數大、黏度系數小,在液態和臨界點附近具有良好的溶劑性能,尤其適合天然原料的萃取[21]。目前,已有研究利用亞臨界流體萃取技術從萬壽菊中提取葉黃素的研究,但未見針對金盞花利用亞臨界流體萃取葉黃素的研究。亞臨界流體萃取工藝操作簡單,提取高效、經濟實用,特別適用于食品工業生物活性物質和熱敏性物質的提取分離,適合金盞花中天然葉黃素的富集,工藝技術具有顯著的優勢[21-22]。因此,本研究借鑒其它天然色素萃取的現代化工藝技術,促使金盞花中葉黃素發揮更大的應用范圍和使用價值。
綜上,本研究以金盞花顆粒為原料,利用亞臨界流體R134a萃取富集葉黃素,探討金盞花顆粒尺寸、萃取時間、萃取壓力、萃取溫度和萃取次數對葉黃素萃取富集的影響,在此基礎上利用Plackett-Burnman試驗設計選出對其富集含量影響較大的3個因素,然后再運用響應面法優化確定亞臨界R134a萃取富集葉黃素的最佳工藝參數,以期為金盞花中葉黃素的提取研究提供理論基礎。
1 材料與方法
1.1 材料與儀器
金盞花圓柱形顆粒(直徑5 mm,尺寸長度25 mm) 甘肅三一生物科技有限責任公司提供;葉黃素標準品(CAS號:127-40-2,純度≥98.0%) 美國Solarbio公司;1,1,1,2-四氟乙烷(R134a)、環己烷(C6H12)、乙醚[(C2H5)2O]、正己烷(C6H10)、無水乙醇(C2H5OH)、甲基叔丁基醚(CH3OCC(CH3)3,MTBE)(均為色譜純),二丁基羥基甲苯(C15H24O,BHT)、氫氧化鉀(KOH)、碘(I2)(均為分析純) 均購自國藥集團化學試劑公司。
Agilent 1260高效液相色譜 北京京科瑞達科技有限公司;ES1035A型分析天平(感量0.01 mg和0.01 g) 廈門群隆儀器有限公司;24 L亞臨界萃取中試成套定制設備 甘肅省輕工研究院有限責任公司;SHZ-D(III)型循環水真空泵 上海貝侖儀器設備有限公司;H1850型高速離心機 廣州航信科學儀器有限公司。
1.2 實驗方法
1.2.1 葉黃素的萃取富集工藝 將金盞花原料截成不同尺寸的顆粒。準確稱量1.50 kg一定顆粒尺寸的金盞花原料加入萃取釜中,密封,進行抽真空,使壓力表值為-0.6 MPa,即可完全排出萃取釜內空氣。然后打開高壓柱塞泵,將R134a經高壓柱塞加壓,再經過板式換熱器加熱到一定萃取溫度后打入萃取釜,通過視鏡觀察液位淹沒金盞花顆粒為止[21,23]。控制一定的萃取壓力,始終使萃取溶劑R134a保持液態,然后萃取一定的時間,萃取1次,萃取完成后,通過切換閥門,將含有葉黃素的萃取物導入分離罐,然后通過加熱使R134a不斷的氣化分離,同時打開壓縮機將不斷氣化的R134a蒸汽通過系統隔膜壓縮機壓縮進入冷凝器冷凝液化后回收至溶劑儲罐循環使用。而萃取富集成分通過分離放出,經過高速離心分離(4 ℃,3000 r/min,10 min)、過濾后得到含有葉黃素的金盞花萃取物。
1.2.2 單因素實驗設計
1.2.2.1 顆粒尺寸 按照“1.2.1”的方法,控制萃取時間為40 min,萃取壓力1.2 MPa,萃取溫度40 ℃,萃取次數1次,考察金盞花顆粒尺寸(5、10、15、20、25 mm)對亞臨界萃取富集葉黃素含量的影響。
1.2.2.2 萃取時間 在上述優化顆粒尺寸的基礎上,確定顆粒尺寸為10 mm,萃取壓力1.2 MPa,萃取溫度40 ℃,萃取次數1次,考察萃取時間(30、35、40、45、50 min)對亞臨界萃取富集葉黃素含量的影響。
1.2.2.3 萃取壓力 在上述優化顆粒尺寸和萃取時間的基礎上,確定顆粒尺寸為10 mm、萃取時間為45 min,萃取溫度40 ℃,萃取次數1次,考察萃取壓力(0.8、1.0、1.2、1.4、1.6 MPa)對亞臨界萃取富集葉黃素含量的影響。
1.2.2.4 萃取溫度 在上述優化顆粒尺寸、萃取時間和萃取壓力的基礎上,確定顆粒尺寸為10 mm、萃取時間45 min、萃取壓力1.2 MPa,萃取次數1次,考察萃取溫度(30、35、40、45、50 ℃)亞臨界萃取富集葉黃素含量的影響。
1.2.2.5 萃取次數 在上述優化顆粒尺寸、萃取時間、萃取壓力和萃取溫度的基礎上,確定顆粒尺寸為10 mm、萃取時間45 min、萃取壓力1.2 MPa、萃取溫度40 ℃,考察萃取次數(1、2、3、4次)對亞臨界萃取富集葉黃素含量的影響。
1.2.3 Plackett-Burman試驗設計 通過Plackett-Burman試驗設計可以確定因素對響應值的影響作用,篩選出對響應值有影響的因素[24-25]。本試驗以萃取物中葉黃素含量為響應值,在單因素的基礎上,利用Plackett-Burman設計金盞花顆粒尺寸、萃取時間、萃取壓力、萃取溫度、萃取次數5個因素對葉黃素含量萃取富集的影響,為進一步的Box-Behnken試驗奠定基礎。試驗因素及水平見表1。

表1 Plackett-Burman試驗設計因素及水平表
1.2.4 響應面試驗設計 通過單因素實驗及Plackett-Burman試驗設計的結果,篩選出對葉黃素富集含量影響顯著的3個因素,然后運用Box-Behnken試驗設計進行3因素3水平的響應面試驗優化。以萃取物葉黃素含量為響應值(Y),分別以萃取時間(A)、萃取溫度(B)、萃取次數(C)為自變量進行優化。Box-Behnken 試驗優化水平設計見表2。
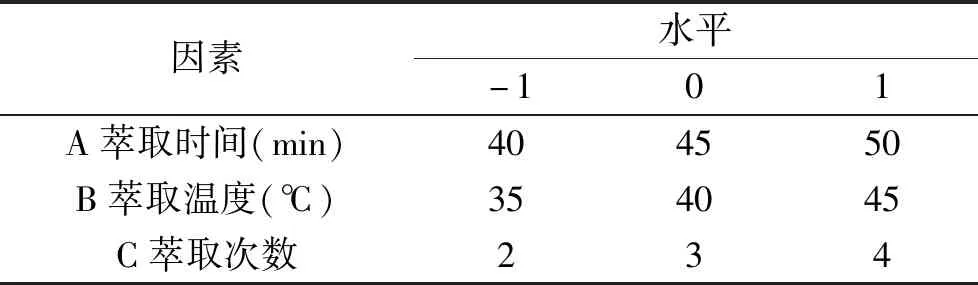
表2 Box-Behnken中心試驗設計因素及水平表
1.2.5 葉黃素含量的測定 通過開展金盞花中葉黃素的提取的單因素實驗發現,在相同萃取次數條件下,利用亞臨界流體萃取法提取得到的葉黃素提取率(24.43%)且無顯著差異(P=0.325),進而進一步研究提取物中葉黃素含量的差異性,發現不同影響因素對提取物中葉黃素的含量影響顯著(P<0.05),所以在本研究中選取了提取物中的葉黃素含量作為評價指標。
1.2.5.1 色譜條件 葉黃素含量的檢測參考《食品中葉黃素的測定》的方法[26-27]。色譜柱:Symmetry C18(250 mm×4.6 mm,5 μm),流動相A:甲醇/水(88+12,體積比;含0.1% BHT)-甲基叔丁基醚(含0.1% BHT);梯度洗脫,0~18 min,甲醇/水由100%變換至10%;18 min,甲醇/水由10%變換至100%,保留10 min。紫外檢測器波長:445 nm,進樣量:50 μL,流速:1.0 mL/min,柱溫:30 ℃。
1.2.5.2 標準曲線的繪制 準確稱取5 mg(精確至0.01 mg)葉黃素標準品,將其溶解在0.1% BHT乙醇溶液中,并定容至100 mL,配制成50 μg/mL的標準液。然后分別吸取0.050、0.100、0.200、0.400、1.00 mL置于5個25 mL棕色容量瓶中,然后用0.1% BHT乙醇溶液定容至刻線,搖勻,配制成梯度標準液(0.100、0.200、0.400、0.800、2.000 μg/mL),使用前過0.45 μm濾膜。按照金盞花前處理及試樣測定的方法上高效液相色譜儀,同時做空白對照,經計算線性回歸方程:y=103.3x-35.073(R2=0.999,n=5),其中y為峰面積,x為葉黃素濃度(μg/mL)[21]。
1.2.5.3 金盞花前處理及試樣測定 準確稱取2 g(精確至0.0001 g)萃取物于50 mL聚丙烯離心管中,加入約0.2 g BHT和10 mL乙醇,混勻,加入10 mL 10%氫氧化鉀溶液,渦旋振蕩1 min混勻,室溫避光振蕩皂化30 min,以10 mL萃取溶劑避光渦旋振蕩提取3 min,4500 r/min離心3 min,重復提取2次,合并提取液,以10 mL水洗滌,4500 r/min離心3 min分層,重復洗滌1次,合并有機相于室溫減壓濃縮至近干,以0.1% BHT乙醇溶液渦旋振蕩溶解殘渣并定容至5 mL,過0.45 μm濾膜,供液相色譜測定[21]。
提取物中葉黃素含量計算:
式中:X:試樣中葉黃素的含量,%;c:由標準曲線而得的樣液中標準品的含量,μg/mL;V:樣品最終定容體積,mL;m:稱樣量,g;F:校正系數。
1.3 數據處理
采用SPSS對單因素實驗數據進行處理(所有數據均以MEAN±SD表示),并利用單因素ANOVA檢驗中的LSD法和Duncan法進行顯著性分析,顯著性水平P<0.05。運用Design-Expert 8.0中的Plackett-Burman試驗設計和Box-Behnken試驗設計進行結果分析并作圖。
2 結果與分析
2.1 單因素實驗結果
2.1.1 顆粒尺寸對葉黃素含量的影響 圖1反映的是金盞花顆粒尺寸對葉黃素含量的影響。在其它萃取條件相同條件下,隨著顆粒尺寸的增加,金盞花萃取物中葉黃素含量呈先升高后降低的趨勢,且在金盞花顆粒尺寸為10 mm時,金盞花萃取物中葉黃素含量達到27.54%的最大值,這可能是因為物料顆粒尺寸過小,物料容易被泡散,細小物料粉末下沉,形成了物料堆積,增大了傳質阻力,同時致使亞臨界R134a只沿著阻力小的線路通過料層,形成許多針孔,使萃取不均勻[28]。隨著金盞花顆粒尺寸超過10 mm時,萃取物中葉黃素的含量顯著下降(P<0.05),這可能是由于金盞花顆粒尺寸增大,導致了R134a與物料接觸不良,使得溶劑進入物料的阻力變大[29]。因此,在后續的提取過程中選取10 mm為萃取顆粒尺寸。

圖1 顆粒尺寸對葉黃素含量的影響
2.1.2 萃取時間對葉黃素含量的影響 由圖2可知,當萃取時間在30~45 min時,隨著萃取時間的延長,金盞花萃取物中葉黃素的含量顯著增大(P<0.05),在萃取時間為45 min時,萃取物中葉黃素含量最大,為27.54%,繼續延長萃取時間,葉黃素富集含量呈下降趨勢,但差異不顯著(P>0.05)。隨著萃取時間的增加,萃取物中葉黃素含量呈先升后降的趨勢,這是由于亞臨界流體萃取是一個溶劑與溶質之間的傳質平衡的體現,這個平衡過程需要一定的時間來實現[20,30]。在亞臨界萃取初期,R134a與金盞花顆粒之間的接觸不夠充分,部分葉黃素沒有充分溶出,萃取物中葉黃素的含量較低,隨著萃取時間的延長,溶劑與溶質之間達到了一個動態平衡的狀態,此時葉黃素的溶出量最大。當時間超過45 min時,葉黃素含量出現下降趨勢,這可能是由于時間的延長導致反式葉黃素發生了氧化降解[31]。故認為萃取時間為45 min較好。

圖2 萃取時間對葉黃素含量的影響
2.1.3 萃取壓力對葉黃素含量的影響 在前期試驗基礎上,確定金盞花顆粒尺寸為10 mm、萃取時間為45 min,研究萃取壓力對葉黃素含量的影響。結果如圖3所示,研究發現,萃取壓力從0.8 MPa升高到1.0 MPa時葉黃素含量顯著增大(P<0.05),之后繼續升高萃取壓力到1.6 MPa時,在此區間葉黃素含量增加不顯著(P>0.05),這說明在一定的壓力范圍內,亞臨界流體R134a的密度隨著壓力的增加而增大,隨之溶解能力也增加,且隨著萃取壓力增大,溶質分子內的相互作用力也增加,葉黃素的溶解性也增加,萃取物中葉黃素含量增加[21]。當壓力高于1.0 MPa時,萃取壓力對葉黃素含量影響不顯著(P>0.05),這說明當壓力高于R134a流體的亞臨界狀態壓力時,亞臨界流體對葉黃素的溶解性影響較小,而且亞臨界流體黏度隨著壓力升高而升高,阻止了溶質向溶劑中的擴散,所以葉黃素的含量升高不顯著[32]。同時考慮到壓力對R134a溶解能力的影響,故而選擇萃取壓力為1.2 MPa較合適。

圖3 萃取壓力對葉黃素含量的影響
2.1.4 萃取溫度對葉黃素含量的影響 圖4反映的是萃取溫度對葉黃素含量的影響。從圖4可以看出隨著萃取溫度的升高,萃取物中葉黃素含量呈先增加后降低的趨勢。當萃取溫度從30 ℃升高到40 ℃時葉黃素含量顯著增大(P<0.05),這可能是由于溫度的升高增大了溶劑和溶質分子之間的布朗運動作用,使得溶質能夠盡可能地溶出[33]。但隨著溫度升高到40 ℃以上時,葉黃素的含量反而出現了下降的現象,且在溫度為50 ℃時差異顯著(P<0.05),這是由于溫度的升高導致了R134a溶劑的揮發性也隨之增大,使得部分溶劑氣化,降低了其溶解性。同時萃取溫度過高,葉黃素易受熱分解,導致了萃取物中的葉黃素的含量減少[28]。因此,選擇40 ℃作為后續萃取溫度。

圖4 萃取溫度對葉黃素含量的影響
2.1.5 萃取次數對葉黃素含量的影響 在前期試驗的基礎上,固定金盞花顆粒尺寸為10 mm,萃取時間45 min、萃取壓力1.2 MPa、萃取溫度40 ℃,考察萃取次數對葉黃素含量的影響。結果見圖5,實驗結果表明,亞臨界流體R134a萃取物中葉黃素的富集含量隨著萃取次數的增加逐漸提高,且在前3次萃取時萃取物中葉黃素的含量顯著增加(P<0.05)。但當萃取次數達到3次以上時,葉黃素含量上升開始變得緩慢,且萃取3次與萃取4次時萃取物中葉黃素的含量增加不顯著(P>0.05),這說明金盞花顆粒經過3次亞臨界流體萃取后,已基本達到了完全萃取葉黃素的效果[21]。因此在本實驗中以3次萃取作為最優萃取次數,且在此條件下得到的葉黃素含量達到了31.78%。

圖5 萃取次數對葉黃素含量的影響
2.2 Plackett-Burman試驗結果
通過Plackett-Burman試驗設計對影響金盞花中萃取葉黃素的因素進行顯著性分析,Plackett-Burman試驗設計及結果見表3,試驗結果方差分析見表4,偏回歸系數及顯著性檢驗見表5。

表3 Plackett-Burman試驗設計及結果

表4 Plackett-Burman設計的方差分析表
從表4可知,該試驗模型極顯著(P<0.01)。從表5 Plackett-Burman試驗結果的偏回歸系數及顯著性檢驗分析可知,萃取時間(B)、萃取溫度(D)、萃取次數(E)三個因素對金盞花中葉黃素的萃取富集影響極顯著(P<0.01),所以選擇萃取時間、萃取溫度和萃取次數進行響應面的優化設計試驗。顆粒尺寸(A)和萃取壓力(C)兩個因素對葉黃素含量影響不顯著(P>0.05),所以在后續試驗中分別將其固定為10 mm和1.2 MPa。

表5 偏回歸系數及顯著性檢驗
2.3 Box-Behnken試驗結果
2.3.1 葉黃素提取優化試驗設計及結果 利用Design-Expert 8.0對表6中的數據進行方差分析和回歸分析,對試驗結果進行擬合。以萃取時間(A)、萃取溫度(B)和萃取次數(C)為自變量,擬合得到回歸方程:
葉黃素含量(%)=31.61-0.17A-0.18B+1.02C-0.2AB-0.038AC-0.027BC-0.51A2-0.37B2-0.53C2。

表6 Box-Behnken試驗設計及結果

表7 Box-Behnken試驗結果方差分析表

2.3.2 響應面交互作用分析 響應面3D曲面圖反映的是兩兩因素之間對響應值的影響作用,其中3D曲面圖越陡峭,說明兩因素之間交互作用越明顯。從圖6可以看出萃取時間和萃取溫度、萃取時間和萃取次數、萃取溫度萃取次數之間兩兩的交互作用不顯著(P>0.05),該結果與方差分析結果一致。

圖6 交互作用對葉黃素含量影響的響應面圖
2.3.3 最優萃取工藝參數及驗證 通過利用Design-Expert 8.0設計分析得到的亞臨界流體萃取富集金盞花中葉黃素工藝為顆粒尺寸10 mm、萃取時間44.24 min、萃取壓力1.2 MPa、萃取溫度38.79 ℃、萃取次數3.98次,預測萃取物中葉黃素含量為32.14%。考慮到實際操作,驗證試驗取顆粒尺寸10 mm、萃取時間44 min、萃取壓力1.2 MPa、萃取溫度39 ℃、萃取次數4次的條件下進行實驗。在此條件下進行3次平行試驗,得到的金盞花萃取物中葉黃素含量為32.28%±0.33%(P=0.128),與預測值相差0.44%,說明模型有效。這一研究萃取得到的萃取物中葉黃素含量明顯高于周彥芳等[34]的利用有機溶劑法提取得到的浸膏中的含量(16.5%)和超臨界CO2法萃取得到的浸膏中的含量(2.6%),可見,本方法提取效果相對較高,同時,亞臨界流體萃取法富集金盞花中葉黃素工藝操作簡單,萃取浸膏中葉黃素的含量較高,相比有機溶劑萃取法和超臨界CO2法萃取法具有一定的優越性,為金盞花中提取葉黃素的工業化提供了可行性基礎。
3 結論
本研究通過利用單因素實驗及Plackett-Burman試驗設計篩選出對葉黃素含量具有顯著影響的因素,并在此基礎上進一步利用Design-Expert 8.0中的Box-Behnken試驗設計對亞臨界流體萃取富集金盞花中葉黃素工藝進行研究,得出亞臨界流體萃取富集金盞花中葉黃素最佳工藝為:金盞花顆粒尺寸10 mm、萃取時間44 min、萃取壓力1.2 MPa、萃取溫度39 ℃、萃取次數4次,在此條件下,進行3次平行試驗,亞臨界萃取物中葉黃素含量可達到32.28%。同時,亞臨界流體萃取富集金盞花中葉黃素工藝操作簡單,能夠實現工業化生產。該研究可以為富集金盞花中葉黃素的產業化研究提供一定的理論參考。

