精氣血津液的功能性質和生物學基礎
張啟明 王義國 張健雄 韓學艷 田欣
精、血和津液都具有濡養作用,難以區分;血和津液都具有化神作用,不好鑒別。精、氣、血、津液是中醫表達人體組成和功能的重要概念,但中醫理論體系沒有說明其客觀實在,故無法借用工程技術的手段進行客觀測評。本文的目的就是以精、氣、血、津液的傳統認識為依據,以功能性五藏的15種功能為線索[1],將精、氣、血、津液與人體的流變結構進行對比,以明確精、氣、血、津液的功能性質和生物學基礎,并通過精、氣、血、津液的生物學關系說明了這種認識的合理性。
1 人體組成部分的兩種分類方法
1.1 按照物理屬性將人體分為物質性部分和能量性部分
(1)物質性部分,有系統、器官、組織、細胞、細胞器和分子6個層次;(2)能量性部分,是物質性部分的存在形式,包括化學能和熱能。化學能存儲于糖、脂肪、蛋白質等供能物質和三磷酸腺苷(ATP)等分子的化學鍵中,在生命活動過程中可轉化為機械能(如運動、呼吸)、電能(如心電、腦電、肌電及其形成的磁場)、光能(如紅外線)和聲能(如發音);熱能是物質性部分所有分子的動能(包括平動能和轉動能)之和[2]。
1.2 按照毗鄰關系將人體分為固定結構和流變結構
(1)固定結構,即有固定毗鄰關系的結構,如消化系統、神經組織,由組織型體細胞為構成要素,常常是慢變量。五臟(六臟)、六腑、奇恒之腑、五體、官竅和經絡都是中醫認識的人體固定結構;(2)流變結構,即沒有固定毗鄰關系的結構,如體液、生物電,以物質流和能量流為構成要素,常常是快變量。其中,物質流即單位時間內流經人體各種固定結構的糖、脂肪、蛋白質、水、礦物質、維生素、代謝產物、血細胞、飲食物、糞便、空氣、皮脂、汗液、尿液、生殖細胞、受精卵、母血、母乳等,中醫稱精、血、津液;能量流即單位時間內流經人體各種固定結構的化學能和熱能,中醫稱氣。
2 精、氣、血、津液的五藏歸屬
生物醫學和中醫學的研究對象是一致的,都是人體[3];生物醫學和中醫學的研究目的也是一致的,都在維護人的健康[4];生物醫學和中醫學都全面地認識了人體的各種組成部分和功能,即人體的任何組成部分和功能都能在生物醫學和中醫學的理論體系中找到[5]。
脾、肺、腎、肝、心五藏是以五行學說為原始模型構建的獨特理論體系,體現了關系(整體性)和時序(動態性)等中醫乃至中國傳統文化的特點。五臟(六臟)、六腑、奇恒之腑、五體、官竅和經絡的功能都可歸屬五藏[1],故可以五藏的15種功能為線索,通過對比精、氣、血、津液與人體的流變結構的功能,將精、氣、血、津液歸屬五藏。也只有精、氣、血、津液存在時,五藏的功能才得以實施,才體現中醫關注的整體性和動態性。
2.1 精、氣、血、津液的傳統認知
全國高等中醫藥院校規劃教材《中醫基礎理論》[6]詳細地介紹了關于精、氣、血、津液的來源、性狀、分布、相關臟腑、功能和分類等傳統認識,是確定精、氣、血、津液的功能性質和生物學基礎的依據,詳見表1。

表1 精、氣、血、津液的傳統認知
2.2根據功能的不同將精納入五藏
具有繁衍生命功能的精可看作生殖細胞,歸入生育功能的腎藏;具有濡養功能的精可看作營養物質,即水谷之精,歸入散精功能的脾藏;具有化血功能的精,或可看作造血原料,歸入全形功能的腎藏,或可看作激發造血功能的激素和細胞因子,歸入藏精功能的腎藏;具有調節生長發育功能的精可看作生長激素、甲狀腺激素等,歸入藏精功能的腎藏;具有化氣和化神功能的精可看作供能物質,經生物氧化(氣化)為各種生命活動(神)提供能量(元氣、元陽),歸入氣化功能的腎藏。
2.3 根據功能的不同將氣納入五藏
具有推動作用的氣可看作線粒體產生的化學能(元氣);具有溫煦作用的氣(包括具有溫煦作用的衛氣)可看作線粒體產生的熱能(元陽),歸入氣化功能的腎藏;具有防御作用的氣可看作為對外免疫系統對病原微生物及其產物、外來異物免疫防御和免疫耐受提供動力的化學能(衛氣),歸入衛外功能的肺藏;對汗液具有固攝作用的氣可看作為小汗腺周圍肌上皮細胞的舒縮提供動力的化學能(衛氣),歸入衛外功能的肺藏;對津液具有固攝作用的氣可看作為肝、小腸合成白蛋白和載脂蛋白提供動力的化學能,歸入散精功能的脾藏;對血具有固攝作用的氣可看作為凝血抗凝血系統防止出血和血栓形成提供動力的化學能,歸入統血功能的脾藏;對尿液具有固攝作用的氣可看作為膀胱三角區肌、膀胱括約肌、尿道外括約肌(男性)、尿道陰道括約肌(女性)的舒縮提供動力的化學能,歸入主水功能的腎藏;對精液具有固攝作用的氣可看作為生殖腺周圍肌上皮細胞的舒縮提供動力的化學能,歸入生育功能的腎藏;對唾液、胃液、腸液具有固攝作用的氣可看作為消化腺周圍肌上皮細胞的舒縮提供動力的化學能,歸入運化功能的脾藏;具有調控和中介作用的氣可看作為體液調節系統產生激素和細胞因子提供動力的化學能,歸入藏精功能的腎藏;具有生血功能的氣或可看作為造血系統造血提供動力的化學能,歸入全形功能的腎藏,或可看作為消化系統攝取營養物質增加血容量提供動力的化學能,歸入運化功能的脾藏;具有生津功能的氣可看作為消化系統攝取營養物質增加血容量提供動力的化學能,歸入運化功能的脾藏;具有行血和行津功能的氣可看作為脈管系統推動體液循環提供動力的化學能,歸入主血脈功能的心藏。
2.4 根據功能的不同將血納入五藏
具有濡養功能的血可看作營養物質,即水谷之精(營氣),歸入散精功能的脾藏;具有化神功能的血可看作營養物質,經生物氧化(氣化)為各種生命活動(神)提供能量(元氣、元陽),歸入氣化功能的腎藏;具有養氣功能的血可看作產生能量的供能物質,歸入氣化功能的腎藏;具有載氣功能的血可看作承載O2和CO2的紅細胞和血漿,歸入主氣功能的肺藏;具有柔肝作用的血可看作腦血管為內臟神經系統提供的營養物質,歸入疏泄功能的肝藏;具有養筋功能的血可看作腦血管為軀體神經系統提供的營養物質,歸入藏血功能的肝藏;具有舍神功能的血可看作腦血管為產生精神活動的中樞神經系統提供的營養物質,歸入藏神功能的心藏。
2.5 根據功能的不同將津液納入五藏
具有濡養功能的津液可看作營養物質,即水谷之精,歸于運化功能的脾藏;具有充養血脈功能的津液可看作進入血液循環的水和營養物質,歸于運化功能的脾藏;具有生氣功能的津液可看作產生能量的供能物質,歸入氣化功能的腎藏;具有載氣功能的津液,可看作承載O2和CO2的體液,歸入主氣功能的肺藏;具有滋潤功能的津液可看作潤滑體腔、關節腔、體表和官竅的體液,如消化腺分泌的消化液、黏液腺分泌的黏液、皮脂腺分泌的皮脂、滑液膜分泌的滑液、皮膚黏膜的滲出液和漏出液、腎臟分泌的尿液、淚腺分泌的淚液、耵聹腺分泌的耵聹、漿膜分泌的漿液等,因潤滑部位不同而分別歸于運化和主肌肉功能的脾藏、主氣和衛外功能的肺藏、主水和生育功能的腎藏、藏血功能的肝藏、主血脈功能的心藏。
精、氣、血、津液的五藏歸屬詳見下頁圖1。
3 精、氣、血、津液的功能性質和生物學基礎
根據精、氣、血、津液的傳統認識及其五藏歸屬,容易獲知精、氣、血、津液的功能性質和生物學基礎。
3.1 精
精是構成人體和維持人體生命活動的基本物質。分為5種:(1)生殖之精,即精子、卵子,具有攜帶遺傳信息,傳宗接代的功能;(2)水谷之精,又稱營氣,即糖、脂肪、蛋白質、水、無機鹽、維生素,具有營養功能;(3)成形之精,即核酸、糖、類脂、蛋白質、鈣、磷等結構性物質,是細胞更新、再生、重建和合成細胞產物的原料;(4)化氣之精,即糖、脂肪和蛋白質等供能性物質,能夠氧化供能;(5)調節之精,即激素和細胞因子,能借助體液對人體的生殖、細胞再生、同化異化、泌尿、防御和循環起協調作用。
3.2 氣
氣是維持人體生命活動的能量。分為2種:(1)推動之氣,又稱元氣、原氣、腎氣,即化學能,具有推動作用;(2)溫煦之氣,又稱元陽、原陽、腎陽,即熱能,具有溫煦作用。
3.3 血
血即血液,分為3種:(1)載氣之血,即紅細胞和血漿,能承載O2和CO2;(2)免疫之血,即免疫細胞和免疫分子,能對病原微生物及其產物、外來異物免疫防御和免疫耐受,對自身細胞及其產物免疫耐受、免疫自穩和免疫監視[7];(3)攝血之血,即血小板、凝血因子、抗凝系統和纖溶系統,能防止出血和血栓形成。
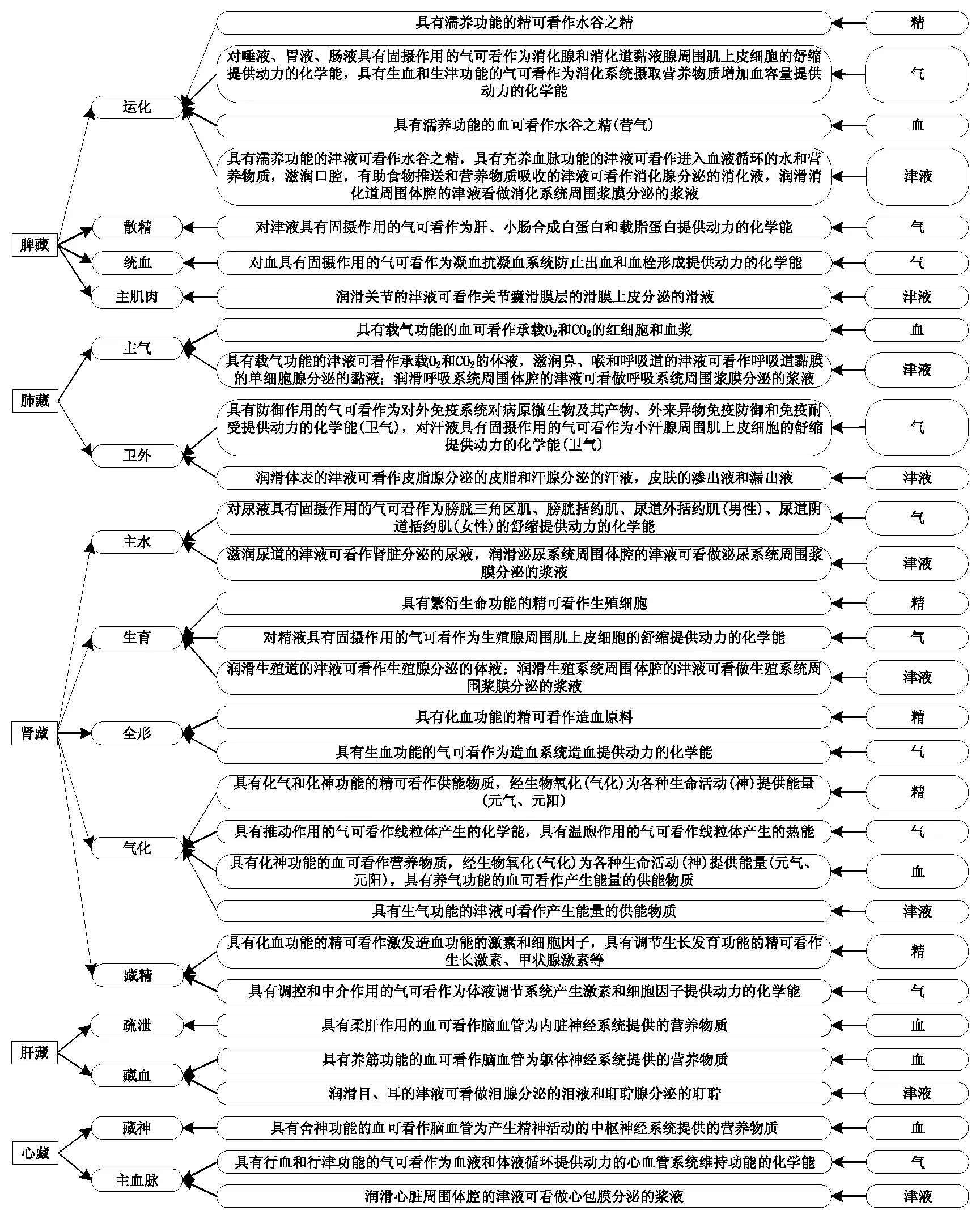
圖1 精、氣、血、津液的五藏歸屬
3.4 津液
津液即體液,分為2種:(1)承載津液,即血漿、淋巴液、腦脊液、房水、組織液、細胞內液和部分存在于體外的體液,具有承載物質能量的功能;(2)潤滑津液,即漿液、滑液和部分存在于體外的體液,具有減少摩擦和濕潤暴露部位的功能。
精、氣、血和津液的產生部位、分類、生物學基礎、功能性質和五藏歸屬詳見圖2。
4 精、氣、血、津液的生物學關系
來自父母的生殖之精(精子、卵子)交媾形成人的雛形(受精卵),經過母體十月懷胎產生具有固定結構的形(臟腑、五體、官竅、經絡)[8]。出生后,人體一方面借助脾藏的運化(消化)和散精(轉載)功能將飲食物變成水谷之精(糖、脂肪、蛋白質、水、無機鹽、維生素),并以津液(體液)為承載介質布散周身,并將食物殘渣以糞便形式排出體外;另一方面借助肺藏的主氣(呼吸)功能從空氣中攝取清氣(O2),并以血(紅細胞、血漿)為承載介質布散周身[9]。布散周身的水谷之精一方面在腎藏的藏精(體液調節)功能調節下借助精的成形功能化生細胞成分(蛋白質、核酸、核糖、結構多糖、磷脂、糖脂、膽固醇等),后者為非造血干細胞提供原料生成新的組織型體細胞以充形,借助腎藏的生育(生殖)功能化生生殖之精(精子、卵子)繁育后代,為造血干細胞提供原料生成新的血細胞;另一方面在腎藏的藏精(體液調節)功能調節下借助精的化氣功能與清氣(O2)結合(生物氧化)化生的能量分為維持體溫的熱能(元陽)和為人體各種生命活動(神)提供動力的化學能(元氣)。損傷、衰亡、變性和突變的體細胞借助精的成形功能分解成結構性物質或供能性物質參與全身代謝,以維持組織型體細胞和游走型體細胞(血細胞)的穩定。生物氧化過程產生的代謝廢物(尿酸、尿素)以津液(體液)為承載介質,主要借助腎藏的主水(泌尿)功能排出體外,少量到達皮膚形成汗液排出體外,產生的濁氣(CO2)以血(紅細胞、血漿)為承載介質借助肺藏主氣(呼吸)功能排出體外[10]。維持生命活動的化學能最終主要轉化為熱能[11],與維持體溫的熱能一起以津液(體液)為承載介質到達皮膚排出體外,少量熱能通過呼吸水氣和糞尿排出體外。
顯然,精、氣、血、津液的生物學關系支持了關于精、氣、血、津液的功能性質和生物學基礎的認識,具體見圖3。
概言之,本文以功能性五藏的15種功能為線索,以精、氣、血、津液的傳統認識為依據,通過對比精、氣、血、津液與人體的流變結構,給出了精、氣、血、津液的功能性質和生物學基礎,并借助人體流變結構之間的關系論證了這些認識的合理性,有望使中醫理論與工程技術結合,實現五藏功能態勢的客觀測評。
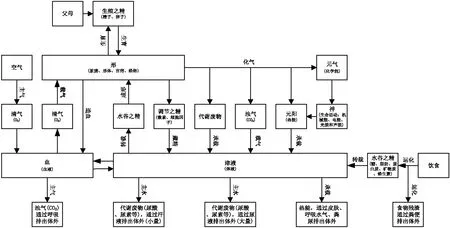
圖3 精、氣、血、津液的生物學關系

