基于上轉換納米粒子的低損傷神經界面技術
鄒亮 ,田慧慧
1中國科學院納米科學卓越創新中心,國家納米科學中心,北京 100190
2中國科學院大學,北京 100049
1 引言
光遺傳是一種結合光控技術和基因技術的神經調控技術,能夠以毫秒級的時間精度對特定類型神經元的電活動實現選擇性地激活或抑制1-4。利用基因技術使光敏蛋白基因在特定類型神經元的細胞膜上表達光敏蛋白離子通道或離子泵,通過相應波長激發光照射,能夠控制細胞膜結構上的光敏蛋白的激活與抑制,從而實現對神經元活動性的調控,揭示各種神經元在神經環路中的功能和相互聯系方式。近年來,隨著光控技術和基因技術的進步,光遺傳在神經科學領域迅速發展。盡管如此,目前報導的光敏蛋白普遍采用可見光作為激發光2,5-7,這給神經調控帶來了許多難題。由于組織對可見光的吸收和散射非常嚴重8,9,這會導致激發光能量的損失和組織發熱,因此為了調控深腦組織神經元的活動,就必須將光纖或者光電器件(如uLED)植入到目標腦區10-15。然而這種侵入式的調控會造成較嚴重的組織損傷,并且植入光纖的后端通常需要連接外部設備,會在一定程度上限制動物的活動,進而影響動物行為學實驗的可靠性。
針對上述難題,研究人員研發出了許多新型光敏蛋白。例如Bedbrook等16研發了一種新型光敏蛋白-ChRger2,雖然這種光敏蛋白的激發光波長仍然位于可見光的藍光波段,但是由于它的光敏性遠大于常用的藍光激活光敏蛋白ChR2(H134R):一種常用于體內光遺傳的增強型光電流單突變體,因此所需的激發光強度很小。利用這種新型光敏蛋白,Bedbrook等成功地通過顱外藍光照射激活了小鼠右側次級運動皮層的神經元,對小鼠的轉向行為進行了調控。值得注意的是,一方面該研究選取的腦區位于大腦表層,并且對顱骨做了鉆薄處理,這種新型光敏蛋白對位于大腦深處神經元的調控能否起作用有待驗證,另一方面由于組織對藍光有很強的散射作用,這種施加激發光的方式難以實現對大腦深處小體積核團的精準照射。由于組織對長波段光的吸收和散射作用較小,在過去的研究中,除了研發新型高光敏性的光敏蛋白之外,在開發能夠將激發波長紅移的新型光敏蛋白方向也取得了一系列的進展。比如,2008年Zhang等17研發了VChR1光敏蛋白,這種光敏蛋白在黃光(589 nm)照射下就能激發出動作電位。相比于常用的藍光(473 nm)激發光敏蛋白ChR2和VChR1,實現了激發光紅移;黃光在組織中的穿透性強于藍光,因此激活組織中VChR1所需激光能量更低,降低了組織發熱現象。然而這種紅移光敏蛋白產生光電流的動力學性能差,難以實現對神經元活動的高頻調控,并且它在細胞膜上的表達能力較差。2013年,Lin等18報導了ReaChR光敏蛋白,他們利用這種光敏蛋白實現了顱外紅光(655 nm)照射,調控小鼠觸須的運動行為。相比于VChR1,該蛋白的激發光波長進一步紅移,且在細胞膜上的表達能力得到了提高。還有許多團隊在光敏蛋白激發光紅移方向做了努力,比如2011年Yizhar等19報導的光敏蛋白C1V1 (E122T)在紅光(630 nm)照射下能可靠地觸發動作電位,2014年Klapoetke等20報導的光敏蛋白Chrimson能穩定地被紅光(660 nm)激活。但到目前為止,以近紅外光(NIR,650-1350 nm)為激發光的光敏蛋白尚未有報導。
作為一種替代手段,上轉換納米粒子(UCNPs)可以將低頻的NIR轉換成高頻的可見光用于激活光敏蛋白,間接實現NIR光遺傳體系21,22。由于生物組織對NIR的吸收和散射作用較弱23-26,因此UCNPs介導的NIR光遺傳體系相比于其他光遺傳體系具有許多獨特的優勢。理論上,將UCNPs引入表達了光敏蛋白的神經元附近,通過照射NIR,即可控制神經元表面離子通道的激活或關閉。然而在活體光遺傳實驗中,還需要考慮諸多因素。首先,UCNPs的各項參數應當與光遺傳實驗相匹配:1)激活UCNPs所需的激發光在組織中的穿透能力和吸收性;2)UCNPs的發射光譜與所用光敏蛋白的激發光譜的匹配性,二者重合度越高,越容易實現對UCNPs的激活;3)UCNPs的發光壽命與選用的光敏蛋白對激發光的響應時間的匹配性。其次,在激發光波長等條件一定的情況下,若UCNPs上轉換效率較低,則需要使用較大功率的NIR才能得到足夠高的上轉換熒光能量來激活光敏蛋白,而大功率NIR會導致組織發熱,這嚴重制約了UCNPs在光遺傳實驗中的應用。因此,如何在保持良好生物相容性的同時提高UCNPs的熒光強度對其在光遺傳體系的廣泛應用具有深刻意義。本文將著重介紹UCNPs的各項參數如激發波長、發射波長、發光壽命與光遺傳實驗的匹配性問題以及增強UCNPs的轉換效率的方法,主要包括優化UCNPs結構和修飾有機染料兩種方法,總結和討論了UCNPs介導的光遺傳工作,并對構建同步進行調控和檢測活體大腦電活動的低損傷、雙向神經界面進行了展望。
2 UCNPs參數與光遺傳實驗的匹配
利用UCNPs作為激活光源進行光遺傳實驗,需要考慮所選用的UCNPs的激發光在組織中的穿透能力與吸收性、UCNPs的發射光與光敏蛋白吸收峰的重合度以及UCNPs的發光壽命與光敏蛋白的響應時間之間的匹配性問題。
2.1 UCNPs的激發光
不同波長的激發光在組織中穿透能力以及組織中的水對其吸收能力均不相同。在近紅外光波段范圍內,通常波長越長,其在組織中的穿透能力越強,但同時組織中的水對其吸收能力也越強,兩種情況在極端情況下都容易導致組織過熱,因此在選擇激發波長時需要折中考慮。通過在UCNPs的結構中引入不同稀土元素作為敏化劑可以調節其激發波長。例如Yb3+離子的吸收中心為980 nm,以該離子為敏化劑的UCNPs可被980 nm激發光激活,進行上轉換過程27。然而,組織中的水對該波長的吸收性相對較強。以Nd3+離子作為敏化劑的UCNPs可在800 nm激發光的照射下進行上轉換過程28,29。雖然800 nm激發光在組織中的穿透能力比980 nm弱,但是它在組織中的水吸收系數比980 nm要小幾十倍23,28,30。因此,在活體光遺傳實驗中選擇敏化劑離子的時候,需要綜合考慮其激發波長在組織中的穿透能力和吸收性。并且UCNPs通過選擇不同敏化劑離子調節激發光波長是一個相對獨立的過程,不會限制其發射光的設計,該特性為光遺傳實驗的設計帶來了便利。
2.2 UCNPs的發射光
由于光敏蛋白的激發波長不盡相同,調控UCNPs的發射光譜,使之與光敏蛋白的激發光譜相匹配,對高效地進行光遺傳實驗至關重要。UCNPs的發射光譜主要依賴于激活劑所用稀土元素的特征發射峰31。例如Tm3+離子具有475 nm的發射峰,可用于激活吸收峰為藍光的光敏蛋白。而Er3+離子的最強發射峰為543 nm27,32,Ho3+離子的發射峰為541 nm33,可以激活對綠光甚至黃光敏感的光敏蛋白。除此之外,Er3+離子還有651 nm的發射峰27,32,可用于激活對紅光敏感的光敏蛋白。因此,Tm3+、Er3+和Ho3+的發射峰波段范圍可以匹配許多光敏蛋白的激發光譜。盡管Er3+和Ho3+的發射峰接近黃光,但是用它們激活以黃光為激發光的光敏蛋白效率較低,而近期報道以Eu3+離子作為激活劑的UCNPs具有590和616 nm發射峰34,35,能高效地激活以黃光為激發光的光敏蛋白。如果UCNPs的發射光譜與光敏蛋白的吸收光譜匹配度較低,激活光敏蛋白所需的激光能量就要更高,甚至無法激活光敏蛋白。因此在活體光遺傳實驗中選擇激活劑離子的時候,需要考慮該激活劑離子的發射光譜與所選光敏蛋白的激發光譜之間的匹配度,以實現高效地調控神經電活動。
2.3 UCNPs的發光壽命
最后,不同光敏蛋白對激發光的響應時間不同,在時間精度上能達到毫秒級1-4。而稀土離子的發光響應也具有一定壽命,即從激發態返回到基態所用平均時間31,其本征衰減曲線從微秒級到毫秒級不等。如果稀土離子的發光壽命超出光敏蛋白的響應時間過多,則會導致激發調控神經活動能跟隨的激發光脈沖頻率降低。反之,如果UCNPs的發光壽命遠小于光敏蛋白的響應時間,則會導致光敏蛋白難以激活。因此在UCNPs介導光遺傳實驗的設計過程中,稀土離子的發光壽命和光敏蛋白的響應時間相匹配也是一個需要考慮的因素。在材料合成過程中,通常可通過調節摻雜劑濃度36-38、UCNPs尺寸39,40和結構中能量傳遞過程41,42來調節UCNPs的發光壽命,使之與相應的光敏蛋白匹配。
3 增強UCNPs轉換效率的方法
如前所述,在光遺傳實驗中,增強UCNPs的轉換效率能有效降低激發光能量,從而降低組織熱損傷。其中增強UCNPs轉換效率主要可以通過設計殼結構保護納米顆粒表面和修飾有機染料提升納米顆粒光吸收能力兩種方式實現。如果能夠結合兩種方式的優點,則能達到更好的增強效果。
3.1 通過設計核殼結構增強UCNPs轉換效率
UCNPs的表面態對其轉換效率影響很大,由于UCNPs的比表面積較大,其表面有較多的雜質、配體和溶劑分子,從而導致多光子弛豫效應,使UCNPs表面摻雜離子猝滅而減少發光中心發光離子的數量,從而造成能量損失。除此之外,UCNPs內部的摻雜離子會通過能量轉移過程將激發能量傳遞給表面猝滅位點,產生非輻射弛豫,降低轉換效率。因此,抑制表面猝滅能有效地提高UCNPs的轉換效率。目前,利用基質材料作鈍化殼是一種常用的抑制表面猝滅的手段。如2007年Yi等43報導了一種核-鈍化殼結構的UCNPs,他們在NaYF4:Yb核的表面包裹一層NaYF4作為鈍化殼。實驗結果表明,與未包裹鈍化殼的UCNPs相比,這種核-鈍化殼結構的UCNPs的轉換效率提高了30倍。通過相似的原理,Mai等44在2007年、Ansari等45在2016年對NaYF4:Yb/Er UCNPs做了鈍化殼處理,都成功地增強了UCNP的轉換效率。2008年Sch?fer等46報導的KYF4:Yb/Er UCNPs經過鈍化殼處理后,轉換效率顯著提升(圖1a,b)。
除此之外,在鈍化殼中摻入合適濃度的敏化劑或者敏化劑和激活劑得到的活性殼不僅能抑制UCNPs的表面猝滅效應,而且還能增強UCNPs對NIR能量的吸收和傳遞能力,從而進一步增大UCNPs的轉換效率。2009年,Vetrone等47把NaGdF4:Yb活性殼包裹到NaGdF4:Yb/Er表面,相比于之前提及的用鈍化殼包裹UCNPs抑制表面猝滅提高轉換效率的方法,這種方法得到的綠色熒光和紅色熒光分別增強了3倍和10倍(圖1c,d),這是由于加入的Yb3+離子能夠存儲激活能,隨后又能高效地將能量傳遞給核中的激活劑。還有許多諸如此類應用殼結構抑制表面猝滅的研究工作都成功實現了對UCNPs轉換效率的顯著提升48-54。
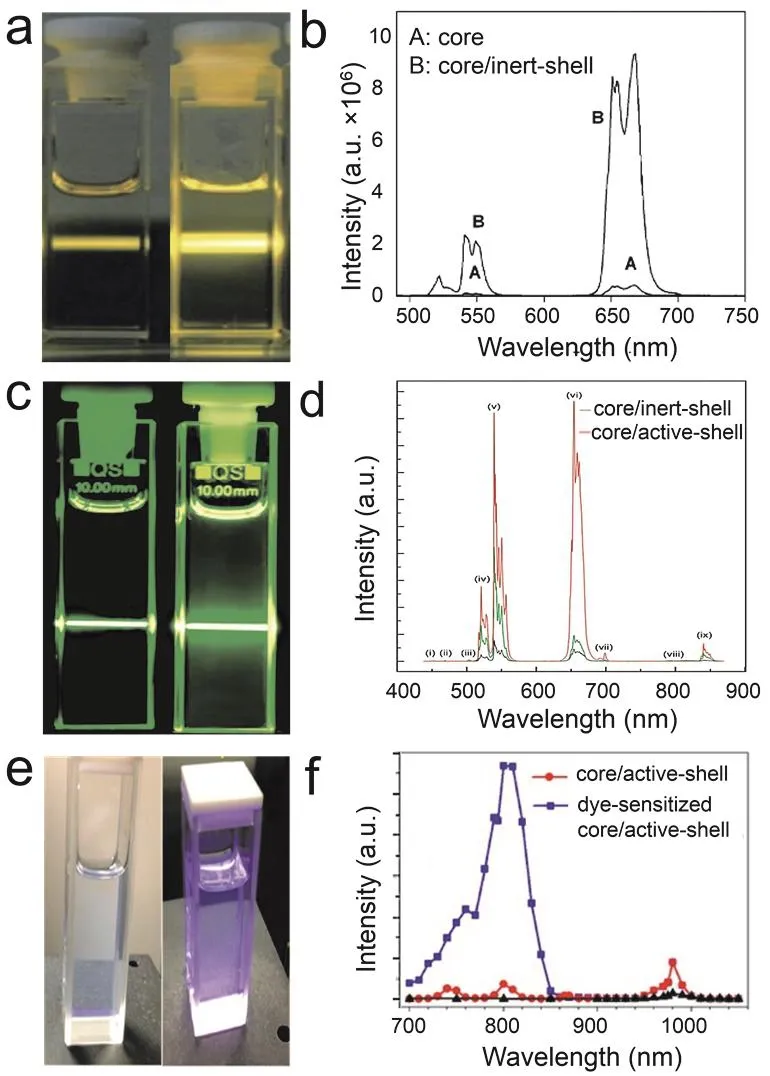
圖1 各種增強上轉換效率方法的熒光強度和發射譜對比Fig.1 Enhanced upconversion efficiency of different kinds of core-shell UCNPs.
3.2 通過修飾有機染料增強UCNPs轉換效率
雖然通過殼的保護以及敏化劑和激活劑的摻入可以在很大程度上提升UCNPs的轉換效率,但UCNPs中的鑭系離子光吸收截面小和激發峰窄的本質特性導致許多激發光沒有被捕獲,這限制了熒光亮度的進一步增強。有機染料的光吸收截面比鑭系離子大3到4個數量級,研究發現,對UCNPs修飾有機染料之后能有效提高UCNPs捕獲外界激發光子的能力,從而進一步提高UCNPs的轉換效率。2012年,Zou等55首次實現了對UCNPs修飾有機染料,他們的實驗證明經染料修飾后的UCNPs在很寬的波長范圍內都具有吸收能力,并且相比于未經染料修飾的UCNPs,轉換效率增強了~3300倍。隨后研究人員對UCNPs修飾不同的熒光基團,提高UCNPs轉換效率,如2015年,Wu等56對UCNPs分別修飾了商業有機染料IR-783和IR-820以及他們團隊自己合成的IR-808和IR-845有機染料,經實驗對比,修飾了IR-808染料的UCNPs在在相應激發光照射下,其熒光亮度比沒有修飾有機染料的UCNPs提高了200倍,而修飾了IR-845、IR-783、IR-820染料的UCNPs相比于沒有修飾染料的UCNPs,熒光亮度分別提高了100倍、80倍和70倍。按照相同方法,2017年Lee等57也實現了修飾有機染料增強UCNPs的上轉換效率。
3.3 結合兩種方法增強UCNPs轉換效率
如前所述,在UCNPs的設計過程中,如果能夠將設計殼層結構保護納米顆粒表面和修飾有機染料提升納米顆粒光吸收能力兩種方式結合到一起,有望達到更好的增強轉換效率的效果。修飾了有機染料的核殼結構UCNPs結合了核殼結構的優勢和染料分子優良的光捕獲能力,極大程度地提高了UCNPs的轉換效率。其主要的增強原理是在經過有機染料修飾過的核殼結構UCNPs體系中,有機染料可以高效地吸收紅外光,將這些能量傳遞給殼中的敏化劑,隨后這些敏化劑會將這些能量輸送到核內的敏化劑,最后這些能量被核內敏化劑附近的激活劑捕獲進行上轉換。2015年,Chen等58報導的染料修飾的核殼結構UCNPs,通過這種多級能量傳遞方式,實現了轉換效率~100倍的提升(圖1e,f)。修飾了有機染料的核殼結構UCNPs的上轉換效率遠大于普通UCNPs,這給UCNPs在光遺傳領域的應用帶來了契機。2016年Wu等59發現經IR-806修飾過的核殼結構UCNPs的轉換效率很高,僅需1.5 W·mm-2的NIR (800 nm)就能激活表達了ReaChR光敏蛋白的海馬神經元。但是此實驗只在細胞層面驗證了UCNPs在光遺傳領域的應用,在活體中的近紅外光調控神經活動實驗有待進一步開展。
4 UCNPs在光遺傳領域的應用實例
相比于可見光,組織對NIR的吸收和散射要弱很多,因此NIR在組織中的穿透性優于可見光。UCNPs可以將組織穿透性好的NIR轉換成可激活光敏蛋白的可見光,因此將UCNPs應用到光遺傳實驗中,可以實現顱外激光照射調控深腦神經元活動。對此,研究人員開展了一系列工作,拓展了光遺傳在腦科學中的應用。
4.1 UCNPs的體外光遺傳應用
2015年,Hososhima等60首次將UCNPs應用到光遺傳實驗,他們在含有UCNPs的聚合物薄膜上培養表達了C1V1光敏蛋白的細胞,當用NIR (980 nm)照射培養細胞的薄膜基底時,薄膜中的UCNPs發出綠色熒光并激活培養在薄膜上的細胞,使其產生動作電位。該工作首次實現了將UCNPs與光遺傳實驗相結合,通過用生物相容性好的聚合物薄膜包裹UCNPs的方法巧妙地避免了納米粒子與細胞直接接觸導致的細胞毒害作用。然而相比與前面介紹到的2016年Wu等59的染料敏化核殼結構的UCNPs-僅需1.5 W·mm-2的NIR (800 nm)激活光敏蛋白,該工作中所用的激光功率高達58 W·mm-2,如此高功率的NIR照射會導致細胞溫度升高,不僅會影響細胞活性,而且會激活細胞膜上自然存在的熱敏蛋白,影響試驗結果。為了提高轉換效率,2015年Shah等61合成了核殼結構UCNPs,他們將核殼結構的UCNPs與PLGA混合形成基底,研究轉染了ChR2的神經細胞是否能被NIR激活。實驗結果表明,這種核殼結構的UCNPs在8 W·mm-2的NIR (980 nm)照射下發出的藍色熒光足夠激活ChR2光敏蛋白,并且能在10 Hz脈沖NIR照射條件下穩定獲得重復出現的動作電位(圖2)。雖然這些工作證明了UCNPs發出的熒光能夠激活表達了光敏蛋白的細胞,但是由于體外培養環境與活體環境的差異巨大,UCNPs介導的活體光遺傳還要解決很多難題,例如:1)將包含UCNPs的聚合物薄膜植入組織時,植入的體積太大會給組織帶來很大損傷,植入體積太小熒光強度不足以激活光敏蛋白;2)活體實驗中NIR需要穿透皮膚、顱骨、腦組織等等,這些都會導致NIR的光強變弱,因此增大激發光能量不可避免,而這可能會導致溫度升高,對組織造成傷害。
4.2 UCNPs的活體光遺傳應用
2016年Bansal等62首次將UCNPs用于活體光遺傳實驗。該工作首先對轉染了ChR2的線蟲做饑餓處理,隨后將饑餓的線蟲暴露到他們合成的UCNPs (Si外殼,發射藍色熒光)溶液中使線蟲攝取UCNPs,最后通過施加準連續NIR (980 nm)光照射線蟲,成功調控了線蟲的運動方向(圖3),并且沒有發現明顯的組織過熱和納米粒子毒性的副作用。除此之外,2017年Ai等63在幼年斑馬魚模型中,也通過用NIR (808 nm)照射UCNPs發射藍色熒光,成功激活ChR2光敏蛋白。值得注意的是,線蟲和幼年斑馬魚的身體透明度相對較高,對光的透過性好,因此對于UCNPs在組織穿透性較差的嚙齒類動物中的光遺傳應用還有待進一步探索。
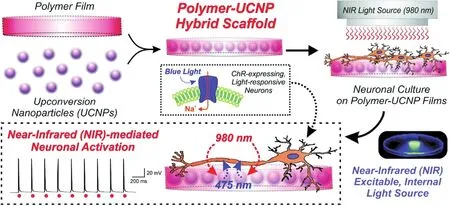
圖2 用包裹UCNPs的聚合物薄膜實現光遺傳激活神經元的示意圖61Fig.2 Schematic diagram depicting the generation and application of polymer-UCNP hybrid scaffolds for optogenetic neuronal activation 61.
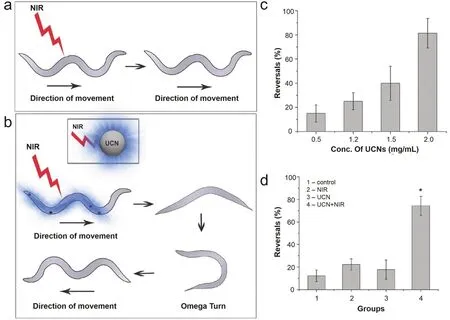
圖3 UCNPs介導的NIR光遺傳調控線蟲運動行為62Fig.3 Modulation of movement behavior in C.elegans by UCNP-mediated NIR optogenetics 62.
2017年Lin等64首次將UCNPs應用到嚙齒動物光遺傳實驗(圖4a,b,c)。他們通過摻雜Tm3+離子或Er3+離子,得到了發射熒光波長與ChR2和C1V1光敏蛋白相匹配的核殼結構UCNPs。他們將分散有此UCNPs的溶液加入微玻璃管,待溶劑揮發后剪斷微玻璃管并密封好,隨后將鎢絲電極與此光學器件綁到一起,最后將此器件植入大鼠腦組織,通過顱外施加980 nm 的NIR,在功率為7 mW·mm-2和4.4 mW·mm-2時,分別成功激活了發射波長為470 nm和540 nm的UCNPs,并相應激活了V1M腦區(1 mm深)的ChR2和C1V1光敏蛋白,記錄到了相應的動作電位,實現了同時對神經活動的調控和神經信號的檢測。但是值得注意的是,此實驗是在老鼠麻醉狀態下進行的;所選腦區距離腦表僅1 mm,經過選用合適的光敏蛋白,通過顱外照射可見光即能對該深度的神經元進行調控;且微玻璃管包裹雖然能夠使UCNPs與細胞隔離,降低對細胞的毒性,但玻璃管和所用鎢絲電極都是剛性的,會對組織造成一定程度的損傷以及炎癥反應,因此生物相容性有待進一步提高。同年,Wang等65利用相同方法制備了負載有UCNPs的光學器件,通過埋植該器件實現了顱外施加NIR (980 nm,5 mW·mm-2)調控自由活動老鼠VTA腦區(4.5 mm深)、皮層紋狀體腦區(3 mm深)和視覺皮層腦區(1 mm深)的神經活動。其實驗結果證實負載UCNPs的光學器件植入組織后沒有引發嚴重的免疫反應,并且NIR照射時皮膚的溫度沒有顯著升高。這說明該方法可以用于自由活動老鼠深腦光遺傳實驗。通常來說,相比于激活興奮性光敏蛋白,激活抑制性光敏蛋白需要更高能量的熒光照射,這就要求UCNPs具有更高的轉換效率66。2018年,Lin等67通過核殼殼結構進一步增強了UCNPs的轉換效率,與之前所用核殼結構UCNPs相比,轉換效率提升了~3倍。利用相同方法,他們實現了將UCNPs用于神經活動抑制的實驗,并同時成功地檢測到了神經元的動作電位(圖4d,e,f,g)。他們通過體外NIR (980 nm,6 mW·mm-2)照射自由活動老鼠,成功激活了大鼠STN腦區(7.8 mm深)和小鼠次級運動皮層(0.5 mm深)中神經元細胞膜表面的抑制性光敏蛋白-eNpHR3.0,記錄到了大鼠相應腦區中的電生理信號,并且實現了調控自由移動小鼠的運動功能。
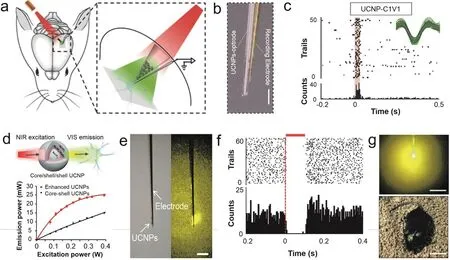
圖4 植入負載UCNPs的微玻璃管實現NIR光遺傳調控老鼠神經活動Fig.4 NIR neuromodulation in mice/rats by micro-optrodes containing UCNPs.
為了減小剛性器件與柔性組織力學性能不匹配帶來的損傷,構建更穩定的神經調控界面,2018年Chen等68直接注射含有UCNPs的溶液到腦組織,實現了顱外照射NIR (980 nm,96W·mm-2)激活光敏蛋白,調控小鼠VTA腦區的神經活動(圖5a,b,c)。他們所用UCNPs為SiO2包裹的核殼結構UCNPs。SiO2的包裹解決了UCNPs對細胞的毒害作用,因此在細胞毒性表征實驗中沒有發現顯著的細胞毒害作用。并且由于沒有引入大尺寸剛性材料,實驗中沒有發現嚴重的免疫反應,這體現了該方法良好的生物相容性。此研究還發現,SiO2包裹的UCNPs注射到體內一個月后還能穩定停留在注射位點附近,沒有發現很明顯的擴散,這證明該方法可以實現在一定時間期限內穩定調控動物神經活動(圖5d)。相比于前述用高光敏性光敏蛋白進性顱外可見光照射調控小鼠活動的實驗而言,該工作中UCNPs是定點注射的,其發射光只會調控注射位點附近神經元的活動性,因此這種給光方式的空間精度更高;相比于用微玻璃管負載UCNPs植入腦區的工作,這種注射UCNPs的方法無需將剛性器件植入腦組織,因此對組織造成的損傷更小,具有更良好的生物相容性。之后,2019年Miyazaki等21將一種已實現商品化的微米尺寸上轉換顆粒注射到腦組織之后,通過顱外施加NIR(976 nm)照射成功激活了小鼠mPFC和dSTR腦區中表達了C1V1光敏蛋白的神經元,并且調控了自由移動小鼠的運動行為(圖6)。為了研究此方法的穩定性,Miyazaki等將這種上轉換顆粒注射到腦組織,兩個月后通過MRI實驗結果發現注射的上轉換顆粒沒有發生明顯的擴散。這可能是因為這種上轉換顆粒是微米尺寸的,相比于納米尺寸顆粒,其擴散性要小許多。因此,通過合理優化上轉換材料的結構、組成、尺寸以及使用方法等參數,基于上轉換材料的光遺傳技術有望實現長期穩定地利用NIR調控動物深部腦區神經活動。
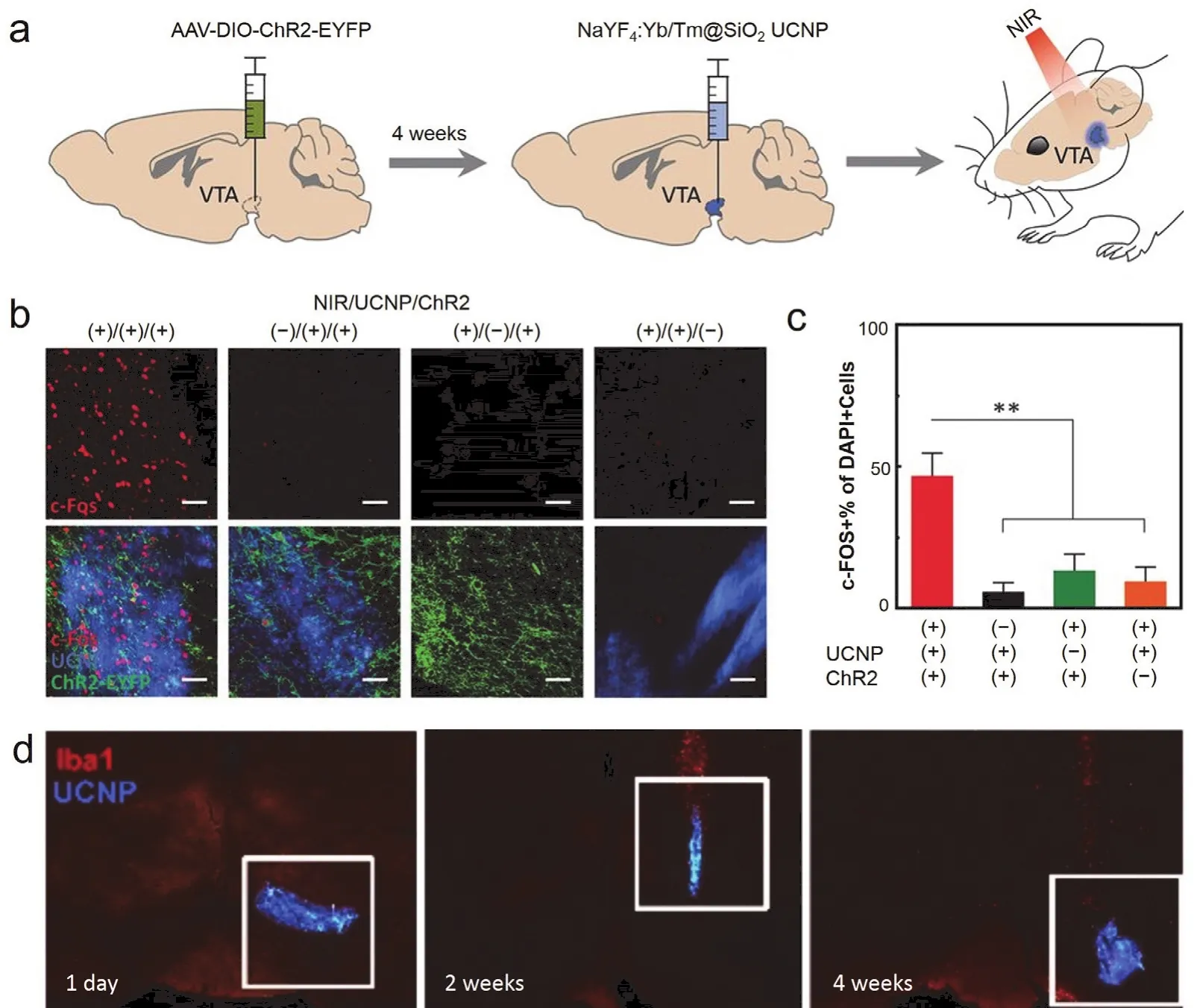
圖5 注射含有UCNPs的溶液實現NIR光遺傳調控小鼠神經活動68Fig.5 NIR neuromodulation in mice by injecting solution containing UCNPs 68.
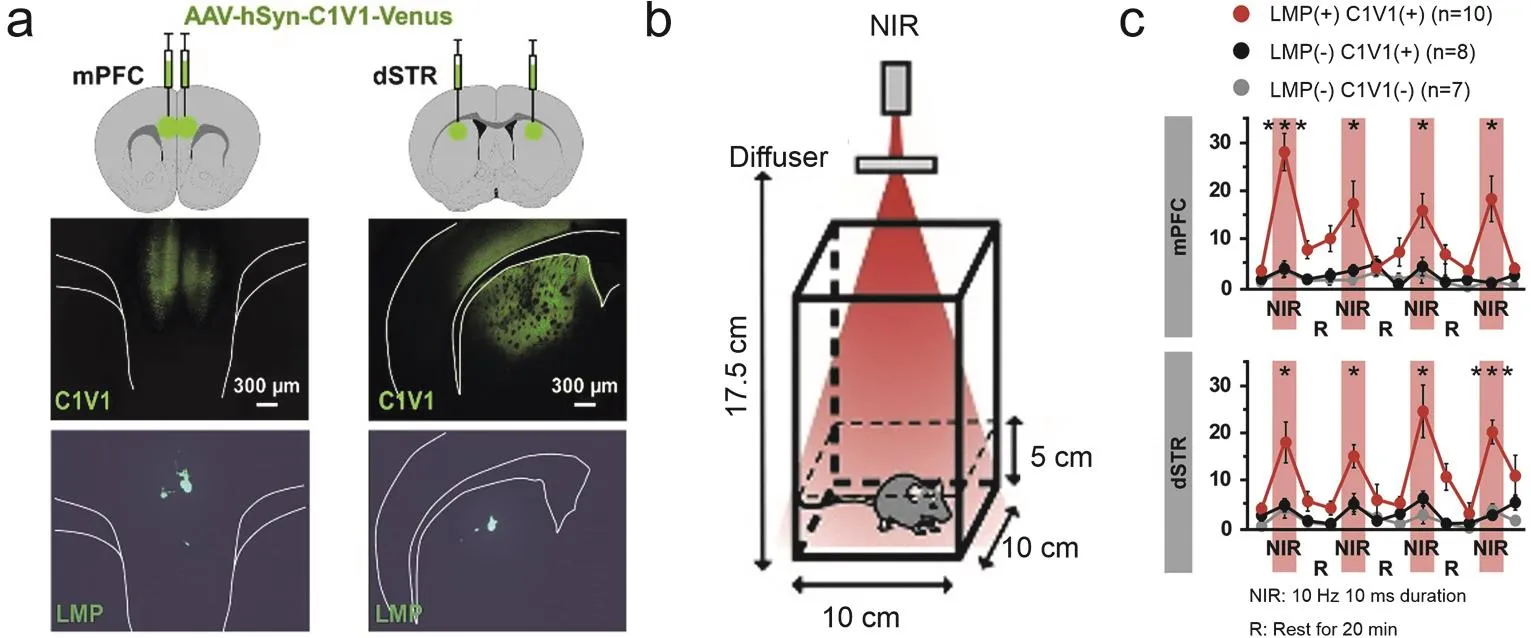
圖6 注射含有上轉換微粒的溶液實現NIR光遺傳調控小鼠神經活動21Fig.6 NIR neuromodulation in mice by injecting solution containing lanthanide micro-particles (LMPs)21.
5 總結與展望
UCNPs可以將組織穿透性好的NIR轉換成與光敏蛋白匹配的可見光,將UCNPs與光遺傳技術相結合,從而實現顱外照射NIR激活深腦中表達了光敏蛋白的神經元,對自由移動動物的行為進行調控。相比于傳統光遺傳技術,基于UCNPs的光遺傳技術不需要在動物組織中植入光纖或微型LED等光學設備,因此,UCNPs介導的光遺傳實驗對動物組織的損傷更小。同時由于不需要用連接連接線埋植在動物腦中的光學設備和外部光源設備,因此在行為學實驗中動物的活動更能反映動物的真實狀態,提高動物行為學的可靠性,這些對研究人員了解神經環路的結構與功能非常有益。因此用UCNPs介導的NIR光遺傳技術備受研究人員青睞,近年來發展迅速。盡管如此,轉換效率低、組織發熱、納米粒子對細胞的毒害作用、納米粒子在組織內的穩定性差等問題限制了該體系的廣泛應用。通過設計殼結構避免表面猝滅效應,修飾有機染料提高光吸收能力等手段可以提高UCNPs轉換效率。轉換效率的提高能降低所需激發光的能量,因此同時也能減輕組織發熱的問題。通過對UCNPs表面修飾生物兼容材料或者將UCNPs包裹到柔性生物兼容聚合物中,能夠避免UCNPs與細胞直接接觸,從而解決UCNPs對細胞的毒害問題。與此同時,UCNPs被聚合物包裹后植入組織,其空間位置將被嚴格限制,不再擴散,因此可以長期穩定發揮作用。
高時空精度地調控和檢測神經活動對了解神經元之間如何交流以及行為功能如何發生是非常重要的69-73。但是目前將UCNPs介導的小損傷光遺傳技術與神經電極技術,尤其是柔性神經電極技術結合的研究工作較少;2015年Liu等74研發了一種可注射網狀柔性神經電極,相比于金屬絲電極或者硅電極,這種柔性電極與大腦力學性能更匹配,能構建更穩定的神經界面,有利于長期檢測神經元活動。2019年Guan等75研發了一種操作簡便的自組裝柔性神經流蘇電極,這種電極在聚乙二醇(PEG)聚合物的熔融液中自組裝后固化得到直徑為幾十微米的針狀電極,即能順利植入腦組織,隨后PEG降解,神經電極恢復柔性。這種柔性神經電極可以與大腦構建優良的神經界面,實現對神經元動作電位長期穩定地檢測。將這種柔性電極與UCNPs介導的光遺傳結合,有望構建穩定的雙向神經界面,實現小損傷長期檢測與調控神經活動,這對腦科學基礎研究和神經疾病治療等具有重要的應用價值。

