不同溫度處理對紅蕓豆蛋白熱穩定性及結構的影響
陳振家,王曉聞,荊 旭,梁亞萍
不同溫度處理對紅蕓豆蛋白熱穩定性及結構的影響
陳振家1,王曉聞1※,荊 旭1,梁亞萍2
(1. 山西農業大學食品科學與工程學院,太谷 030801; 2.山西農業大學校醫院,太谷 030801)
為探究加熱過程中紅蕓豆分離蛋白(Red Kidney Bean Protein Isolate, KPI)溶解特性和結構特性變化及評估不同溫度(50~95 ℃)處理對KPI溶液熱聚集特性的影響,該研究以不同溫度處理KPI溶液為研究對象,采用熱力學和光譜學對其熱聚集特性進行分析。結果表明:隨處理溫度升高,紅蕓豆蛋白溶解度呈先升后降趨勢,70 ℃時蛋白溶解度達到最高值82.68%,溫度升高至95℃時,溶解度下降至65.63%;電泳結果顯示,90 ℃處理蛋白上清液電泳圖譜中出現一條分子量約為135 kDa的新條帶。隨溫度升高,總巰基數量則呈下降趨勢,游離巰基呈先升后降趨勢。隨溫度上升,加熱造成蛋白-螺旋結構占比呈下降趨勢,不規則結構占比呈上升趨勢,-折疊和-轉角變化幅度不大,而KPI內源熒光的最大發射波長呈紅移趨勢。研究結果為紅蕓豆食品熱加工工藝優化和質量控制提供了理論基礎。
熱處理;熱穩定性;溶解度;紅蕓豆蛋白;二硫鍵;二級結構;內源熒光發射光譜
0 引 言
蕓豆(.L)學名菜豆(俗稱二季豆、四季豆或腰豆),一年生草本植物,豆科菜豆屬,是亞洲、南美和非洲地區廣為種植和消費的一種食用豆類。2017年,FAO統計數據顯示全球蕓豆產量排名第一的是印度,緊隨其后的是巴西、中國和墨西哥。蕓豆品種繁多,大多根據其皮色進行劃分,主要有:紅蕓豆、白蕓豆、黑蕓豆和奶花蕓豆等品種。紅蕓豆蛋白質量分數為200~300 g/kg,由于其蛋白含量高,同時具有高纖維、低脂肪的營養特性,使得紅蕓豆成為全世界人類和動物的高蛋白攝取來源[1]。然而其蛋白并未完全開發成為類似于大豆分離蛋白這樣的商業產品,蛋白價值并未得到充分利用[2]。
紅蕓豆蛋白中的主要成分為菜豆球蛋白。菜豆蛋白可以分為S和T兩種類型,其中S型比T型消化性更好[3]。目前球蛋白主要的3種構型為T(Tendergreen)型、C(Contender)型和S(Sanilac)型,這3種構型總計有9條不同的多肽鏈組成,T和S兩種構型本質上完全不同,而C型介于T和S型之間[3-5]。相比動物蛋白,豆類蛋白有著自身的營養缺陷,表現為氨基酸組成中缺乏含硫氨基酸和色氨酸,蛋白中含有抗營養因子凝集素。菜豆凝集素很大程度上抑制蛋白酶活性,延緩小鼠機體生長,改變腸道組織[6],同時也會刺激幼崽過早發育[7]。
加熱處理不僅能夠鈍化凝集素,而且能較大程度改善其消化性[8-9],因此,人類攝取豆類食物時通常有加熱工序。但是,蛋白質對所處環境的變化非常敏感,任何化學和物理條件的改變都會影響其結構變化,進而導致聚集發生,蛋白結構微小差異也會影響到其消化性和熱穩定性[10]。加熱會導致蛋白發生變性,亞基解離、結構去折疊、疏水基團暴露于表面。變性通常伴隨去折疊蛋白分子的聚集,同時會改變蛋白的部分功能特性(凝膠性、起泡性和乳化性)[11]。李向紅等[12]通過不同干燥方式對大豆蛋白熱聚集體形成的影響進行分析研究,結果表明干燥過程中蛋白聚集體體系結構發生重組;陶汝青等[13]發現熱處理過程中大豆蛋白的熱變性程度對豆腐花粉凝結的凝膠強度和所需時間具有顯著影響;王喜波等[14]研究表明不同加熱殺菌方式會改變牛乳清蛋白結構,導致蛋白無規則卷曲結構含量增加,結構轉變更為無序;Fumio等[15]在分子角度理解大豆蛋白質的熱致現象中認為,球蛋白在加熱過程中會發生明顯的解離,解離后的亞基會通過二硫鍵和其他非共價鍵重新形成二聚體或三聚體;Gharibzahedi等[16-18]的研究也表明,熱處理對大豆分離蛋白及其制品的功能性質,如溶解性、乳化性、凝膠性等具有較大影響。
目前,國內關于加熱處理對紅蕓豆蛋白結構及物化特性的研究鮮有報道。本文以紅蕓豆蛋白為研究對象,通過不同溫度處理比較分析蛋白的聚集特性和結構特性變化規律,以期為實踐生產中紅蕓豆蛋白食品熱加工工藝優化和質量控制提供理論基礎。
1 材料與方法
1.1 試劑
紅蕓豆(品蕓三號),購于太谷農貿市場;電泳試劑(AMRESCO分裝)、考馬斯亮藍G-250、牛血清蛋白,上海生工生物工程技術服務有限公司;低分子量標準蛋白,上海生物化學研究所。
1.2 儀器
電泳槽(DYCZ-24D型)、電泳儀(DYY-6C型),北京六一廠;凝膠成像分析系統(WD-9413A),北京六一廠;T18-basic高速剪切儀,德國艾卡設備有限公司;FD-1冷凍干燥機,北京博醫康技術公司;LS55熒光分光光度計,美國Perkin-Elmer公司;Chirascan圓二色譜儀,英國Applied Photophysics公司;Q20差示掃描量熱儀,美國TA公司。
1.3 試驗方法
1.3.1 紅蕓豆分離蛋白制備
將紅蕓豆研磨成粉(過80目篩0.180 mm),按固液比1:10(g/mL)將紅蕓豆粉與石油醚混合攪拌8 h,去除石油醚油脂混合液,沉淀通風處放置24 h后即為紅蕓豆脫脂粉。將紅蕓豆脫脂粉按料液比1:15(g/mL)加蒸餾水混合,溶液調pH值至8.5,攪拌2 h,紗布過濾后2 800離心15 min,棄去沉淀,上清液調酸至pH值4.5,靜置30 min后,2 800離心5 min去除上清。沉淀水洗3次后加蒸餾水復溶并調pH值至中性,最后經冷凍干燥備用,冷阱溫度-40 ℃,干燥真空度0.09 MPa,干燥時間24 h。蛋白質質量分數87.45%,含水率5.36%[19]。
1.3.2 紅蕓豆蛋白溶液不同溫度處理
配制pH值7.0,2%紅蕓豆蛋白(KPI)溶液(g/g),室溫攪拌2 h充分水化后,分別置于50、60、70、80、90和95 ℃溫度條件下處理30 min[13]。
1.3.3 蛋白溶解度測定
將不同溫度處理所得紅蕓豆蛋白溶液10 000離心15 min后取上清液,Bradford法測定上清液中可溶性蛋白含量。
1.3.4差示掃描量熱(Differential Scanning Calorimetry,DSC)分析
取10L 10%KPI溶液放入熱分析鋁盤中,密封后放入差示量熱掃描儀中。儀器恒溫至40 ℃持續15 min,此后以10 ℃/min的速率升溫至120 ℃,繪制加熱過程中的熱流變化曲線[20]。
1.3.5 蛋白濁度測定
將不同溫度處理所得紅蕓豆蛋白溶液用蒸餾水稀釋5倍后,震蕩搖勻后用10 mm比色杯在660 nm波長測其吸光值[21]。
1.3.6 游離巰基和總巰基的測定
將定量不同溫度處理所得紅蕓豆蛋白溶液加入反應緩沖液A(0.1 mol/L pH值8.0磷酸鈉緩沖液,含1 mmol/L EDTA),室溫下攪拌2 h,10 000離心10 min,取5.5 mL上清液加入0.1mL Ellman′s 試劑溶液,混合均勻后室溫避光放置15 min,412 nm下測量吸光值;空白加5.5 mL反應緩沖液A;根據標準曲線換算游離巰基含量。公式如下:
1=0.896+0.0023 (1)
式中為吸光值;1為游離巰基含量,mol/g。
將定量不同溫度處理所得紅蕓豆蛋白溶液加入反應緩沖液B(0.1 mol/L 、pH 8.0磷酸鈉緩沖液,含1 mmol/L EDTA,8 M尿素),室溫下攪拌2 h,10 000 ×離心10min,取5.5 mL上清液加入0.1 mL Ellman′s 試劑溶液,混合均勻后室溫避光放置15min,412nm下測量吸光度;空白加5.5 mL反應緩沖液B;根據標準曲線換算總巰基含量[21-23]。公式如下:
2=1.1821+0.0052 (2)
式中為吸光值;2為總巰基含量,mol/g。
1.3.7 聚丙烯酰胺凝膠電泳(SDS-PAGE)
將不同溫度處理所得紅蕓豆蛋白溶液10 000 ×離心10 min,上清液稀釋至1 mg/mL并與樣品緩沖液1:1混合,100 ℃煮沸5 min,上樣10L。濃縮膠質量分數5%,分離膠質量分數12%,恒壓電泳(濃縮膠100 V、分離膠150 V),當溴酚藍指示劑距膠底部5 mm時,停止電泳。固定30 min,考馬斯亮藍G-250染色8 h,脫色2 h,掃描成像,此為非還原SDS-PAGE。在上清液稀釋至1 mg/mL并與樣品緩沖液1:1混合過程中加入-巰基乙醇為還原SDS-PAGE[24]。
1.3.8 圓二色譜分析
將不同溫度處理所得紅蕓豆蛋白溶液用蒸餾水稀釋至0.2 mg/mL,取200L裝入0.1 cm光程的樣品池,在190~260 nm進行光譜掃描,掃描速度24 nm/min,重復掃描3次。采用DICHROWEB(http://dichroweb.cryst.bbk.ac.uk/ html/process.shtml)對所得結果進行在線擬合計算[25]。
1.3.9 內源熒光發射光譜
將不同溫度處理所得紅蕓豆蛋白溶液用蒸餾水稀釋至0.1 mg/mL。蛋白樣品在290 nm處激發,掃描300~400 nm的熒光發射光譜,狹縫寬10 nm,掃描速率200 nm/min[26]。
1.3.10 數據統計與分析
2 結果與分析
2.1 不同溫度處理對紅蕓豆蛋白溶解性的影響
由圖1可知,紅蕓豆蛋白溶液度隨溫度升高呈先升后降趨勢。50~70 ℃范圍內,蛋白溶解度呈上升趨勢,70 ℃時蛋白溶解度達到最高值82.68%,溫度進一步升高導致蛋白溶解度下降,95 ℃時溶解度下降至65.63%。蛋白溶解度與溫度的關系一方面取決于蛋白與水分的締合程度,另一方面取決于加熱過程中蛋白組分的聚集特性。一般而言,加熱會促進蛋白的水化能力,加強蛋白與水的締合能力,從而增大蛋白的溶解性;此外,加熱溫度超過蛋白的變性溫度后,蛋白變性會導致空間結構發生變化,疏水基團暴露增強多肽鏈的疏水性,導致蛋白發生疏水聚集;同時蛋白在熱作用下,部分通過非共價鍵和二硫鍵結合的亞基發生解離,在疏水作用力的推動下,選擇性進行的疏水締合,導致蛋白聚集沉淀,從而造成蛋白溶解度下降[27]。通過熱分析可知,紅蕓豆蛋白只有一個明顯的吸熱峰值,對應溫度為93.4 ℃,這說明紅蕓豆蛋白的變性溫度為93.4 ℃。由圖1可知,隨溫度增加直至70 ℃時,紅蕓豆蛋白在溶液體系中的水化能力不斷增加,由圖1a可知,溫度超過80 ℃時,紅蕓豆蛋白已開始發生變性,從而造成蛋白溶解度下降。
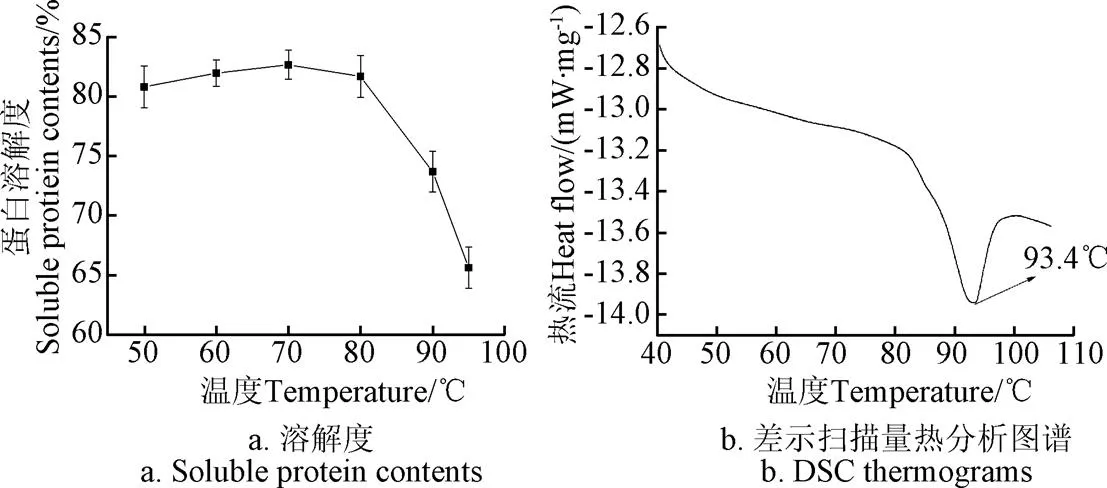
圖1 不同溫度條件下KPI溶解度和KPI的差示掃描量熱分析圖譜
2.2 不同溫度處理對紅蕓豆蛋白濁度的影響
由圖2可知,在25~50 ℃范圍內,紅蕓豆蛋白溶液濁度呈下降趨勢;50~100 ℃范圍內隨溫度增加,濁度呈上升趨勢;其中,90~95 ℃區間內,濁度有較大幅度增加。
濁度值反映蛋白溶液的聚集程度,濁度值越大,蛋白聚集程度越高。對比圖1和圖2,可以得知70~95 ℃區間內,紅蕓豆蛋白的溶解度與濁度值呈負相關。熱聚集既可以形成不溶性聚集體也可以形成可溶性聚集體,這都會導致蛋白質溶解度的下降,但只有形成不溶性聚集體才會造成蛋白質的沉淀。因此,隨溫度升高,熱聚集加劇,濁度升高而蛋白溶解度下降。
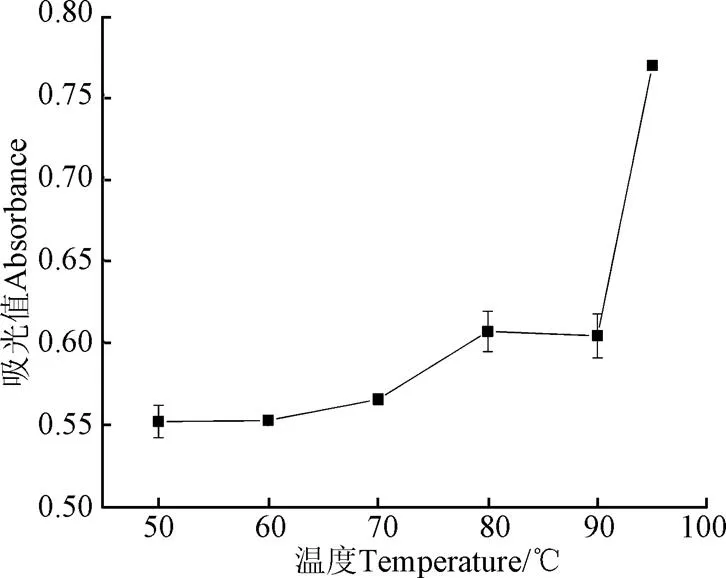
圖2 不同溫度下KPI濁度值
2.3 不同溫度處理紅蕓豆蛋白SDS-PAGE
蕓豆蛋白主要由豌豆球蛋白()和豆球蛋白()組成。豌豆球蛋白是一類7S球蛋白,常被稱為菜豆球蛋白(),它由3~5個亞基組成,占整個蛋白含量的50%。菜豆球蛋白是由-,-和-球蛋白組成的三聚體,且分子量分布在43~53 kDa[28]。豆球蛋白是一類11~12S球蛋白,它由酸性亞基和堿性亞基組成,酸性亞基和堿性亞基解離成單一組分時常常和豌豆球蛋白發生共沉淀。分子量為47 kDa的亞基條帶是豌豆球蛋白,而且其亞基之間沒有二硫鍵相連。因此在圖3中可以看到,菜豆球蛋白在非還原和還原電泳圖譜中沒有明顯差別。圖3中31、25、21和18 kDa的亞基條帶一般被認為屬于植物凝集素[29]。
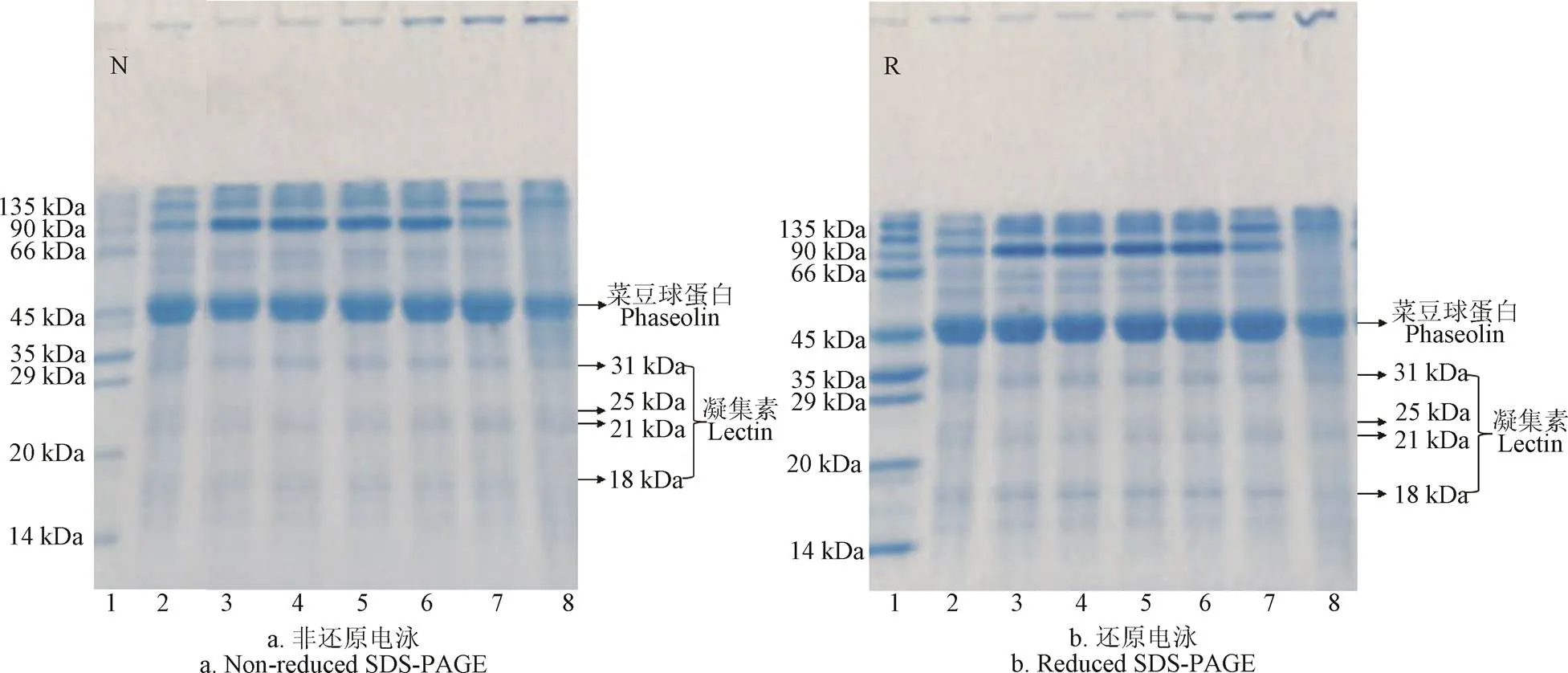
注:1:標樣;2:蛋白粉;3~8表示不同溫度條件,分別為50 ℃、60 ℃、70 ℃、80 ℃、90 ℃和95 ℃。
由圖3可知,紅蕓豆蛋白非還原和還原電泳圖譜中亞基分布相似,說明紅蕓豆蛋白質亞基締結形成過程中幾乎沒有二硫鍵的參與。非還原電泳圖譜中,80~95 ℃濃縮膠頂部出現明顯條帶,而這些條帶在50~70 ℃的電泳圖譜中未出現,說明隨溫度增加紅蕓豆蛋白發生聚集并形成大分子可溶性聚集體,這些條帶同樣出現在還原電泳圖譜中,說明并沒有因還原電泳中添加的-巰基乙醇而發生分子量變小的現象,因此推測這些大分子可溶性聚集體不是通過非二硫鍵形成的。隨溫度變化,紅蕓豆蛋白亞基分布在50~80 ℃范圍內未有變化;90 ℃時,90 kDa附近的亞基明顯變淺,而且在135 kDa附近出現一條明顯的條帶。當加熱至95 ℃時,90 kDa附近的亞基條帶消失,而45和135 kDa附近的亞基條帶變淺。對照圖1、圖2結果,可以得知溫度升高會促使蛋白亞基的聚集,而就熱聚集程度而言,90 kDa附近的亞基條帶在加熱過程中最易發生聚集,它是造成加熱過程中溶解度降低和濁度上升的主要原因,而135 kDa附近的兩條亞基條帶次之,45 kDa附近的豌豆球蛋白熱聚集程度最低。
2.4 不同溫度處理對紅蕓豆蛋白巰基含量的影響
由圖4可知,隨溫度升高,紅蕓豆蛋白總巰基在50~80 ℃范圍內變化不大,80~95 ℃范圍內,則呈下降趨勢;紅蕓豆蛋白游離巰基在50~95 ℃范圍內呈先升后降趨勢,80 ℃時紅蕓豆蛋白游離巰基含量最大。
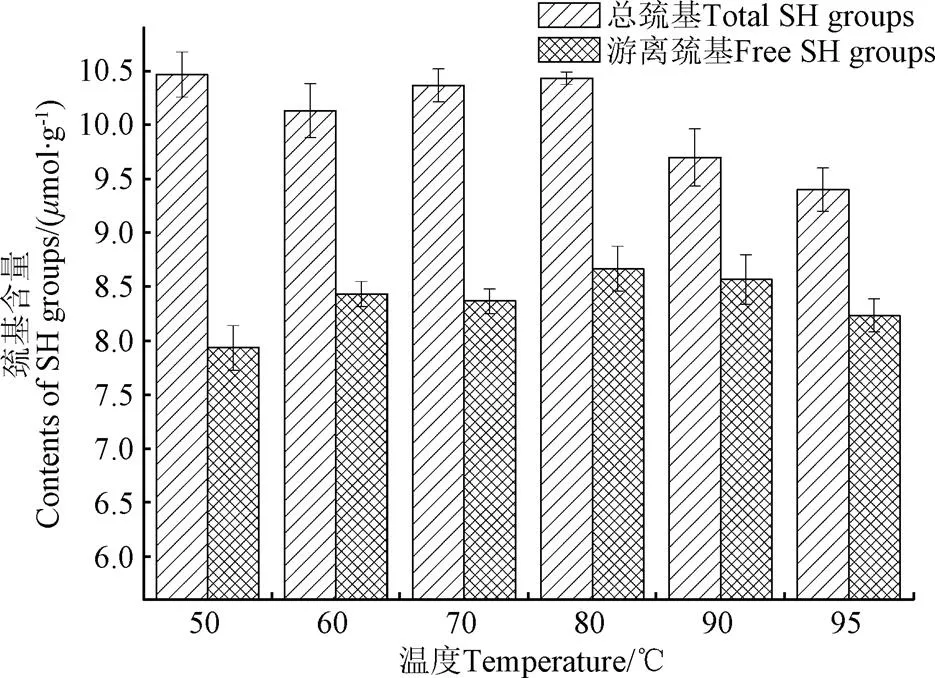
圖4 不同溫度條件下KPI游離巰基和總巰基含量
加熱會誘導蛋白構象發生改變從而改變游離巰基的數量,同時加熱處理也同時影響巰基和二硫鍵的相互轉換[30]。適度加熱能增加蛋白分子的親水性,促進蛋白的水合作用,此時有利于部分蛋白聚集體的解離,從而增加游離巰基數量。隨溫度進一步上升,部分蛋白變性,蛋白空間結構解離,部分疏水內核暴露,這也提高了游離巰基數量增加的機率。當加熱至蛋白變性溫度時,維系蛋白亞基間的二硫鍵斷裂,這本應繼續增加游離巰基數量,但變性后的蛋白亞基在疏水作用推動下發生大量聚集,這使得已暴露的游離巰基被部分包埋[31]。其次,熱致二硫鍵斷裂形成的游離巰基大多會重新形成新的二硫鍵以推動聚集體的形成。比如,大豆蛋白11S在90 ℃時,AB亞基的二硫鍵斷裂,而很快A亞基通過二硫鍵形成A亞基聚集體,而B亞基則和7S中的-亞基通過二硫鍵形成新的聚集體[32]。總巰基的數量與巰基氧化形成二硫鍵的數量變化呈反比,80~95 ℃范圍內,總巰基數量則呈下降趨勢說明加熱促進了二硫鍵的形成,它們可能參與了不溶性聚集體的形成,因為從電泳圖譜分析可知,二硫鍵參與形成可溶性聚集體的數量很少。
2.5 不同溫度處理對紅蕓豆蛋白二級結構的影響
利用Far-UV CD可以測定不同溫度下蛋白質二級結構的變化。由圖5可知50 ℃時,紅蕓豆蛋白Far-UV CD圖譜在接近192 nm處有一正峰,在207 nm附近處有一個負峰,在210~230 nm有較寬的肩峰,呈現典型的有序二級結構峰型。隨溫度增加,原207 nm處的負峰移向更低的波長并伴隨強度增大,證明蛋白二級結構無序化程度增大[33]。由表1可知,隨溫度變化,紅蕓豆蛋白的二級結構也有一定程度變化。隨溫度升高,-螺旋結構占比呈下降趨勢,而不規則結構占比呈上升趨勢,-折疊和-轉角變化幅度不大。
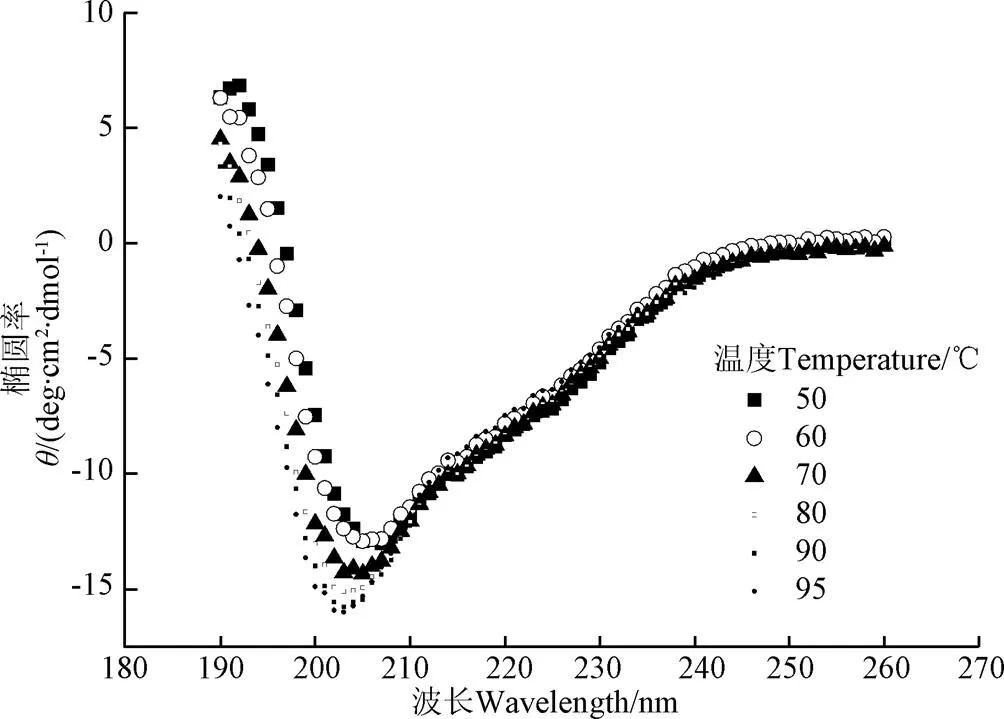
圖5 不同溫度條件下KPI的Far-UV CD 圖譜
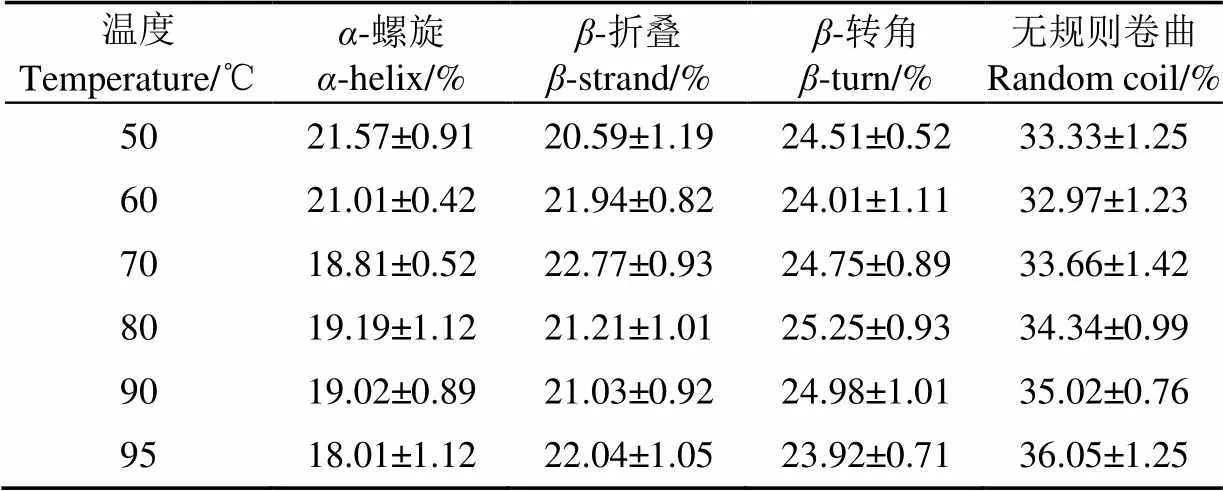
表1 不同溫度條件下KPI二級結構占比Table 1 Proportion of secondary structure of KPI with different temperature treatment
Shevkani等[34]通過近紅外光譜測定蕓豆蛋白二級結構的平均含量為:-螺旋(22.8%),-折疊(38.6%),-轉角(20.1%),A1(9.7%)和A2(2.9%)。Zirwer等[35]研究發現:牛血清蛋白加熱過程中,-螺旋結構會轉變為-折疊結構。天然狀態下的大豆蛋白會有少量無規則結構,而在加熱后大豆蛋白的無規則結構會有所增加。加熱過程中蛋白的變性總體上都會降低有序結構數量,而增加無序結構數量。
2.6 不同溫度處理紅蕓豆蛋白內源熒光圖譜
蛋白質的內源熒光光譜是通過測定色氨酸殘基所處環境的極性得到的,可以反映蛋白質空間構象的變化以及蛋白質之間的相互作用[36]。當蛋白質色氨酸殘基所處的溶劑環境極性提高,即色氨酸殘基從球蛋白內部疏水性區域轉移到表面暴露在溶劑環境中時,其最大發射波長會增大即發生紅移。蕓豆蛋白是典型的色氨酸熒光光譜。熒光峰在332 nm處,表明色氨酸殘基位于蕓豆分離蛋白的疏水區域[37]。
由圖6和表2可知,在50~70 ℃隨溫度上升,紅蕓豆蛋白最大發射波長發生紅移,說明蛋白分子結構逐步展開,內部色氨酸暴露;80 ℃時,紅蕓豆蛋白最大發射波長藍移,說明蛋白部分聚集,原來暴露的色氨酸被重新包埋,但對應溶解度數據,此時形成的聚集體應為可溶;溫度繼續上升,90 ℃時,紅蕓豆蛋白二硫鍵斷裂造成蛋白結構新的解離,色氨酸暴露程度增加,紅蕓豆蛋白最大發射波長發生紅移。
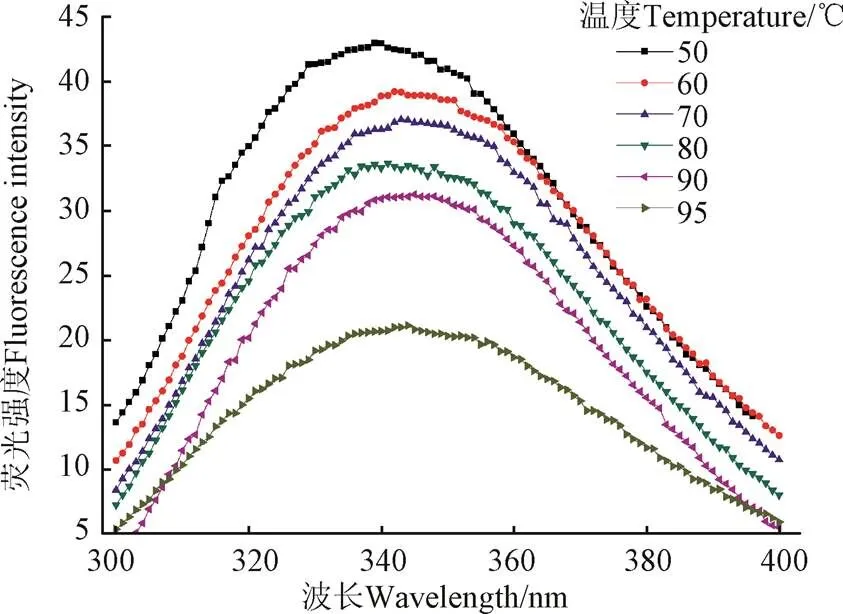
圖6 不同溫度條件下KPI的內源熒光發射光譜
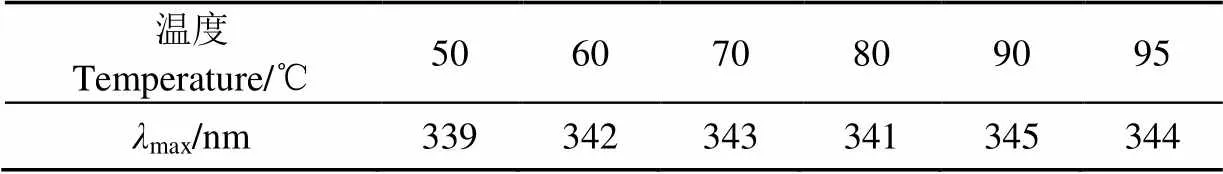
表2 不同溫度條件下KPI的內源熒光最大發射波長(λmax)Table 2 Maximum emission wavelength (λmax) of KPI with different temperature treatment
3 結 論
1)加熱處理對紅蕓豆蛋白溶解度和濁度有較大影響,50~70 ℃范圍內,蛋白溶解度呈上升趨勢,70 ℃時蛋白溶解度達到最高值82.68%,溫度進一步升高將導致蛋白溶解度下降,95 ℃時溶解度下降至65.63%;升溫過程中,蛋白濁度呈持續增加趨勢;熱處理導致蛋白二硫鍵的增加和聚集體的形成,因此蛋白總巰基數量則呈下降趨勢。
2)加熱處理對紅蕓豆蛋白亞基組成有較大影響,90 ℃時紅蕓豆可溶蛋白電泳圖譜中出現分子量約為135 kDa的新條帶;95 ℃時,可溶蛋白電泳圖譜中90 kDa的條帶消失。
3)加熱處理造成紅蕓豆蛋白二級結構不規則程度增加,-螺旋結構占比呈下降趨勢,不規則結構占比呈上升趨勢,同時,加熱也造成了紅蕓豆蛋白內部疏水結構的暴露,內源熒光的最大發射波長紅移。
試驗結果將對今后紅蕓豆加工過程中蛋白結構調控和提高蛋白產品熱穩定性提供理論指導。
[1] Thompson H J. Dietary Bean Consumption and Human Health[J]. Nutrients, 2019, 11(12): 3074.
[2] He Q, Sun X, He S et al. PEGylation of black kidney bean (Phaseolus vulgaris L.) protein isolate with potential functironal properties[J]. Colloids and Surfaces B: Biointerfaces, 2018, 164: 89-97.
[3] Montoya C A, Gomez A S, Lallès J P, et al. In vitro and in vivo protein hydrolysis of beans (Phaseolus vulgaris) genetically modified to express different phaseolin types[J]. Food chemistry, 2008, 106(3): 1225-1233.
[4] Montoya A, Lalles J, Beebe S, et al. Influence of the Phaseolus vulgaris phaseolin level of incorporation, type and thermal treatment on gut characteristics in rats[J]. British journal of Nutrition, 2006, 95(1): 116-123.
[5] Bessada S, Barreira J, Oliveira M. Pulses and food security: Dietary protein, digestibility, bioactive and functional properties[J]. Trends in Food Science & Technology, 2019, 93: 53-68.
[6] Pusztai A, Ewen S, Grant G, et al. Relationship between survival and binding of plant lectins during small intestinal passage and their effectiveness as growth factors[J]. Digestion, 1990, 46(Suppl.2): 308-316.
[7] Radberg K, Biernat M, Linderoth A, et al. Enteral exposure to crude red kidney bean lectin induces maturation of the gut in suckling pigs[J]. Journal of Animal Science, 2001, 79(10): 2669-2678.
[8] Rovalino-Córdova M, Fogliano V, Capuano E, et al. The effect of cell wall encapsulation on macronutrients digestion: A case study in kidney beans[J]. Food Chemistry, 2019, 286: 557-566.
[9] Halabi A, Deglaire A, Hamon P, et al. Kinetics of heat-induced denaturation of proteins in model infant milk formulas as a function of whey protein composition[J]. Food Chemistry, 2020, 302, 125296.
[10] Fukuda T, Maruyama N, Kanazawa A, et al. Molecular analysis and physicochemical properties of electrophoretic variants of wild soybean Glycine soja storage proteins[J]. Journal of Agricultural and Food Chemistry, 2005, 53(9): 3658-3665.
[11] Chi E, Krishnan S, Randolph T, et al. Physical stability of proteins in aqueous solution: mechanism and driving forces in nonnative protein aggregation[J]. Pharmaceutical Research, 2003, 20(9): 1325-1336.
[12] 李向紅,劉展,李偉,等. 干燥方法對大豆分離蛋白熱誘導聚集體的影響[J]. 農業工程學報,2008,24(10):258-261.
Li Xianghong, Liu Zhan, Li Wei, et al. Effect of drying method on heat-induced aggregate of soy protein isolate[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2008, 24(10): 258-261. (in Chinese with English abstract)
[13] 陶汝青,夏寧,滕建文,等. 大豆蛋白熱變性程度對速溶豆腐花粉凝膠成型的影響[J]. 農業工程學報,2017,33(11):299-305.
Tao Ruqing, Xia Ning, Teng Jianwen, et al. Effect of heat denaturation degree of soybean protein on gel property of instant soybean curd[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(11): 299-305. (in Chinese with English abstract)
[14] 王喜波,張安琪,王玉瑩,等. 巴氏殺菌和超巴氏殺菌對牛乳清蛋白結構及熱穩定性的影響[J]. 農業工程學報,2019,35(6):315-321.
Wang Xibo, Zhang Anqi, Wang Yuying, et al. Effect of pasteurization and ultra-pasteurization on structure and thermal stability of fresh milk whey protein[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(6): 315-321. (in Chinese with English abstract)
[15] Fumio, Yamauchi, Tatsunori, et al. Molecular understanding of heat‐induced phenomena of soybean protein[J]. Food Reviews International, 1991, 7(3):283-322.
[16] Gharibzahedi S M T, Hernández O C, Welti C, et al. High pressure processing of food-grade emulsion systems: Antimicrobial activity, and effect on the physicochemical properties[J]. Food Hydrocolloids, 2019, 87: 307-320.
[17] Shen Y, Tang X, Li Y, et al. Drying methods affect physicochemical and functional properties of quinoa protein isolate[J]. Food Chemistry, 2020, 339: 127823.
[18] Andrea R, Mauricio O N, Yamira C B, et al. Heat-induced changes in microstructure of spray-dried plant protein isolates and its implications on in vitro gastric digestion[J]. LWT-Food Science and Technology, 2020, 118: 108795.
[19] Byanju B, Rahman M, Hojilla-Evangelista M P, et al. Effect of high-power sonication pretreatment on extraction and some physicochemical properties of proteins from chickpea, kidney bean, and soybean[J]. International Journal of Biological Macromolecules, 2020, 145(15): 712-721.
[20] Chen Zhenjia, Shi Xiaodi, Xu Jingting, et al. Gel properties of SPI modified by enzymatic cross-linking during frozen storage[J]. Food Hydrocolloids, 2016, 56(5): 445-452.
[21] Ren C, Tang L, Zhang M, et al. Interactions between whey soybean protein (WSP) and beta-conglycinin (7S) during the formation of protein particles at elevated temperatures[J]. Food Hydrocolloids, 2009, 23(3): 936-941.
[22] Ruan Q, Chen Y, Kong X, et al. Comparative studies on sulfhydryl determination of soy protein using two aromatic disulfide reagents and two fluorescent reagents[J]. Journal of Agricultural and Food Chemistry, 2013, 61(11): 2661-2668.
[23] Arzeni C, Martinez K, Zema P, et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J]. Journal of Food Engineering, 2012, 108(3): 463-472.
[24] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature. 1970, 227: 680-685.
[25] Wan Y, Liu J, Guo S. Effects of succinylation on the structure and thermal aggregation of soy protein isolate[J]. Food chemistry, 2018, 245: 542-550.
[26] Shen L, Tang C H. Microfluidization as a potential technique to modify surface properties of soy protein isolate[J]. Food Research International, 2012, 48(1): 108-118.
[27] Rahmati N, Koocheki A, Varidi M, et al. Introducing Speckled sugar bean (Phaseolus vulgaris) protein isolates as a new source of emulsifying agent[J]. Food Hydrocolloids, 2018, 79: 498-508.
[28] Wani I, Sogi D, Shivhare U, et al. Physico-chemical and functional properties of native and hydrolyzed kidney bean (Phaseolus vulgaris L.) protein isolates[J]. Food Research International, 2014, 76(8): 11-18.
[29] Rui X, Boye J, Ribereau S, et al. Comparative study of the composition and thermal properties of protein isolates prepared from nine Phaseolus vulgaris legume varieties[J]. Food Research International, 2011, 44(8): 2497-2504.
[30] Alting A C, Weijers M, De Hoog E H A , et al. Acid-induced cold gelation of globular proteins: effects of protein aggregate characteristics and disulfide bonding on rheological properties[J]. Journal Agricultural and Food Chemistry, 2004, 52(3): 623-631.
[31] Nishinari K, Fang Y, Guo S, et al. Gums and stabilisers for the food industry 17: Properties and applications of soy proteins[M]. London: Royal Society of Chemistry, 2014: 28-45.
[32] Wu C, Wang J, Yan X, et al. Effect of partial replacement of water-soluble cod proteins by soy proteins on the heat-induced aggregation and gelation properties of mixed protein systems[J]. Food Hydrocolloids, 2019, 100: 105417.
[33] Wan Y, Liu J, Guo S. Effects of succinylation on the structure and thermal aggregation of soy protein isolate[J]. Food Chemistry, 2018, 245: 542-550.
[34] Shevkani K, Singh N, Kaur A, et al. Structural and functional characterization of kidney bean and field pea protein isolates: A comparative study[J]. Food Hydrocolloids, 2015, 43: 679-689.
[35] Zirwer D, Gast K, Welfle H, et al. Secondary structure of globulins from plant seeds: A re-evaluation from circular dichroism measurements[J]. International Journal of Biological Macromolecules, 1985, 7: 105-108
[36] Pallarès I, Vendrell J, Avilés F X, et al. Amyloid fibril formation by a partially structured intermediate state of α-chymotrypsin[J]. Journal of Molecular Biology, 2004, 342(1): 321-331.
[37] He S, Zhao J, Cao X, et al. Low pH-shifting treatment would improve functional properties of black turtle bean (Phaseolus vulgaris L.) protein isolate with immunoreactivity reduction[J]. Food Chemistry, 2020, 330: 127217.
Effects of different temperature treatments on thermal stability and structure of red kidney bean protein
Chen Zhenjia1, Wang Xiaowen1※, Jing Xu1, Liang Yaping2
(1.,030801,; 2.,,030801,)
Heat is the most common physical agent that denatures proteins. Heat-induced denaturation unfolds protein structure, exposes surface hydrophobic groups and dissociates proteins into their constituent subunits. Denaturation decreases protein solubility, resulting in aggregation of the unfold molecules due to changes in functional properties, such as water absorption, gelation, foaming, and emulsification. An in-depth study was carried out to investigate the physicochemical properties and aggregation characteristics of red kidney bean protein isolate (KPI) during heating and to determine the influence of different temperatures on the thermal aggregation behavior of KPI. The protein solubility, turbidity, content of total and free sulfhydryl groups, subunit composition, and protein secondary structure of native KPI aqueous dispersions (2% g/mL) thermally treated at different temperatures (50, 60, 70, 80, 90 and 95 ℃)were analyzed by different detection methods and techniques. High temperature caused the dissociation and association of protein subunits leading to the formation of soluble and insoluble aggregates, which reduced the solubility of the protein to some extent and increased the turbidity of the protein solution. Results of protein concentration showed that the solubility of red kidney bean protein increased initially and then decreased with the increase of temperature. The solubility of KPI increased by more than 82% at 70 ℃, but decreased to 65.63% at 95 ℃ (near denaturation temperature 93.4 ℃). The turbidity of the protein solution of red kidney bean increased with temperature. Results of SDS-PAGE gel electrophoresis revealed that proteins of red kidney bean tended to form macromolecule aggregates at high temperature. The protein profiles obtained from SDS-PAGE analysis performed in the absence and presence of-mercaptoethanol were not significantly different when thermal treatment was carried out at a temperature below 90 ℃. A new band with a molecular weight of approximately 135 kDa appeared in the electrophoretic pattern at 90 ℃. The subunit bands with a molecular weight of approximately 90 kDa disappeared in the electrophoretic pattern at 95 ℃, indicating that the protein subunits underwent dissociation and aggregation to a certain extent during heating. A gradual decrease in the content of total sulfhydryl groups was observed and the amount of free sulfhydryl groups initially increased and then decreased as the temperature increased. These results suggested that thermal treatment enhanced protein aggregation and oxidation of SH group. Results of circular dichroism spectroscopy revealed that heat treatment affected the secondary structure of KPI, whereas the content of-helix in KPI decreased with the rising heating temperature, and the content of random coil increased, but there was no apparent change in the content of-strand and-turn. Fluorescence analysis showed that red-shift of KPI solution occurred when the temperature was over 80 ℃, indicating that thermal treatments greatly changed the secondary and tertiary structure of KPI. This implies that high temperature destroys the tertiary structure of KPI and increases the polarity of protein microenvironment. The results can provide the important theoretical basis for controlling the thermal behavior and aggregation properties of red kidney bean products.
heat treatment; thermal stability; solubility; red kidney bean protein; disulfide bonds; secondary structure; intrinsic fluorescence emission spectra
陳振家,王曉聞,荊旭,等. 不同溫度處理對紅蕓豆蛋白熱穩定性及結構的影響[J]. 農業工程學報,2020,36(19):306-312.doi:10.11975/j.issn.1002-6819.2020.19.035 http://www.tcsae.org
Chen Zhenjia, Wang Xiaowen, Jing Xu, et al. Effects of different temperature treatments on thermal stability and structure of red kidney bean protein[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(19): 306-312. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.19.035 http://www.tcsae.org
2020-05-27
2020-09-10
山西省重點研發計劃項目(201903D11006);山西農業大學博士科研啟動項目(2016ZZ06)
陳振家,博士,副教授,主要從事植物蛋白研究。Email:13453216350@163.com
王曉聞,博士,教授,主要從事雜糧加工研究。Email:wwxw11@163.com
10.11975/j.issn.1002-6819.2020.19.035
TS201.7
A
1002-6819(2020)-19-0306-07

