煙酰胺單核苷酸對低血糖后葡萄糖再灌注大鼠學習記憶的影響
王曉楠 徐茜 張勵 楊旸 胡雪君
(中國醫科大學附屬第一醫院老年醫學科,遼寧 沈陽 110001)
低血糖是糖尿病患者胰島素治療的潛在并發癥。重度低血糖可導致明顯的神經元死亡和認知障礙〔1〕。目前臨床對于重度低血糖的治療是立即靜脈輸注葡萄糖以迅速升高血糖水平。但有研究發現,低血糖所致腦損害不但與低血糖本身有關,還與低血糖后葡萄糖再灌注相關,而且低血糖后葡萄糖再灌注治療會誘導活性氧(ROS)產生增加,ROS的產生導致多聚二磷酸腺苷核糖聚合酶(PARP)-1活化,煙酰胺腺嘌呤二核苷酸/三磷酸腺苷(NAD/ATP)耗盡,導致神經細胞死亡,進一步加重低血糖性腦損害〔2,3〕。煙酰胺單核苷酸(NMN)是一種NAD+的前體物質。NMN不僅可以增加細胞內NAD+水平,還可以降低腦組織內ROS的產生〔4〕。本研究觀測NMN對低血糖后葡萄糖再灌注大鼠模型認知功能的影響,并探討其可能的保護機制。
1 材料與方法
1.1實驗動物與材料 SPF級雄性SD大鼠,體重250~350 g,由中國醫科大學實驗動物中心提供。NMN購自美國Sigma公司;生物合成人胰島素(諾和靈R)購自丹麥諾和諾德公司;血糖儀(拜安康)購自德國拜耳公司;2′,7′-二氯二氫熒光素二乙酸酯(H2DCF-DA)試劑盒購自美國Invitrogen公司。
1.2實驗方法
1.2.1動物分組及用藥方法 實驗大鼠以3.6%水合氯醛腹腔注射(1 ml/100 g體重)麻醉后,行頸部靜脈插管術,術后觀察24 h,正常飼水食。經過3 d的術后恢復,將30只反應正常的大鼠,隨機分為假手術組(Sham)、低血糖后葡萄糖再灌注組(GR)、和低血糖后葡萄糖再灌注并給予NMN治療(GR+NMN)組,每組10只。Sham組:經頸靜脈泵入胰島素(1.5 U/h)的同時泵入25%葡萄糖,使血糖水平維持在5~8 mmol/L,維持5 h。GR組:經頸靜脈泵入胰島素(1 U/h)誘導低血糖,當血糖低于1 mmol/L時,將血糖水平維持在1 mmol/L左右1 h;隨后給予25%葡萄糖(2.0 ml/h)使血糖水平快速升至5~8 mmol/L,維持3 h。GR+NMN組:經頸靜脈泵入胰島素(1 U/h)誘導低血糖,當血糖低于1 mmol/L時,將血糖水平維持在1 mmol/L左右1 h;隨后給予腹膜注射NMN 500 mg/kg,同時再給予25%葡萄糖(2.0 ml/h)使血糖水平快速升至5~8 mmol/L,維持3 h。造模后1 d大鼠完全清醒后,GR+NMN組給予干預治療,每天腹膜注射NMN 500 mg/kg,Sham組及GR組腹膜注射等滲NaCl注射液(104.5 mg/kg),連續注射1 w。
1.2.2各組大鼠學習記憶能力的檢測 實驗藥物干預1 w后,參照參考文獻對各組實驗大鼠進行Morris水迷宮實驗檢測學習記憶能力〔5〕。其中定位航行實驗歷時5 d,每天4次,每次間隔20 min,主要記錄實際逃避潛伏期。第5天進行空間探索實驗,記錄原平臺象限活動時間及120 s內穿越原平臺的次數。每次均3組平行進行。
1.2.3組織標本采集 各組實驗大鼠在最后一次進行Morris水迷宮實驗后取材。大鼠用3.6%水合氯醛腹腔注射(1 ml/100 g體重)麻醉后,斷頭處死,迅速取出完整海馬組織,置于液氮中速凍,后移至-80℃冰箱凍存以備檢測。
1.2.4海馬組織內NAD+水平的測定 將凍存的海馬組織置于室溫下解凍,用75%乙醇-0.05 mol/L K2HPO4溶液將海馬組織搗碎溶解,使NAD+在乙醇脫氫酶的作用下轉換成還原型煙酰胺腺嘌呤二核苷酸(NADH),13 000 r/min 14℃離心15 min,取上清液,在400~600 nm的分光光度計下測定的NADH熒光值〔5〕。
1.2.5海馬組織內ROS聚集水平的測定 H2DCF-DA來檢測海馬組織內ROS聚集情況。將凍存的海馬組織置于室溫下解凍,將解凍后海馬組織放置于切片機的載物臺上,以400 μm厚度進行切片,并將其置于1個微孔的膜插件內,再將膜插件置于盛有H2DCF-DA(10 μmol/L)的海馬組織培養液的培養皿中,37℃、5% CO2培養(培養液組成:50%MEM,25%Hank平衡鹽溶液,25%無活性馬血清,1%谷氨酸,6.5 mg/L D-葡萄糖,1%青霉素-鏈霉素)30 min后,用PBS沖洗兩次,用5 mmol/L Tris HCl將海馬組織切片搗碎溶解,13 000 r/min 14℃離心15 min,取上清液,在485~535 nm的分光光度計下測定DCF的熒光值〔5〕。
1.3統計學方法 采用SPSS17.0軟件進行方差分析,Scheffe法。
2 結 果
2.1各組學習記憶能力比較 與Sham組比較,GR組逃避潛伏期顯著延長,原平臺象限活動時間顯著降低,穿越平臺次數顯著減少(均P<0.05)。與GR組比較,GR+NMN組逃避潛伏期均顯著縮短,原平臺象限活動時間顯著延長,穿越平臺次數顯著增多(均P<0.05)。見表1,表2。

表1 各組定位航行實驗中每日平均逃避潛伏期
2.2海馬組織內NAD+水平比較 與Sham組比較,GR組大鼠海馬組織內NAD+水平顯著降低(P<0.05),而GR+NMN組NAD+水平未見明顯變化(P>0.05)。與GR組比較,GR+NMN組大鼠海馬組織內NAD+水平顯著升高(P<0.05)。見表3。
2.3海馬組織內ROS的聚集情況比較 與Sham組比較,GR組大鼠海馬組織內ROS的水平顯著升高(P<0.05),而GR+NMN組大鼠海馬組織內ROS的水平未見明顯變化(P>0.05)。與GR組比較,GR+NMN組大鼠海馬組織內ROS的水平顯著降低(P<0.05)。見表3。
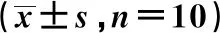
表2 各組空間探索試驗結果
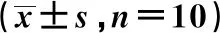
表3 各組大鼠海馬組織內NAD+及ROS水平
3 討 論
嚴重的低血糖會引起海馬組織損傷,導致神經元死亡和認知障礙〔1,6〕。低血糖引起的神經元死亡并不是能量衰竭的直接結果,而是由多種因素共同作用的結果,其中氧化應激和多聚磷酸腺苷二核糖聚合酶(PARP)-1活化具有關鍵性的作用〔7,8〕。在臨床中,一旦發生嚴重的低血糖,首選的關鍵治療方法是立即補充葡萄糖快速提高血糖水平,這對于避免腦損傷是至關重要的。但研究發現,低血糖后葡萄糖再灌注可致繼發性損傷,從而導致更嚴重的神經元死亡〔3〕。葡萄糖再灌注損傷與ROS的集聚〔3〕、炎癥相關的小膠質細胞激活〔9〕及鋅離子的釋放〔10〕相關。雖然低血糖和葡萄糖再灌注都會導致ROS的產生,但ROS的產生主要發生在葡萄糖再灌注期間,而不是低血糖本身〔3〕。ROS的產生可誘導DNA損傷及PARP-1活化,而PARP-1活化會使NAD/ATP耗盡,最終導致神經元死亡。
NAD+是維持細胞功能和能量代謝所必需的物質。越來越多的研究證明NAD+可能在大腦的代謝過程中發揮重要作用,并對神經傳遞、學習和記憶等大腦的功能產生影響〔11,12〕。NMN是一種NAD+的前體物質。雖然目前尚不清楚NMN是否能通過血腦屏障,但NMN腹腔內給藥可以迅速(15 min內)增加腦內海馬組織和下丘腦內的NAD+水平〔13,14〕,這說明NMN可以通過血腦屏障,并誘導腦組織中NAD+的生物合成。另外NMN還可以通過直接抑制ROS的產生而發揮抗氧化應激的作用〔4〕。
本研究說明NMN有效地改善了低血糖后葡萄糖再灌注大鼠的學習記憶能力。綜上所述,NMN可能通過維持海馬組織內NAD+的水平及抗氧化應激的作用,來拮抗低血糖后葡萄糖再灌注誘導的腦損害,從而改善學習記憶能力。本研究為未來臨床防治低血糖后葡萄糖再灌注所致的認知障礙可能提供一定的實驗依據。

