基于MIRA技術的霍亂弧菌膠體金試紙條快速檢測方法的建立
李盛杰 江海濤 吳雨龍








摘要:為了建立一種快速、靈敏、便捷的針對霍亂弧菌的檢測方法,利用多酶恒溫核酸快速擴增技術,對不同引物組在膠體金試紙條檢測中的特異性和靈敏度進行研究。研究結果表明,在以質粒為模板的特異性試驗中,Probe1+引物對2、Probe1+引物對3、Probe2+引物對5這3組引物組均顯示出較高的特異性。但在靈敏度試驗中,僅有Probe2+引物對5能夠檢出濃度為0.1 fg/μL的質粒模板。在后續以核酸為模板的特異性和靈敏度試驗中,Probe2+引物對5的引物組合同樣顯示出較強的特異性,并對核酸模板的檢出限可達到10 fg/μL,均顯示出優于另外2種組合的特異性和靈敏度。本研究所建立的基于MIRA技術的霍亂弧菌檢測方法具有較高的特異性和靈敏度,對于推進霍亂弧菌及其他致病菌的現場快速檢測具有重要意義。
關鍵詞:霍亂弧菌;多酶恒溫核酸快速擴增技術;膠體金試紙
中圖分類號:S182 文獻標志碼: A
文章編號:1002-1302(2021)24-0167-05
收稿日期:2021-09-27
基金項目:國家重點研發計劃(編號:2019YFC1605800);江蘇省高校自然科學研究重大項目(編號:20KJA416003);江蘇省高校重點建設實驗室項目(編號:蘇教科[2016]8)。
作者簡介:李盛杰(1988—),男,江蘇徐州人,博士,講師,從事特殊生物質資源利用研究。E-mail:lishengjie@njxzc.edu.cn。
通信作者:吳雨龍,博士,高級實驗師,從事動物生理生化相關研究。E-mail:wuyl_8080@163.com。
霍亂弧菌(Vibrio cholera)是一種革蘭氏陰性菌,是霍亂的病原體。霍亂可作為散發性、流行性或地方病發生,以引起嚴重腹瀉和脫水而聞名,如果不及時治療,可在48 h內導致死亡[1]。研究表明,霍亂弧菌可以通過人類宿主形成高度傳染性狀態,經排泄到自然環境中,引發霍亂的流行[2]。霍亂弧菌廣泛存在水生動物中或受污染的食物中,特別是貝類和甲殼類動物[3]。因此,建立霍亂弧菌快速、高效的檢測手段,對于保障食品質量安全,維護人民生命健康,加強公共衛生防疫方面具有極其重要的意義。由于霍亂弧菌可以以2種形式存在:活的可培養的和活的但不可培養的(VBNC),使用傳統培養法進行檢測具有一定的局限性[4]。目前,針對霍亂弧菌檢測的方法雖然很多,包括免疫檢測法、生化鑒定法、實時熒光聚合酶鏈式反應、環介導恒溫擴增(LAMP)等方法,但這些方法均無法同時解決操作煩瑣耗時長、檢測效率與檢測靈敏度低、檢測目標單一、快速現場檢測等問題[5-10]。
MIRA(Multi-enzyme Isothermal Rapid Amplification,簡稱MIRA)是一種近年來發展起來的多酶恒溫核酸快速擴增技術。作為一種新型的等溫核酸擴增技術,MIRA不需要復雜的熱循環儀,而是通過簡單的水浴或加熱工具即可在37~42 ℃的恒定溫度條件下進行反應。整個反應過程主要依賴于3種必需的酶:重組酶,促進特異性引物與模板DNA 配對;單鏈 DNA 結合蛋白,無需加熱即可形成單鏈DNA;DNA 聚合酶,負責擴增和延伸[11]。一旦反應開始,模板DNA的擴增就會迅速進行,并且在不到 20 min的時間內達到可檢測的水平。通過設計帶有修飾基團的引物與探針,配合膠體金試紙條,可以極大地實現便攜式的現場快速核酸檢測技術。
霍亂毒素(CT)、毒素共調節菌毛(TCP)和外膜蛋白W(OmpW)是霍亂弧菌的3個主要毒力因子[12]。外膜蛋白W的ompW基因也是霍亂弧菌菌株鑒定中常用的特異性檢測基因。本研究主要針對該基因設計多個引物和探針組,并在多酶恒溫核酸快速擴增體系中通過膠體金試紙條對霍亂弧菌的特異性和靈敏度檢測進行評價。
1 材料與方法
1.1 材料與試劑
霍亂弧菌ompW基因質粒(參考GenBank:MF100045.1序列信息構建);Tiosbio超快速核酸釋放劑、DNA恒溫快速擴增試劑盒、HybriDetect試紙條均購自濰坊安普未來生物科技有限公司;霍亂弧菌、小腸耶爾森氏菌的核酸提取物購自濰坊安普未來生物科技有限公司;副溶血性弧菌、擬態弧菌、河弧菌分離株、創傷弧菌、鮑氏志賀菌、鼠傷寒沙門氏菌、大腸桿菌、金黃色葡萄球菌、坂崎克羅諾菌均來自筆者所在實驗室保藏。
1.2 儀器
PCR擴增儀,T100TM,Bio-rad生命醫學產品有限公司生產。
1.3 試驗方法
1.3.1 引物設計 試驗于2021年3—6月在南京曉莊學院實驗室內進行。根據MIRA技術引物設計原則,建議擴增片段長度在150~500 bp之間,下游引物的5′端需要標記1個修飾基團(如生物素,biotin)。結合霍亂弧菌ompW基因(GenBank:MF100045.1)序列信息,采用PrimerPremier 5.0軟件進行引物設計,委托廣州擎科生物技術有限公司進行合成,具體序列見表1。
1.3.2 探針設計 根據MIRA技術探針設計原則(圖1),探針為位于上下游引物中間,長度在46~52 nt之間,并與目的片段互補的序列;同時在5′端修飾1個抗原標記(如羥基熒光素,FAM);在距5′端約30 nt序列位置上標記1個dSpacer(四氫呋喃,THF),作為大腸桿菌核酸外切酶(NFO)的識別位點;THF距離3′末端約15 nt,并且在3′末端標記1個修飾基團(如胺基、磷酸基團、C3-spacer)。結合7對引物信息,設計得到符合引物對1、2、3、4的探針Probe1([6FAM]AACATTTGCCACCTACCTTTATGGTCCAAT[THF]CTACTTTGGTGAAGC[C3spacer])和符合引物對4、5、6的探針Probe2([6FAM]AGTAGCGATAAAGTGTTAAACACTCAAAGT[THF]AGTTGGCAGTTAATA[C3spacer])。
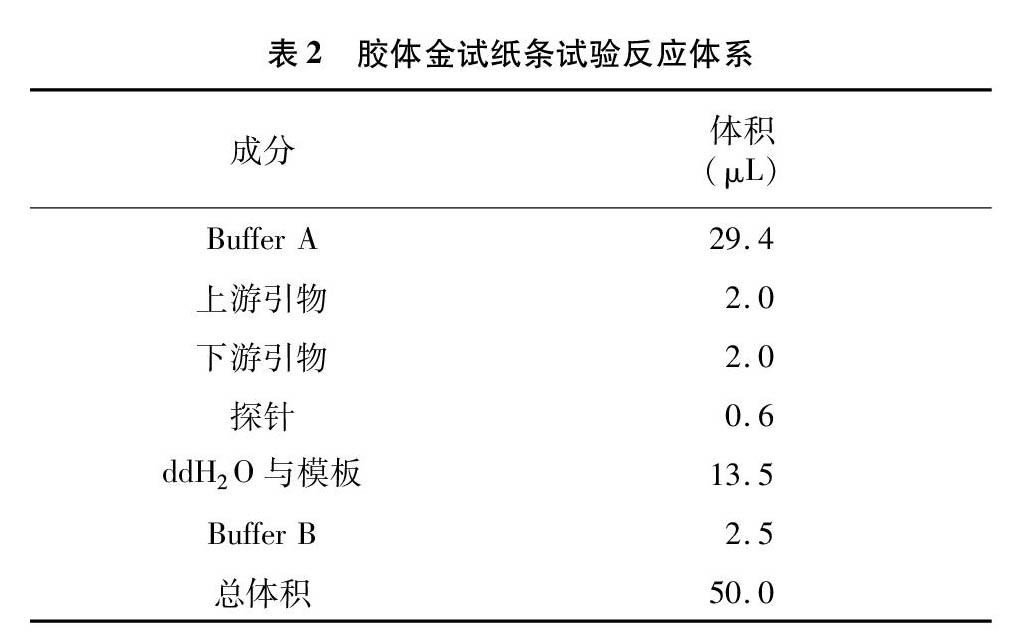
1.3.3 膠體金試紙條試驗反應體系 膠體金試紙條試驗反應體系見表2。
1.3.4 膠體金試紙條試驗操作步驟 在每個反應管中加入適量的Buffer A、上下游引物、探針(探針引物濃度均為10 μmol/L)、ddH2O、核酸模板、BufferB,并充分混合,短暫離心后立即將反應管放入恒溫設備中37 ℃孵育8~12 min;反應結束后,取10 μL反應液加入含有190 μL ddH2O的離心管中,混合均勻后將膠體金試紙條的樣品端插入離心管中3~5 min,觀察質控線與檢測線判讀結果。
2 結果與分析
2.1 質粒模板試紙條特異性
選擇7組引物和對應的探針,將霍亂弧菌ompW基因質粒作為模板,進行膠體金試紙條特異性反應的初篩。膠體金試紙條初篩結果顯示,每組檢測線均出現了條帶,說明不同的引物探針組均能檢出質粒濃度10 fg/μL以上的目標分子,其中2、3、5組條帶最為明顯(圖2)。因此,選擇這3對引物及對應探針進行后續膠體金試紙條的靈敏度試驗。
2.2 質粒模板試紙條靈敏度
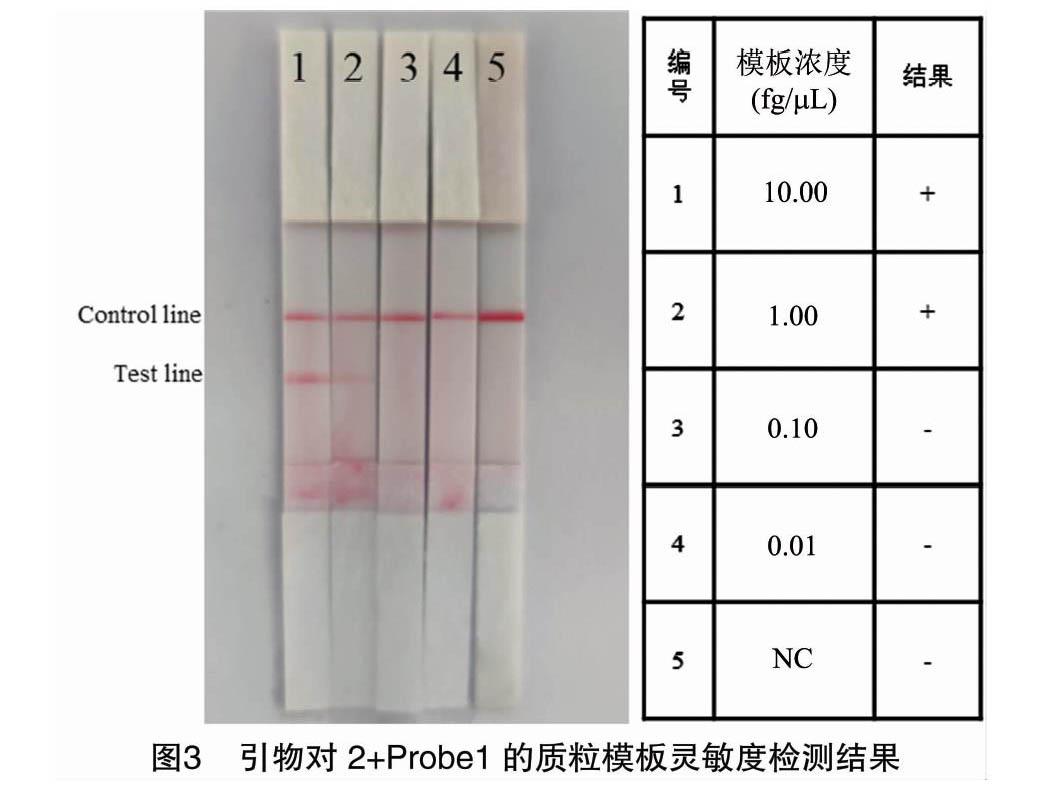
選擇引物對2和探針Probe1的組合,將質粒模板稀釋為10.00、1.00、0.10、0.01 fg/μL 4個梯度濃度進行膠體金試紙條的靈敏度檢測。檢測結果顯示,第2組檢測線有微弱條帶出現,表明該探針引物組合可以檢出濃度為1 fg/μL的質粒模板(圖3)。
選擇引物對3和探針Probe1的組合,將質粒模板稀釋為相同的4個梯度濃度進行膠體金試紙條的靈敏度檢測。檢測結果顯示,該探針引物組合在第2組檢測線同樣可以看到微弱條帶,也可檢出濃度為1 fg/μL的質粒模板(圖4)。
選擇引物對5和探針Probe2的組合,利用同樣稀釋后的質粒模板進行膠體金試紙條的靈敏度檢測。檢測結果顯示,該探針引物組合在第3組檢測線可以看到微弱條帶,表明其可以檢出濃度為 0.1 fg/μL 的質粒模板(圖5)。
2.3 核酸模板試紙條靈敏度
為進一步驗證該方法在真實檢測環境中的效率,選擇從霍亂弧菌中提取的核酸作為模板進行靈敏度檢測試驗。選擇引物對2和探針Probe1的組合,設置1 pg/μL、100 fg/μL、10 fg/μL 3個梯度核酸模板濃度進行膠體金試紙條的靈敏度檢測。檢測結果顯示,第1、2組檢測線有明顯條帶出現,表明該探針引物組合可以檢出濃度為100 fg/μL的核酸模板(圖6)。
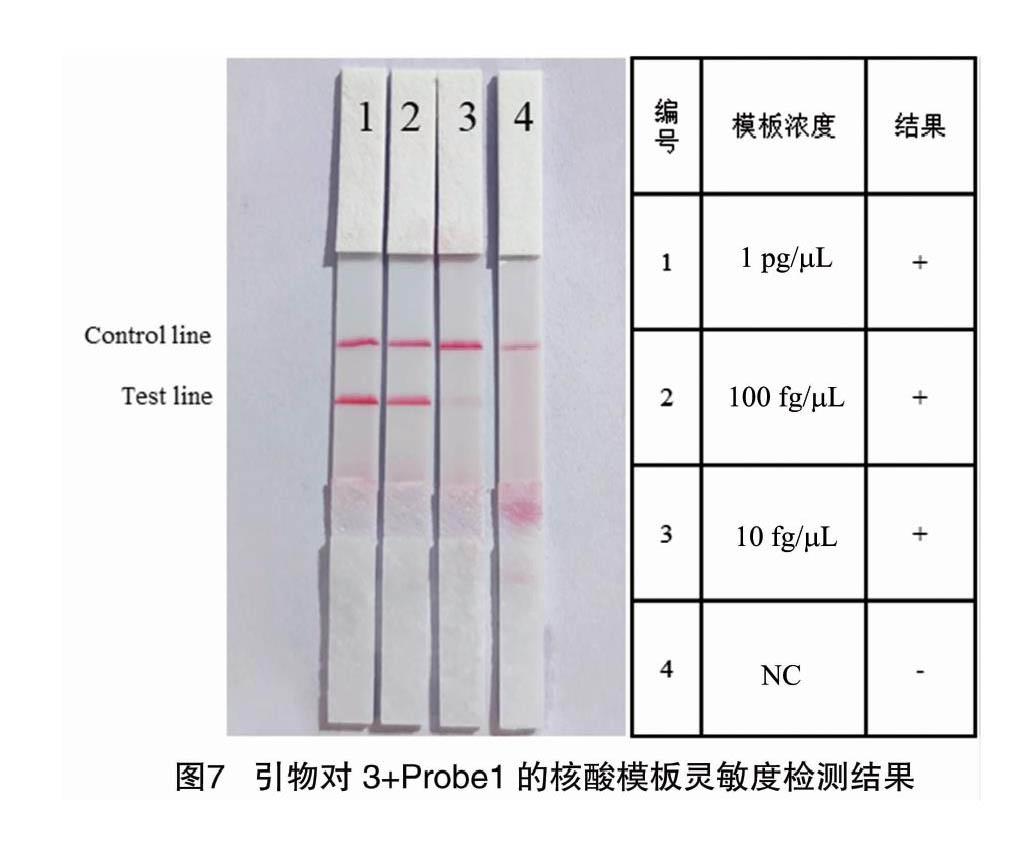
選擇引物對3和探針Probe1的組合,將核酸模板稀釋為相同的3個梯度濃度進行膠體金試紙條的靈敏度檢測。檢測結果顯示,該探針引物組合在第1組、第2組檢測線有明顯條帶出現,在第3組檢測線可以看到微弱條帶,表明可以檢出濃度為 10 fg/μL 的核酸模板(圖7)。
選擇引物對5和探針Probe2的組合,利用同樣稀釋后的核酸模板進行膠體金試紙條的靈敏度檢測。檢測結果顯示,該探針引物組合在第1組、第2組、第3組檢測線均可以看到明顯條帶,表明其可以檢出濃度為10 fg/μL的核酸模板(圖8)。
根據以上試驗結果,無論是在ompW基因質粒模板的靈敏度檢測試驗中還是在霍亂弧菌核酸模板的靈敏度檢測試驗中,引物對5+Probe2的組合均表現出最優的靈敏度檢測結果。因此,選擇該探針引物組合進行不同物種間的特異性檢測試驗。
2.4 不同致病菌核酸模板試紙條特異性試驗結果
在不同致病菌核酸模板的特異性檢測試驗中,本研究選擇了4種其他弧菌(副溶血性弧菌、擬態弧菌、河弧菌、創傷弧菌)和6種可致消化系統疾病的常見細菌(鮑氏志賀菌、鼠傷寒沙門氏菌、小腸耶爾森氏菌、大腸桿菌、金黃色葡萄球菌、坂崎克羅諾菌)進行檢測。結果表明,引物對5+Probe2的組合對于其他致病菌核酸模板的檢出結果均為陰性,只有對霍亂弧菌核酸的檢出結果為陽性,說明該探針引物組合可以特異性地檢出霍亂弧菌而不檢出其他微生物(圖9)。
3 討論與結論
通過對全部7對引物探針組進行初篩,顯示引物對2+Probe1、引物對3+Probe1和引物對5+Probe2的組合在試紙條檢測線均出現顯著明亮的條帶。在后續通過質粒模板和核酸模板進行靈敏度檢測的過程中,引物對5+Probe2的組合均表現出最優的靈敏度,檢出限分別可達到0.1 fg/μL和 10 fg/μL。在不同致病菌核酸模板的特異性檢測試驗中,引物對5+Probe2的組合同樣表現出良好的特異性,在所有11種檢測對象中,僅能檢測出霍亂弧菌而不檢出其他微生物。綜上判斷,我們認為引物對5+Probe2的探針引物組通過膠體金試紙條在多酶恒溫核酸快速擴增條件下,能夠特異性好和靈敏度高地完成霍亂弧菌的快速檢測。本試驗所建立的檢測方法,無需依賴細菌培養、生化鑒定、血清學分群等周期長、操作繁瑣的手段,比常規PCR和實時熒光PCR技術有更短的反應時間,比環介導恒溫擴增方法具有更低的反應溫度,適用于食品安全檢測、病原體臨床診斷等領域,應用前景廣闊,具有較高的實用價值。
本研究建立了一種基于MIRA技術的霍亂弧菌膠體金試紙條快速檢測方法,試驗結果表明,引物對5+Probe2的探針引物組具備準確可靠、特異性強、靈敏度高等優點。該探針引物組可以通過后期開發成便攜且操作簡單便利的一體化檢測試劑盒,用于實際生產和監測環節中對霍亂弧菌的現場快速檢測。
參考文獻:
[1]Qadri F,Khan A I,Faruque A S G,et al. Enterotoxigenic Escherichia coli and Vibrio cholerae diarrhea,Bangladesh,2004[J]. Emerging Infectious Diseases,2005,11(7):1104-1107.
[2]Peterson K M,Gellings P S.Multiple intraintestinal signals coordinate the regulation of Vibrio cholerae virulence determinants[J]. Pathogens and Disease,2018,76(1):126-147.
[3]Bhandari M,Jennison A V,Rathnayake I U,et al. Evolution,distribution and genetics of atypical Vibrio cholerae-A review[J]. Infection,Genetics and Evolution,2021,89:104726.
[4]Conner J G,Teschler J K,Jones C J,et al. Staying alive:Vibrio cholerae’s cycle of environmental survival,transmission,and dissemination[J]. Microbiology Spectrum,2016,4(2):1-32.
[5]韓 輝,畢玉國,祁 軍,等. 霍亂弧菌和擬態弧菌雙重熒光PCR檢測方法的建立[J]. 中國國境衛生檢疫雜志,2015,38(3):153-156.
[6]郭 容,董曉妹,別闖南,等. 五種重要致病性弧菌高通量液相芯片檢測方法的建立[J]. 中國獸醫科學,2021,51(7):805-813.
[7]周霞霞,邱晶磊,楊 廣,等. 傳統培養法與熒光PCR法檢測弧菌的方法評價[J]. 食品安全質量檢測學報,2021,12(4):1550-1556.
[8]萬 瑩,陳永軍,任亞玲,等. 霍亂弧菌三重熒光定量PCR檢測方法的建立與應用[J]. 中國獸醫科學,2019,49(9):1143-1151.
[9]母潤紅,聶丹丹,李明成,等. 水產品中食源性病原菌多重PCR快速檢測方法的建立[J]. 北華大學學報(自然科學版),2020,21(6):756-760.
[10]魏 霜,馬新華,汪天杰,等. 雙重DPO-PCR檢測副溶血弧菌和霍亂弧菌[J]. 食品工業科技,2016,37(22):80-83.
[11]Tu F,Yang X T,Xu S K,et al. Development of a fluorescent probe-based real-time reverse transcription recombinase-aided amplification assay for the rapid detection of classical swine fever virus[J]. Transboundary and Emerging Diseases,2021,68(4):2017-2027.
[12]Taheri F,Nazarian S,Ahmadi T S,et al. Protective effects of egg yolk immunoglobulins (IgYs) developed against recombinant immunogens CtxB,OmpW and TcpA on infant mice infected with Vibrio cholerae[J]. International Immunopharmacology,2020,89:107054.

