大熊貓與亞洲黑熊的紅細胞膜蛋白質譜檢測
鄧林華 趙俸涌 李 勤 黃 山魏 明 張亞輝 王承東 李德生* 朱自嚴*
(1.中國大熊貓保護研究中心,大熊貓國家公園珍稀動物保護生物學國家林業和草原局重點實驗室,都江堰,611830;2.上海市血液中心,上海,200051)
血液作為機體氣體及物質轉運的重要結締組織,其生理生化的改變與生命體活動息息相關,紅細胞作為氣體運輸的唯一載體,直接決定著生命體的氣體代謝。熊科(Ursidae)動物分布較廣,部分種具有冬眠的生活特性,導致紅細胞(red blood cell,RBC)生理生化亦發生改變以適應生命體活動,如冬眠中的棕熊(Ursusarctos),紅細胞抗氧化物質積累以抵抗其低代謝情況下有害物質的積聚,從而保護紅細胞的生存[1]。
成熟的哺乳動物紅細胞無核,其僅可通過無氧酵解途徑供能,而糖酵解依賴的豐富酶系一般通過與骨架蛋白互作而定位于紅細胞膜內側[2-3],其氣體代謝功能行使所依賴的多種通道蛋白一般以多次穿膜的跨膜蛋白形式存在[4-5],故紅細胞氣體代謝功能主要是以膜蛋白為基礎,這一點在其他哺乳動物紅細胞膜研究中已被充分證實,同時在一些生活習性特化的哺乳動物中,膜蛋白數量也發生變化以適應生命活動需要,如駱駝科(Camelidae)動物紅細胞為橢球型,帶3蛋白大量表達以適應其血液滲透壓的變化[6]。
紅細胞膜蛋白研究早期以蛋白電泳為主,隨著蛋白質組學的技術發展,目前較為全面地對紅細胞膜蛋白開展的研究一般采用質譜技術。質譜技術按照對待測樣品添加電荷的不同而分為若干技術,但這些技術的共通之處是對蛋白質酶解后的多肽片段進行電荷標記,通過質量/電荷的數值(質荷比M/Z)對該多肽片段進行分離,分離后的帶電多肽片段通過電場磁場的篩選,最后通過檢測器檢測。由于蛋白質被酶解后形成的肽指紋圖譜是唯一的,故當檢出多肽片段通過打分超過閾值后,就可以認定該蛋白的存在。正由于以上原因導致質譜技術可同時處理較大量樣本信息,故對于未知蛋白樣品的分析十分有用[7-9]。本研究基于探索大熊貓(Ailuropodamelanoleuca)紅細胞膜蛋白組學,通過液相色譜串聯二級質譜(LC-MS/MS)技術,對大熊貓及亞洲黑熊(Ursusthibetanus)紅細胞進行了檢測。
1 材料與方法
1.1 材料
1.1.1 血液樣本來源及抗凝方法
本實驗使用的大熊貓及亞洲黑熊血液來自于中國大熊貓保護研究中心,血液樣本為4—10月采集(本實驗中涉及大熊貓樣本為成年健康雄性,采樣年齡10歲;亞洲黑熊為成年健康雄性,年齡8歲),血液采用EDTA·2K抗凝,采集血樣4℃運輸,12 h內進行實驗。人類及C57BL6小鼠紅細胞樣本為檢驗合格后的實驗廢樣。
1.1.2 主要試劑及儀器
主要試劑:1 moL/LTris-HCl母液(上海生工生物B548142),20×PBS母液(上海生工生物B548117),Hoechst33342染料(B-2261,Sigma)。
主要儀器:離心機(Beckman-optima),蛋白電泳儀(BIO-RAD),分選流式細胞儀(Aria sorp,BD)質譜儀TripleTOF5600系統結合納升噴霧Ⅲ離子源(AB SCIEX)。
1.2 方法
1.2.1 血液分離
大熊貓抗凝血樣經自然沉降后,使用移液器移去白膜層后,吸棄血漿,將剩余壓積紅細胞1∶50稀釋于1×PBS中。
1.2.2 紅細胞分選
將Hoechst33342染料配置成5 000 μg/mL母液,按照1 μL/1 mL比例加入上步制備紅懸液中,冰浴孵育30 min。流式分選儀提前30 min預熱,通過SSC與FSC參數,設門去除細胞碎片,血小板及黏連細胞;然后通過Hoechst33342染料熒光設門,去除有核細胞;最后將單個完整紅細胞分選至無菌15 mL離心管中。取500 μL分選后細胞懸液,離心后,去除400 μL上清,輕柔重懸細胞后,制片,置于顯微鏡下觀察。
1.2.3 細胞膜蛋白制備
將分選后的紅細胞3 500 rpm,離心5 min,小心移除上清,加入40倍體積的低滲液(0.01 mol/L Tris-HCl,pH 7.4),充分混勻,冰浴30 min,4℃,40 000 rpm,離心20 min,沉淀用低滲溶液洗3次。將大熊貓紅細胞血影中加入200 μL RIPA裂解液,震蕩混勻,冰上放置30 min,5 000 rpm,離心5 min,上清即為可溶性膜蛋白溶液。
1.2.4 膜蛋白質譜檢測
將蛋白樣品測定濃度后,進行SDS-PAGE電泳,并將凝膠進行切膠回收、蛋白質再溶解、蛋白質樣本純化、脫鹽及加基質后,進行LC-MS/MS檢測。色譜分離采用2 μL/min的流速上樣。質譜噴霧電壓為2.5 kV,氣簾氣壓為30 PSI,霧化氣壓為5 PSI,加熱器溫度為150℃,質譜掃描方式為信息依賴的采集工作模式。
1.2.5 數據處理
采用Mascot 2.3軟件(Matrix Science)對質譜結果原始數據進行處理,消化酶選擇胰蛋白酶,允許最大漏切位點為2;固定修飾為:Carbamidomethyl(C);可變修飾為:Acetyl(Protein N-term)、Deamidated(NQ)、Dioxidation(W)、Oxidation(M)、Phospho(ST)和Phospho(Y);MS容差為±15 ppm,MSMS容差為±0.15 Da,Protein score C.I.%大于95%為鑒定成功。
2 實驗結果
2.1 大熊貓、亞洲黑熊流式分選純化
大熊貓紅細胞懸液樣本染色后,根據血細胞特性,使用SSC和FSC參數差異去除掉細胞碎片,血小板及黏連細胞,使用Hoechst染料去除掉有核細胞,獲得高純度大熊貓紅細胞,并對分選后細胞懸液濃縮后制片觀察進行驗證,結果如下(圖1)。
2.2 大熊貓、亞洲黑熊紅細胞膜蛋白電泳檢測
大熊貓與亞洲黑熊紅細胞膜蛋白SDS-PAGE分析,從結果中發現,條帶上大熊貓、亞洲黑熊與人類分布差不多,小鼠明顯少于三者。
2.3 大熊貓、亞洲黑熊紅細胞膜蛋白質譜檢測
通過Blast2GO軟件對大熊貓及亞洲黑熊紅細胞膜蛋白進行質譜原始結果注釋,共注釋大熊貓可溶性紅細胞膜蛋白388種,在亞洲黑熊中共注釋出315種紅細胞膜蛋白。大熊貓與亞洲黑熊紅細胞膜蛋白在細胞上的定位主要在于膜部分、胞外區、胞內區及蛋白復合體,大熊貓紅細胞膜蛋白和亞洲黑熊膜蛋白在細胞上的定位位置基本相同。大熊貓和亞洲黑熊膜蛋白發揮催化功能的蛋白從種類上分析差不多,主要有水解酶、轉移酶、氧化還原酶和裂解酶;數量上,大熊貓紅細胞所含各類酶組分較亞洲黑熊豐富。結果見表1,對這些酶類進行檢索后發現,大熊貓較亞洲黑熊在糖酵解及物質轉運相關蛋白及酶系有諸多特有蛋白或酶類亞類,結果見表2。

表1 大熊貓、亞洲黑熊膜蛋白質譜檢測結果Tab.1 Mass spectrometry results of RBC membrane proteins from giant panda and Asian black bear
2.4 大熊貓、亞洲黑熊紅細胞膜蛋白功能分類分析
在用生物功能對大熊貓及亞洲黑熊膜蛋白進行區分后,對比可知,大熊貓與亞洲黑熊膜蛋白上都發揮了比較相似的作用,如結合、酶催化、生物識別、信號轉導和轉運,結果發現二者蛋白分類相似,大熊貓比亞洲黑熊紅細胞膜上存在約20種與代謝相關蛋白類。
3 討論
質譜技術在人類紅細胞膜蛋白的研究中已有很廣泛的應用。2006年,Pasini等[10]對紅細胞膜蛋白通過LTQ-FT質譜技術鑒定出252種可溶性膜蛋白,并對這些蛋白在細胞膜上存在的位置、生物學功能進行了分類討論。在隨后的研究中,研究人員通過對儲存3 d、21 d、42 d后的紅細胞膜蛋白通過LC-MS/MS進行蛋白質組研究,發現紅細胞膜表面發揮酶功能的蛋白及信號轉到相關的蛋白含量下降,認為這可能是儲存后的紅細胞生存能力減弱的原因[11]。一些研究人員通過質譜技術從蛋白質組學上分析了人與小鼠的差別[12],在紅細胞膜蛋白功能方面的研究中通過敲除小鼠對半胱氨酸的氧化過程進行了分析[13],還通過紅細胞胞漿蛋白的質譜分析,發現了先天再生障礙性貧血患者獨特的炎性反應[14]。
由于大熊貓紅細胞膜蛋白承載著紅細胞所行使的生理功能,而目前尚無針對細胞膜蛋白的研究。在對大熊貓紅細胞膜蛋白的研究中,通過SDS-PAGE條帶分析可以發現,大熊貓與亞洲黑熊蛋白條帶數目相近,說明所含蛋白種類相似度較高(圖2),這也提示大熊貓紅細胞膜表面蛋白和亞洲黑熊紅細胞膜表面蛋白種類可能相差不大。在進一步通過質譜研究中,我們發現大熊貓與亞洲黑熊的紅細胞具有功能類似的膜蛋白組成,在這些生物功能中的代謝部分大熊貓較亞洲黑熊多20種(表2,圖3),這提示可能大熊貓隨著生活習性特化,導致其體內生命活動過程發生了改變,最終導致其紅細胞膜蛋白功能的改變以適應上述變化。本研究中未發現亞洲黑熊較大熊貓具有特有的膜蛋白,其可能的原因是,目前亞洲黑熊尚無參比序列及相關蛋白數據庫,故質譜結果僅可根據大熊貓數據庫進行比對,可能導致少部分蛋白注釋存在偏差。
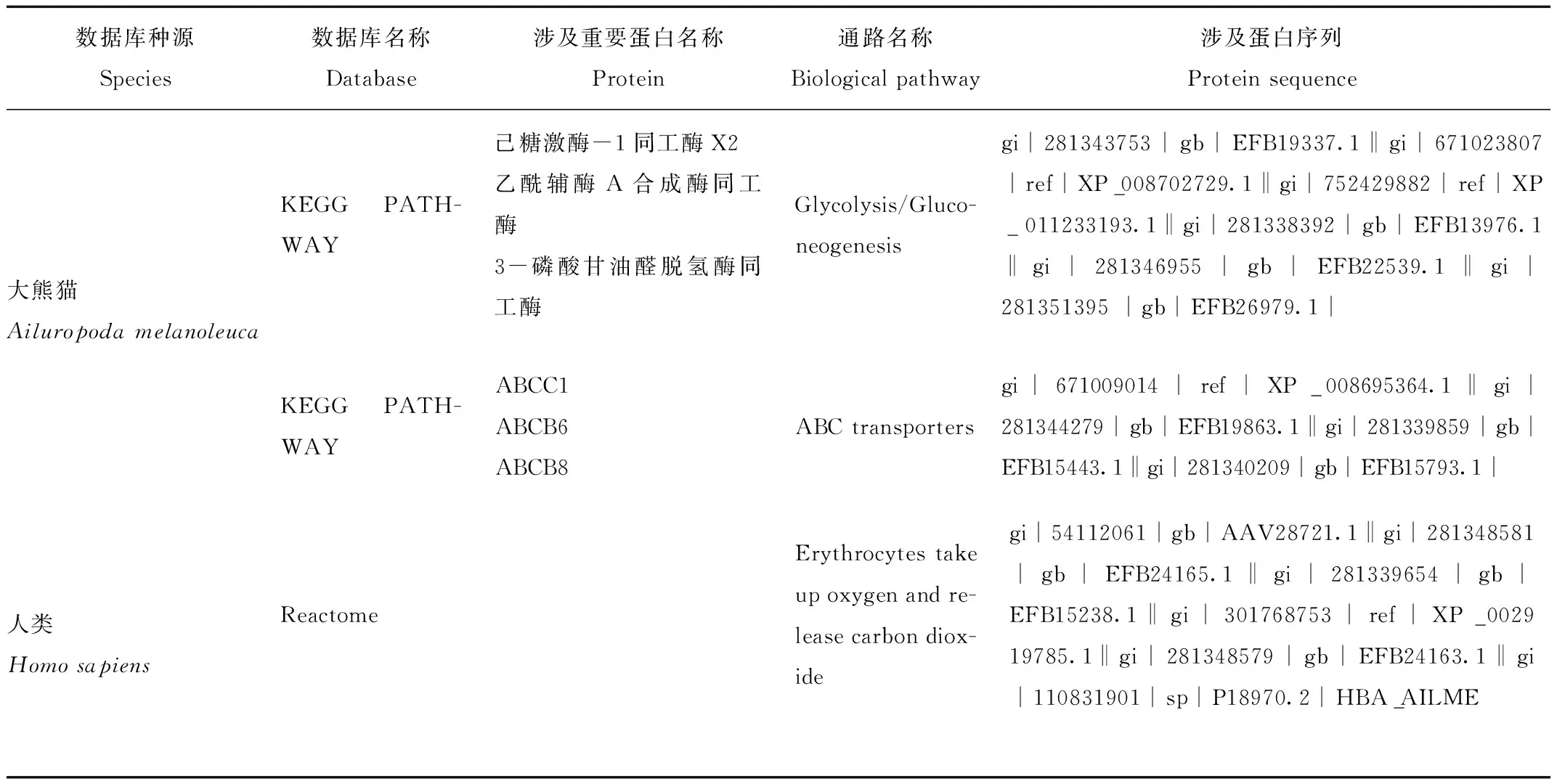
表2 大熊貓、亞洲黑熊紅細胞膜蛋白差異蛋白涉及生物學過程Tab.2 Distinct membrane proteins involved in different pathway in giant panda
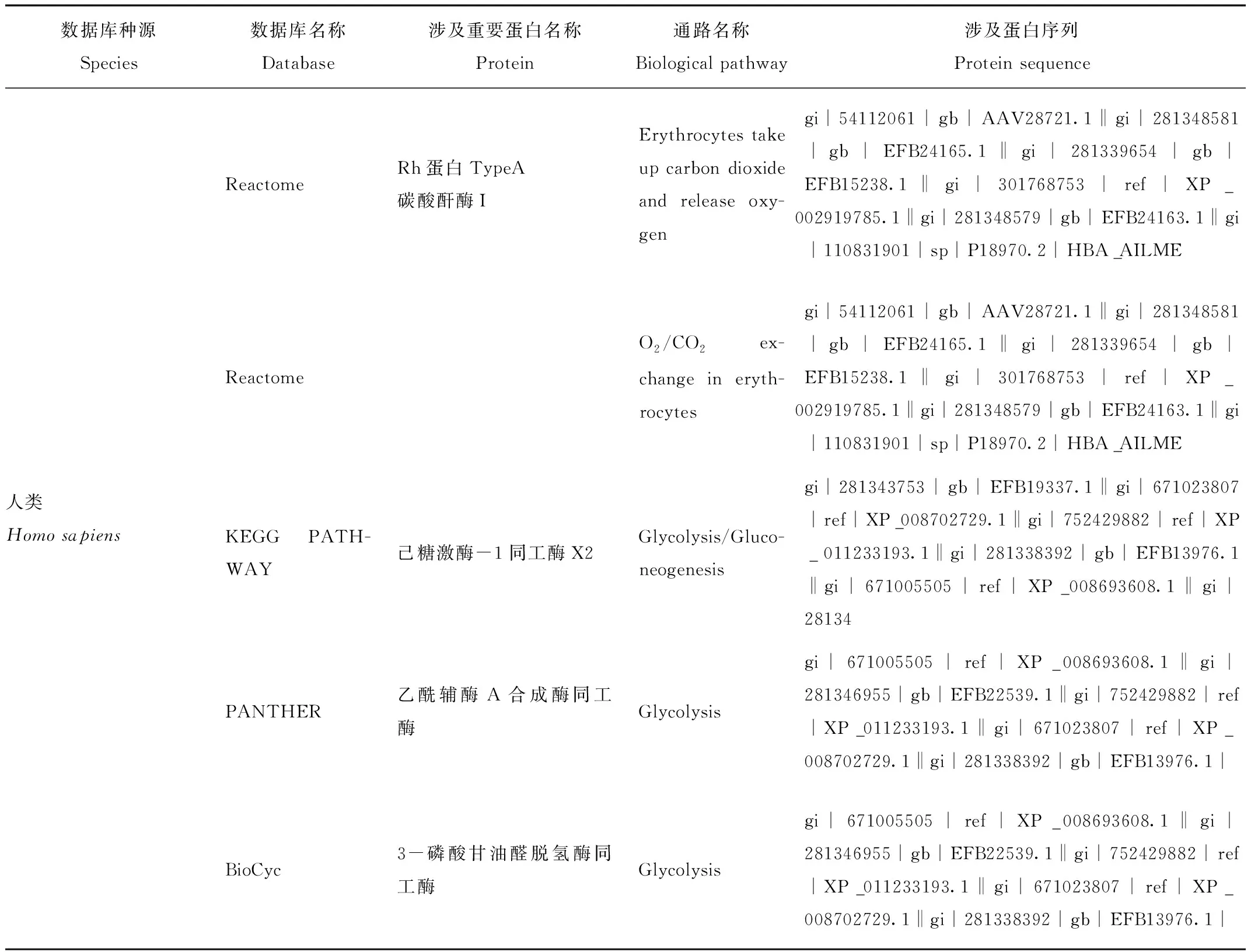
續表2
在質譜檢測中我們還發現蛋白注釋結果中有很多屬于內膜系統的蛋白質。由于成熟的哺乳動物紅細胞只有細胞膜而不含有其他的亞細胞結構膜系統。所以理論上講,由紅細胞制備的細胞膜蛋白不會有內膜系統的干擾,故在大熊貓紅細胞膜上所鑒定到的其他內膜系統上的蛋白來源只有一種可能,就是當紅細胞脫核后,這些蛋白重新定位到紅細胞膜上,繼而可能發揮新的生理功能。這一過程發生的機理、膜蛋白定位的變化及與其定位到紅細胞膜后的特定生理功能還有待進一步研究。
4 結論
通過膜蛋白電泳及質譜檢測對大熊貓及亞洲黑熊紅細胞膜蛋白進行研究后,發現大熊貓與亞洲黑熊紅細胞膜蛋白組成符合哺乳動物紅細胞膜組成規律。通過膜蛋白質譜檢測共檢測標定大熊貓紅細胞膜蛋白388種,亞洲黑熊紅細胞膜蛋白315種。

