水貂源致病性大腸桿菌對喹諾酮類藥物耐藥表型與耐藥基因型檢測與分析
郭家媚 葛 成 張文斌 吳同壘張志強 賈青輝 張召興,2* 張艷英*
(1.河北科技師范學院,河北省預防獸醫學重點實驗室,昌黎,066600;2.河北旅游職業學院,承德,067000)
水貂大腸桿菌(Escherichiacoli)病是水貂養殖中主要的細菌性傳染病之一,該病對不同階段的水貂均有易感性,尤其對40—60日齡的幼貂最易感,可以引起幼貂的急性敗血型、肺炎、腸炎及神經癥狀等一系列疾病,發病率和死亡率均較高,還可以導致妊娠母貂的死胎、流產,給水貂養殖業造成嚴重的經濟損失[1-2]。臨床中抗生素是防治大腸桿菌主要手段,長時間過量添加使用抗生素,進而導致大腸桿菌產生耐藥性,其耐藥性可以在不同菌株傳播,從而導致抗生素防治效果減低,對養殖業和人們的健康具有潛在的威脅[3]。
喹諾酮類藥物為臨床中常用的人工合成的廣譜類抗生素之一,該類藥物具有抗菌譜廣、效果顯著、使用安全等多種優點,被廣泛應用[4]。相關研究表明,大腸桿菌、沙門菌(Salmonella)、綠膿桿菌(Pseudomonasaeruginosa)、肺炎克雷伯氏桿菌(KlebsiellaPneumoniae)等病原菌對喹諾酮類藥物產生很強的耐藥性,其產生的耐藥性與其攜帶的耐藥基因具有一定的相關性[5-6]。本試驗以臨床中分離的15株水貂源致病性大腸桿菌為研究對象,檢測其喹諾酮類藥物耐藥表型和耐藥基因,分析其相關性,為臨床中喹諾酮類藥物在水貂養殖過程合理應用及研究其耐藥機制提供參考依據。
1 材料與方法
1.1 試驗菌株
1.1.1 試驗菌株
15株水貂源大腸桿菌分離患腹瀉病水貂的肝臟、肛拭子等組織,通過人工感染致病試驗,具有很強致病性,由河北省預防獸醫學重點試驗室保存。
1.1.2 實驗材料
恩諾沙星、環丙沙星、氧氟沙星、諾氟沙星藥敏紙片均購自北京天壇藥物生物技術開發公司;營養瓊脂、營養肉湯均購于北京陸橋生化試劑有限公司;DNA Marker 2000 購于北京中科瑞泰生物科技有限公司;2×Master Mix購自北京康為世紀生物科技有限公司。
1.1.3 實驗材料
FGEN02TD型PCR儀,英國Techne公司生產;Bio-Rad型凝膠成像系統,美國Bio-Rad生產;DHP-9082型恒溫培養箱,上海一恒科技有限公司生產。
1.2 方法
1.2.1 藥敏試驗
按照美國臨床檢驗標準委員會(NCCLS)2019年推薦的標準K-B紙片法進與試驗于結果判斷。將菌株復蘇擴大培養,調整菌液濃度為0.5個麥氏濁度,無菌條件下均勻涂在營養瓊脂,貼上藥敏紙片,37℃培養12—18 h后,每種藥物做3個重復,測量抑菌直徑。
1.2.2 基因組DNA的制備
采用水煮法提取菌株的基因組DNA,取1 mL菌液放到1.5 mL EP管于離心,棄上清液加1 mL生理鹽水反復洗滌3次,加入200 μL生理鹽水,放入金屬浴中100℃ 10 min,冷卻后10 000 rpm/min,離心2—3 min,吸取上清液體,即為DNA模板。
1.2.3 基因PCR檢測
參考文獻[7],根據根據GenBank上引物序列,設計喹諾酮類藥物9種的耐藥基因引物(gyrA、gyrB、qnrA、qnrB、qnrC、qnrD、qnrS、Aac(6′)-Ib-cr、pare)由上海生工生物工程有限公司合成。已提取15株致病性大腸桿菌的基因組DNA為模板,對喹諾酮類藥物9種的耐藥基因進行PCR檢測。反應體系(50 μL):2×Master Mix 30 μL,上、下游引物各1.5 μL,DNA 模板2 μL,ddH2O 15 μL;PCR反應條件為94℃ 5 min,94℃ 50 s,56℃ 45 s,72℃ 1 min,30個循環,72℃延伸10 min。PCR結束后取5 μL擴增產物,在1%瓊脂糖凝膠上電泳檢測,其PCR產物上海生工生物工程有限公司進測序,其測序結果與GenBank中的參考序列進行對同源性比較。
1.2.4 耐藥表型與耐藥基因相關性分析
參考文獻[6],臨床分離的15株水貂源致病性大腸桿菌對喹諾酮類藥物耐藥性與攜帶耐藥基因進行統計,計算其符合率,分析其相關性。
2 結果與分析
2.1 藥敏試驗檢測與耐藥表型分析結果
由表1可知,臨床分離的15株水貂源致病性大腸桿菌對4種喹諾酮類藥物均產生不同程度的耐藥性。對諾氟沙星耐藥性為40%、恩諾沙星46.7%、左氧氟沙星40%,環丙沙星26.7%。
如何在刑事立法政策的制定過程中辯證地認識民意,正確引導民意、有效利用民意是一個需要亟待解決的問題。然而民意的定義與范圍十分抽象、復雜,甚至真偽難辨,一旦研判失誤,極易誤導決策者,甚至可能造成社會混亂。因而對民意的考量必須加以合理的規制。
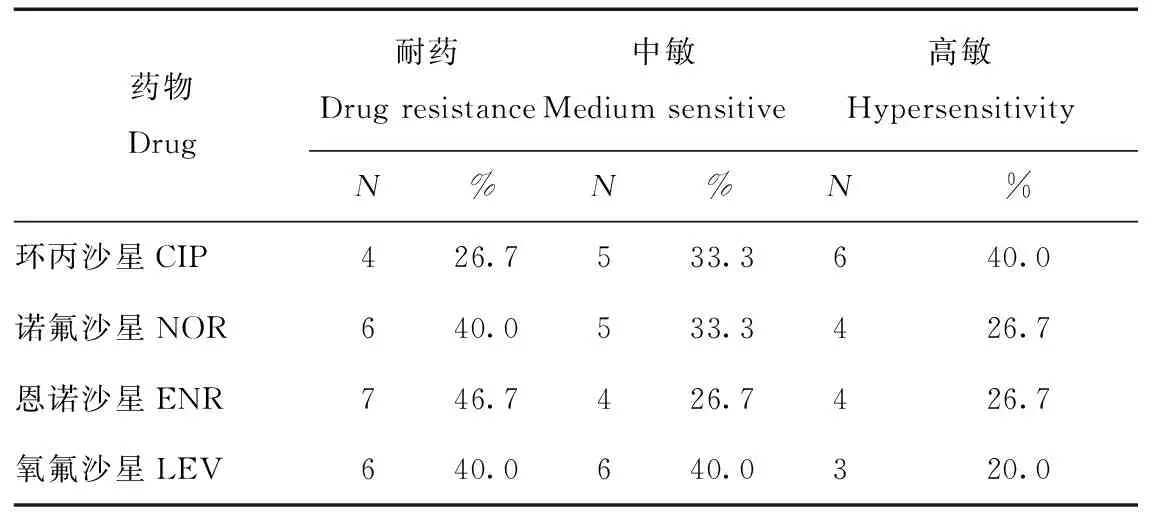
表1 15株大腸桿菌分離株耐藥性分析結果Tab.1 Drug resistance analysis results of 15 strains of Escherichia coli
由表2可知,臨床分離的15株水貂源致病性大腸桿菌呈現多重耐藥,多重耐藥占分離菌株的40%。共呈現3種耐藥表型,其中耐藥表型CIP+-NOR+-ENR+-NA+菌株有4株,占分離菌株的26.7%,耐藥表型為NOR+-ENR+-NA+-CIP-的菌株有2株,占分離菌株的13.3%;耐藥表型是NOR+-CIP--NOR--ENR-菌株有3株,占分離菌株的20%。

表2 15株大腸桿菌分離株耐藥表型分析結果Tab.2 Analysis results of drug resistance phenotype of 15 strains of Escherichia coli
2.2 耐藥基因型檢測與分析結果
臨床分離的15株水貂源致病性大腸桿菌同時攜帶7種耐藥基因gyrA、gyrB、qnrA、qnrB、qnrS、Aac(6′)-Ib-cr、pare,目的條帶大小與實際相符(圖1),其測序結果與GenBank中的登錄參考序列相比,同源性均>97%。由表3可知,耐藥基因gyrA、gyrB、qnrA、pare、qnrB檢出率較高,檢出率為80%—100%,耐藥基因Aac(6′)-Ib-cr、qnrS檢出率分別為40%、7.0%。耐藥基因qnrC、qnrD未檢出。

表3 耐藥基因檢出率結果Tab.3 Results of drug resistance gene detection rate
由表4可知,臨床分離的15株水貂源致病性大腸桿菌同時攜帶多種耐藥基因,呈現多種耐藥基因型,其中耐藥基因型gyrA+gyrB+qnrA+pare+菌株有3株,占分離菌株的20%,耐藥基因型gyrA+gyrB+qnrA+pare+qnrB+Aac(6′)-Ib-cr+的菌株有6株,占分離菌株的40%;耐藥基因型為表型gyrA+gyrB+qnrA+pare+qnrB+菌株有5株,占分離菌株的33.3%;耐藥基因型gyrA+gyrB+qnrA+pare++qnrB+qnrS+菌株有1株,占分離菌株的0.7%。

表4 耐藥基因型分析結果Tab.4 Analysis results of drug resistant genotypes
2.3 耐藥表型與耐藥基因相關性分析結果
由表5可知,恩諾沙星、諾氟沙星、氧氟沙星、環丙沙星耐藥表型與耐藥基因gyrA、gyrB、qnrA、pare符合率為40%—53.3%,恩諾沙星、諾氟沙星、氧氟沙星、環丙沙星耐藥表型耐藥基因Aac(6′)-Ib-cr復合率20%—30%,環丙沙星、諾氟沙星與耐藥基因qnrB符合率為26.7%—33.3%,恩諾沙星、氧氟沙星與耐藥基因qnrB均為46.7%。

表5 耐藥表型與耐藥基因相關性分析結果Tab.5 Analysis results of correlation between drug resistance phenotype and drug resistance gene %
3 討論
大腸桿菌是臨床中主要人畜共患病原菌,該菌可以引起多種動物發病,當外界條件改變時,多種動物宿主處于免疫力低下的狀態,大腸桿菌通過多種途徑入侵宿主,在宿主的體內大量地繁殖,進而引起宿主一系列疾病[8]。近幾年,隨著養殖業的發展,水貂養殖數量逐漸升高,關于水貂大腸桿菌病的報道逐漸增多,大腸桿菌對水貂養殖危害較大。因此,在水貂養殖過程中應注意該病的防控。
臨床中常用的喹諾酮類藥物主要包括環丙沙星、恩諾沙星、氧氟沙星等,廣泛用于醫學、獸醫學臨床,臨床上喹諾酮類藥物頻繁使用,動物源的大腸桿菌對喹諾酮類藥物產生很強的耐藥性,不同動物對喹諾酮類藥物耐藥性具有一定差異性[9]。本試驗研究表明,15株水貂源致病性大腸桿菌對恩諾沙星、諾氟沙星、氧氟沙星、環丙沙星耐藥率為46.7%—26.7%,呈現多重耐藥性,與于杰等[10]報道的水貂源大腸桿菌對氟喹諾酮類藥物產生很強的耐藥性一致。與夏琦琦等[2]、馮濤等[11]的報道存在差異性,可能與氟喹諾酮類藥物在水貂養殖過程中使用頻率及地區有關。大腸桿菌對喹諾酮類抗生素耐藥性的產生,不僅與喹諾酮類抗生素藥物的不規范使用有關,還與其攜帶耐藥基因有關,喹諾酮耐藥基因是有質粒介導的,qnrA、qnrB、qnrS、qnrC、qnrD基因通過質粒可以介導的喹諾酮藥物的耐藥性,oqxA和oqxB基因通過介導細菌的外排作用產生耐藥性[9-12]。國內外對動物源大腸桿菌對喹諾酮類藥物耐藥性的研究較多,但是對水貂源致病性大腸桿菌介導的喹諾酮耐藥基因oqxA、oqxB、qnrA、qnrB、qnrC、qnrD、qnrS等研究較少。本試驗結果表明,15株水貂源致病性大腸桿菌攜帶多種耐藥基因,呈現多種耐藥基因型,其中恩諾沙星、諾氟沙星、氧氟沙星、環丙沙星耐藥表型與耐藥基因gyrA、gyrB、qnrA、par的符合率為40%—55.3%,具有一定相關性,說明水貂大腸桿菌對喹諾酮藥物耐藥性產生可以與耐藥基因gyrA、gyrB、qnrA、par有關,其作用機制尚未明確,有待進一步研究。本試驗為臨床中喹諾酮類藥物在水貂養殖過程合理應用及研究其耐藥機制提供參考依據。

