黃芩廢渣生物質炭對鹽酸四環素的吸附性能研究
張 剛,王小平,2
(1.漳州衛生職業學院 藥學系,福建 漳州 363000;2. 漳州市現代中藥重點實驗室(漳州衛生職業學院),福建 漳州 363000)
0 引言
四環素類抗生素是一類廣譜性抗生素,在人畜感染預防、畜禽牧漁業養殖和農業生產中大量和廣泛使用。由于其具有可變的結構,良好的水溶性和較長的半衰期,未被利用和代謝的抗生素進入環境,對生態環境和人體健康會造成嚴重影響[1-2],同時使環境修復和人體康復變得更加困難[3]。因此,研究如何減少和除去環境中四環素類抗生素,對保護生態環境和保障人體健康都具有重要意義。目前去除水體和土壤中四環素類抗生素的方法有吸附法、混凝沉淀法、反滲透法、光解法、高級氧化法和生物處理等[4-5]。生物質炭作為一種來源豐富、成本低廉的新型吸附材料,因具有操作簡單高效和處理效果優良的特點,成為目前吸附法中處理水體和土壤中四環素類抗生素污染的重要材料,得到廣泛研究和應用[6-7]。
黃芩是一種常見中藥材,具有解熱、抗腫瘤等作用,有效成分為黃酮及黃酮苷類、多糖類和揮發油類等化合物[8],其有效成分提取后,會產生大量的中藥廢渣。中藥廢渣傳統的填埋和焚燒等處理方式,不僅污染環境,而且沒有有效利用余渣資源。黃芩廢渣的主要成分為纖維素、半纖維素和木質素等,是制備生物質炭的優良材料。本研究以中藥黃芩廢渣為原料,以KOH為活化劑,經高溫炭化活化制備高比表面積黃芩廢渣生物質炭,考察其對水中鹽酸四環素(TC)的吸附性能。本研究旨在拓寬水體中四環素類抗生素的去除途徑,同時為中藥黃芩廢渣資源化利用提供一種可行的方法。
1 材料與方法
1.1 材料與試劑
黃芩廢渣(提取黃芩苷后藥渣,安徽億源中藥飲品有限公司);無水乙醇、氫氧化鉀、濃鹽酸(均為西隴化工股份有限公司)、鹽酸四環素(TC,Adamas-01101785,97%+);水為去離子水。
1.2 儀器與設備
FA1004電子分析天平,紹興市景邁儀器設備有限公司;101-1A立式電熱恒溫鼓風干燥箱,天津通利信達儀器廠;BJ-150中藥粉碎機,德清拜杰電器有限公司;SX2箱式電阻爐,上海實驗儀器廠有限公司;SHB-III真空泵,鄭州長城科工貿有限公司;FE20型PH計,梅特勒-托利多(上海)有限公司;SHA-C恒溫水浴振蕩器,金壇市新航儀器廠;PHENOM ProX掃描電鏡,復納科學儀器(上海)有限公司;JW-BK112比表面積及孔徑分析儀,北京精微高博科學技術有限公司;TU-19紫外可見分光光度計,北京普析通用儀器有限責任公司。
1.3 實驗方法
1.3.1 黃芩廢渣生物質炭的制備
將提取黃芩苷后藥渣用水洗滌至中性,放置在鼓風干燥箱中,80 ℃干燥至恒重,粉碎后過100目篩。再將過篩后粉末與KOH溶液按一定浸漬比混合均勻后轉移至電阻爐中,快速升溫700 ℃,活化1.5 h后,用0.1 mol·L-1鹽酸浸泡10 min,然后減壓抽濾,用去離子水洗滌至濾液呈中性,于110 ℃烘箱中干燥至恒重,過200目篩備用。
1.3.2 表征與測試
黃芩廢渣生物質炭形貌由PHENOM ProX掃描電鏡能譜一體機進行表征;表面孔結構由JW-BK112比表面積及孔徑分析儀測定;生物質炭表面零電點(pHPZC)采用Boehm滴定法測定[9];溶液中TC濃度用TU-19紫外可見分光光度計測定。
1.3.3 鹽酸四環素(TC)標準曲線的繪制
取10 mg·L-1的TC溶液,置于紫外可見分光光度計中,在200~500 nm范圍內進行光譜掃描,得到λmax=357 nm,同時測得不同pH條件下TC溶液在λ=357 nm均有相對較好吸光度。配制10mg·L-1、15 mg·L-1、20 mg·L-1、25 mg·L-1和30 mg·L-1的TC溶液,在λ=357 nm 處測定其吸光度,繪制標準曲線(圖1)。標準曲線方程為y=0.031 4x+0.005 2,R2=0.999 89。
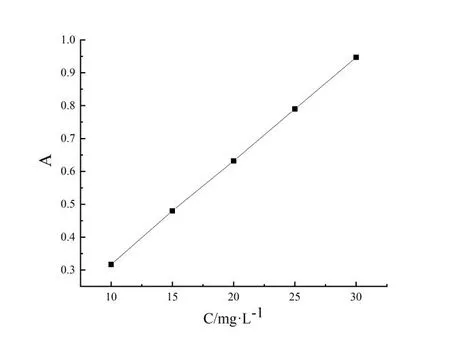
圖1 TC標準曲線
1.3.4 TC吸附實驗
實驗方法:取50 mL TC溶液,由HCl溶液和NaOH溶液調節其pH值,加入0.05 g黃芩廢渣生物質炭,混勻后放入恒溫水浴振蕩器中,以200 r·min-1振蕩吸附,一定時間(t)后取出,用25 μm濾膜過濾,然后用紫外可見分光光度計在λ=357 nm處測量濾液吸光度,利用標準曲線計算濾液中TC濃度,每次做3個平行樣品,利用公式(1)計算后,取平均值得到生物質炭對TC的吸附量。
(1)
式中:q為黃芩廢渣生物質炭對TC的吸附量,mg·g-1;c0和ct分別為吸附前和吸附t時刻時TC濃度,mg·L-1;V為溶液體積,L;m為黃芩廢渣生物質炭質量,g。
改變溶液pH、吸附質濃度、吸附時間和溫度等條件研究生物質炭對TC的吸附性能,實驗和分析方法同上。
2 結果與分析
2.1 黃芩廢渣生物質炭的表征
2.1.1 生物質炭掃描電鏡(SEM)和孔結構分析
黃芩廢渣生物質炭放大4300倍的SEM形貌見圖2。從圖2中可以清晰看到在生物質炭表面形成了大量10 μm左右的大孔和無數的微小孔隙。根據文獻報道[10-11],炭化活化過程中,活化劑KOH與基體發生氧化反應,基體炭被大量消耗形成多孔結構,反應過程中產生的CO、CO2和H2O等氣體能進一步擴展孔隙并最終形成大孔,同時這些氣體向外表面擴散時能進一步產生致孔效應,生成大量的中孔和微孔。上述反應過程中產生的K2CO3和K2O等可溶性鹽(氧化物),在后續的酸洗過程中溶解,能進一步豐富生物質炭表面的孔結構。這種多級多孔結構的形成增大了生物質炭的比表面積,有利于其對TC的吸附。經測定制備的黃芩廢渣生物質炭的BET比表面積為1080 m3·g-1,平均孔徑為2.252 nm,BJH吸附累積孔內表面積(孔徑1.70~300.00 nm范圍)為158.351 m3·g-1。
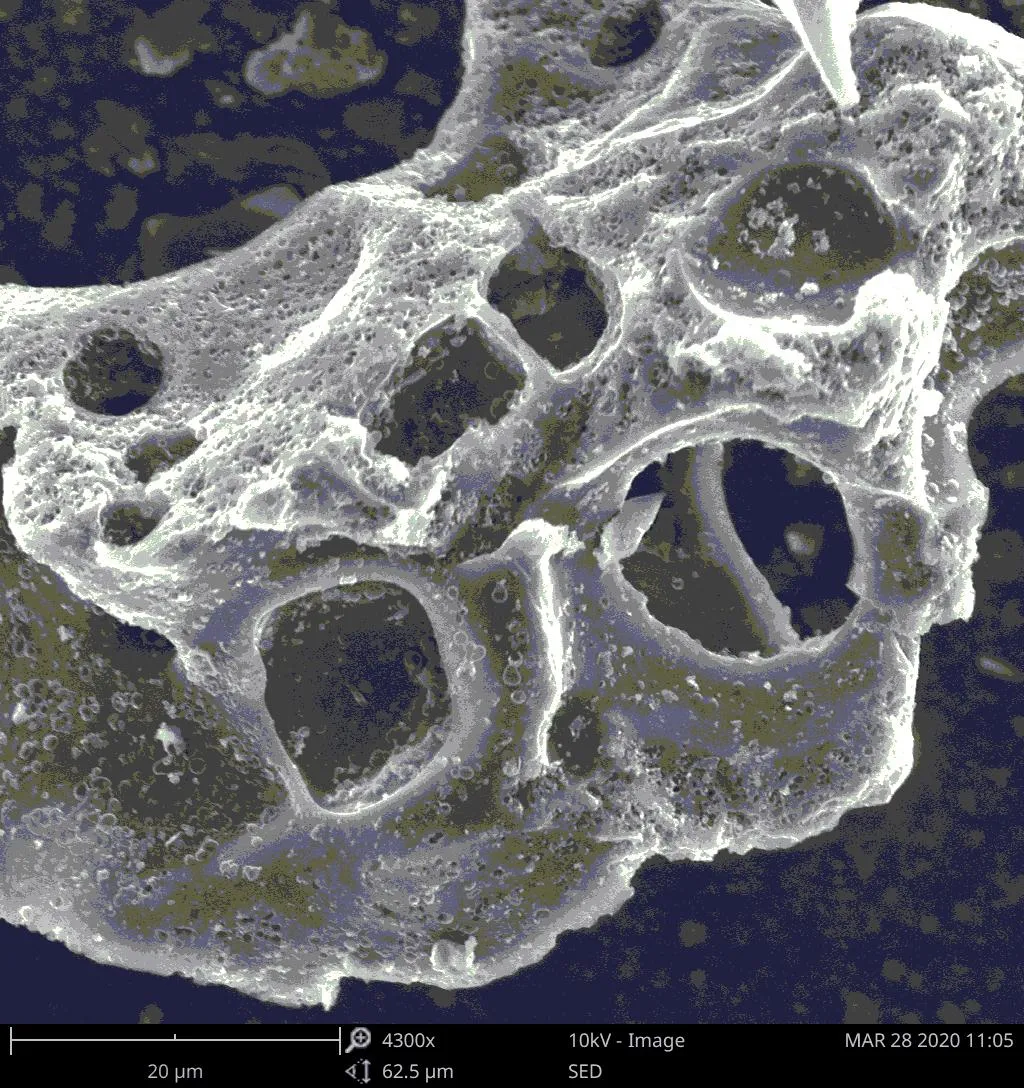
圖2 生物質炭SEM圖
2.1.2 生物質炭零電點(pHPZC)

圖3 黃芩廢渣活性炭pHPZC
2.2 溶液pH值的影響
溶液(c0=100 mg·L-1)pH值對黃芩廢渣生物質炭吸附TC的影響如圖4所示。從圖中可以看出溶液pH值對吸附有顯著的影響。在強酸性溶液中,生物質炭對TC吸附能力較強,平衡吸附量可達95 mg·g-1以上,當溶液pH值為2.4時測得吸附量高達98.57 mg·g-1。之后隨著溶液pH值增加,生物質炭對TC吸附能力急劇降低,實驗表明在溶液pH≧4后,平衡吸附量減小到40 mg·g-1以下;在pH>10以后,平衡吸附量下降到15 mg·g-1以下。這種變化趨勢跟其他研究者的結果相近,即TC在生物質炭表面的吸附量隨著溶液pH值升高先增大后減小[12]。
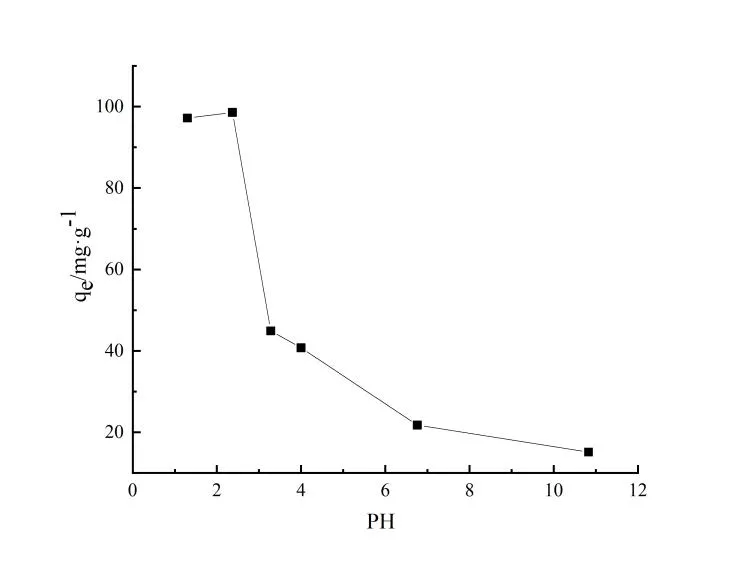
圖4 溶液pH值對TC平衡吸附量的影響
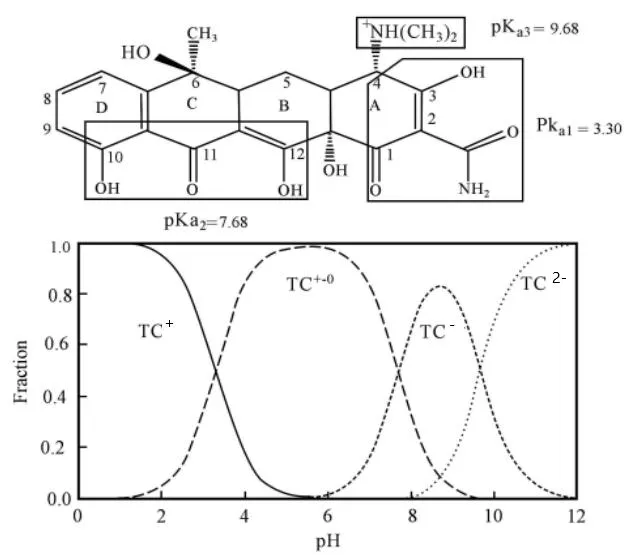
圖5 溶液pH值對TC存在形式的影響[13]
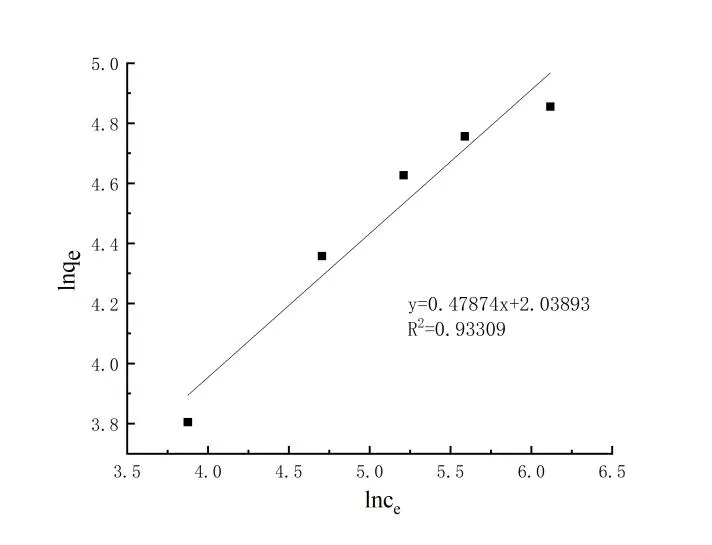
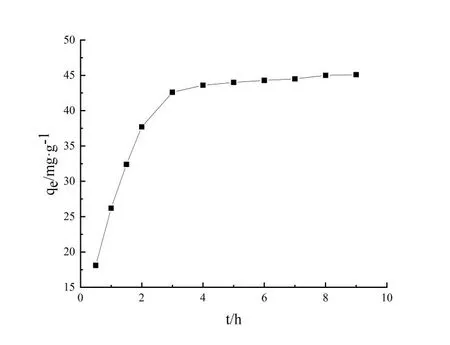
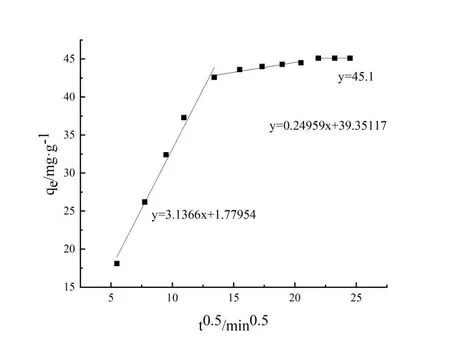
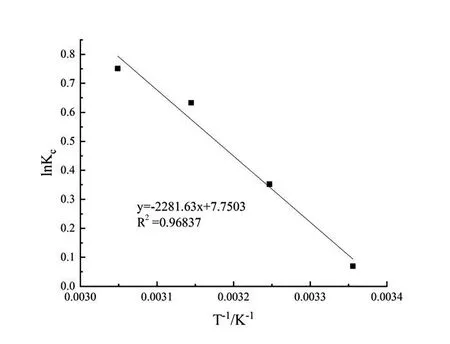
TC在生物質炭表面吸附量這種變化趨勢主要是因為pH值直接影響著溶液中TC的存在形態和生物質炭表面質子化程度[14]。TC在水溶液中的電離平衡常數(pKa1、pKa2、pKa3)分別為3.30、7.68、9.68(如圖5所示),在pH<3.3時,TC主要以H3TC+陽離子形式存在[15];當3.4 取不同濃度的TC溶液,調節溶液pH=3.3,考察吸附質濃度對生物質炭平衡吸附量的影響(圖6)。利用Langmuir(式2)、Freundlich(式3)兩種模型對等溫吸附進行線性擬合,擬合和分析結果分別如圖7和圖8所示。 (2) (3) 式中:ce為平衡時TC濃度,mg·L-1;qm為黃芩廢渣生物質炭的理論飽和吸附量,mg·g-1;kL和kF分別為Langmuir和Freundlich平衡常數。 如圖6所示,隨著TC初始濃度的增加,生物質炭對其平衡吸附量逐漸增大,原因是高濃度TC提供了較大的驅動力,克服了吸附質由溶液向吸附劑表面的遷移阻力[23]。Langmuir模型假定吸附劑表面吸附位點均勻分布,吸附質以單分子層形式吸附在其表面,吸附分子之間獨立存在,沒有相互作用力[24]。Langmuir模型擬合等溫吸附平衡數據R2=0.9963,表明TC在生物質炭表面以單分子層吸附為主,計算得理論最大吸附量為164.2mg·g-1,與實驗測得的最大吸附值175.75mg·g-1略小,原因可能是因為TC分子中具有酰胺基、酚羥基和苯環等結構,分子之間較容易產生氫鍵和共軛現象,部分生物質碳表面存在多層吸附現象[25]。Freundlich模型用來描述吸附點位非均勻表面的多層吸附現象[26],方程中n值反映了吸附反應強度,n值越大,吸附性能越好(一般認為n值在2~10之間易于吸附),計算得此吸附n為2.09,屬于優惠吸附,說明吸附過程中發生協同作用,吸附質分子間存在較強的相互作用[27]。 圖6 TC初始濃度對平衡吸附量的影響 圖7 Langmuir等溫擬合曲線 圖8 Freundlich等溫擬合曲線 取100 mg·L-1TC溶液,調節溶液pH=3.3,用黃芩廢渣生物質炭吸附不同時間后取樣測定,考察時間對吸附的影響(圖9)。從圖9可以看出,生物質炭對TC的吸附量增速呈現先快后慢,3 h后吸附量為42.6 mg·g-1,達到平衡吸附量的94.7%。產生這種現象的原因是初始階段TC濃度較高,吸附質擴散驅動力大,吸附劑表面活性吸附點位多,擴散到生物質炭表面的TC能夠充分接觸吸附劑外表面活性點位而被迅速吸附。隨著吸附的進行,溶液中TC濃度變小,且生物質炭外表面活性點位大多被占據,吸附主要發生在生物質炭內表面,此時TC與生物炭的吸附驅動力變小,吸附速率降低,吸附量增速相對較慢,8 h后基本達到吸附平衡,平衡吸附量為45.16 mg·g-1。 圖9 吸附時間的影響 利用準一級動力學方程(式4)和準二級動力學方程(式5)對上述吸附過程進行線性擬合分析,擬合結果如表1所示。 (4) (5) 式中:qe和qt分別為吸附平衡和t時刻黃芩廢渣生物質炭對TC的吸附量,mg·g-1;k1為準一級動力學吸附速率常數,min-1;k2為準二級動力學吸附速率常數,g·mg-1·min-1。 由表1可以看出,準二級動力學方程可以更好地描述黃芩廢渣生物質炭吸附TC過程(R2=0.994 57),利用準二級動力學得到的理論qe(50.85 mg·g-1)與實驗值qe(45.1 mg·g-1)比較接近,說明吸附動力學主要受化學作用控制,吸附劑表面空的活性點位對吸附速率有重要影響,生物質炭與TC在吸附過程中可能發生了離子交換和電子對共用,形成H鍵和π-π 共軛等穩定的化學鍵[28]。 表1 生物質炭對TC吸附動力學參數 運用顆粒內擴散模型(式6)對黃芩廢渣生物質炭吸附TC過程進行擬合分析,擬合結果見圖10。 (6) 式中:ki為顆粒內擴散速率常數,mg·g-1·min-0.5;ci為顆粒內擴散模型截距,mg·g-1;i為顆粒內擴散階段。 圖10 內擴散擬合曲線 黃芩廢渣生物質炭對TC吸附過程大致分三個階段,第一階段較高吸附質濃度提供驅動力使TC能快速通過液膜擴散至生物質炭顆粒表面,并迅速與吸附劑表面豐富的吸附點位結合,從圖10中可以看出第一階段擬合方程斜率最大,吸附速率最快,C1≠0 ,說明邊界層擴散并不能完全決定該階段速率[29]。第二階段為內擴散吸附占主導過程[30],由于內擴散阻力相對較大,所以吸附速率變小(k2 取50 mL TC溶液,調節溶液pH=3.3,加入0.05 g黃芩廢渣生物質炭,在不同溫度的水浴振蕩器中吸附至平衡,考察吸附過程中熱力學變化情況,探討吸附過程的驅動力和自發性[33]。吸附過程中吉布斯自由能(△G)、熵變(△S)和焓變(△H)等熱力學參數由Van,t Hoff方程(9)和圖11求得[34],熱力學參數計算結果如表2所示。 ΔG=-RTlnKe, (7) (8) (9) 式中:R為氣體常數,8.314J·mol-1·K-1;T為溫度,K; Ke為吸附平衡常數,L·g-1。 圖11 生物質炭吸附TC的Van't Hoff圖 表2 生物質炭吸附TC熱力學參數 從表2可知,實驗條件下△G為負值,且隨著溫度升高△G絕對值變大,說明生物質炭對TC的吸附是一個自發的過程,隨著溫度的升高,吸附的自發性增強;△H>0,說明吸附是一個吸熱過程,升高溫度有利于生物質炭對TC的吸附;△S>0,說明吸附過程增加了固液界面的無序度,有利于生物質炭對TC的吸附[35]。 通過一步法炭化活化制取的黃芩廢渣生物質炭具有多級多孔結構,增大了生物質炭的比表面積,有利于其對TC的吸附。生物炭對TC的平衡吸附量隨溶液pH值增加先增大后減小,吸附質和吸附劑之間存在疏水作用、靜電作用、H鍵和π-π共軛等較復雜的作用力。等溫吸附、吸附動力學和熱力學研究表明,吸附以單分子層吸附為主,吸附速率受表面擴散和內擴散共同影響,屬自發過程,升高溫度有利于吸附反應的進行。2.3 等溫吸附研究

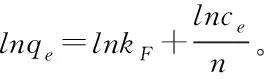
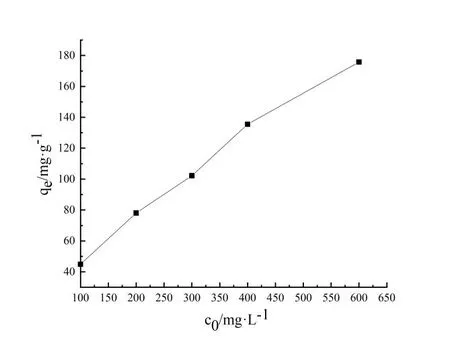
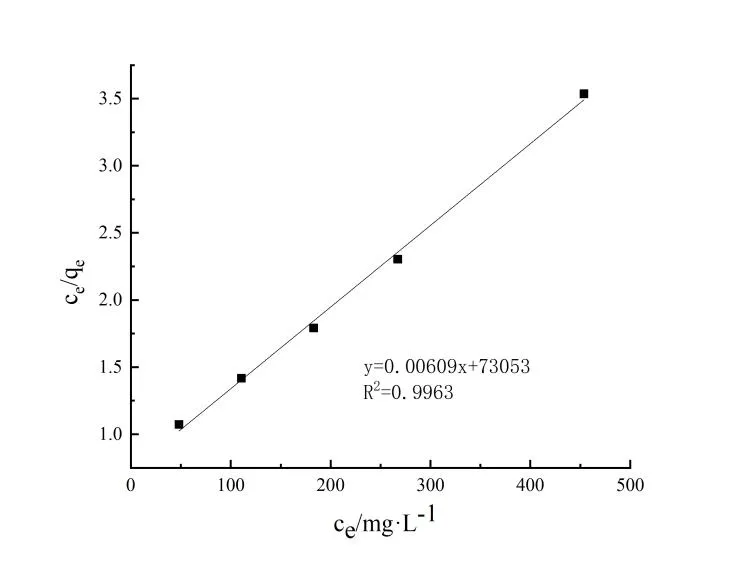
2.4 吸附動力學研究

2.5 吸附熱力學研究

3 結論

