外源性神經激肽B對雌性大鼠生殖軸GnRH和Kisspeptin表達的影響
李海玲 司文宇 宋 爽 康鐵柱 姚郅璆 葉 菁 李福寶 方富貴
(安徽農業大學 動物科技學院,合肥 230036)
中樞神經是通過下丘腦-垂體-性腺(Hypothalamo-pituitary-gonadal,HPG) 軸來調控性腺,其信息傳遞取決于3個主要來源的神經和激素信號之間的動態相互作用:下丘腦前部,促性腺激素釋放激素(Gonadotropin-releasing hormone, GnRH)合成并以脈沖形式分泌;垂體前葉,GnRH脈沖刺激垂體分泌促性腺激素;以及性腺,通過分泌性類固醇并產生配子響應促性腺激素的營養作用[1]。神經激肽B(Neurokinin B,NKB)是速激肽家族的一員[1],其主要通過神經激肽-3受體(NK3R)發揮生物學作用。NKB神經元及其受體主要分布于動物的下丘腦中[2-3],如弓狀核(Arcuate nucleus,ARC)、正中隆起(Median eminence,ME)和視前區(Preoptic area,POA)等,此外在卵巢、胎盤、睪丸及前列腺中也均能檢測到NKB及其受體NK3R分布[4-5]。
Kiss1是開啟和控制性成熟的關鍵基因,Kisspeptin由Kiss1基因編碼表達,主要與 kiss1 受體結合發揮作用,研究表明Kisspeptin/Kiss1R信號傳導是GnRH和促性腺激素分泌的主要刺激因素[6]。研究發現NKB調節女性的GnRH和促黃體生成素(Luteinizing hormone,LH)分泌[7],且主要依賴Kisspeptin調節雌激素對LH分泌的反饋來誘導卵母細胞成熟,進而促進卵泡發育[8]。Navarro等[9]發現施用于大鼠側腦室的NKB激動劑Senktide顯著增加血清中LH的水平,并且在ARC中表達c-fos的Kiss1神經元數量增加10倍。同時NKB和Kisspeptin神經元均表達 NK3R,因此NKB可能作用于Kisspeptin神經元影響GnRH分泌[10]。NKB自發現以來,研究者們發現其在調控生殖的中樞機制中起著關鍵性的作用,不僅可作用于 GnRH 神經元影響 GnRH 的分泌,進而影響卵泡刺激素(Follicle stimulating hormone,FSH)和 LH 的分泌[12],而且還能與 Kisspeptin 相互作用,共同調節生殖內分泌系統[7]。有關NKB 在大鼠、小鼠、山羊和猴子等動物生殖軸上分布的報道多數僅涉及生殖軸中的某一個或某幾個部分的組織、器官,而NKB對大鼠整個生殖軸上 NKB、GnRH 和 Kisspeptin 的分布及其表達量的影響報道甚少。因此,本研究通過側腦室外源注射NKB探討NKB對雌性大鼠生殖軸GnRH和Kisspeptin表達的影響,以期為NKB調節雌性動物生殖功能提供一定的科學依據。
1 材料與方法
1.1 試驗材料
40只60 d的普通級Sprague-Dawley(SD)雌性大鼠,購自清源實驗動物公司。
NKB購自Anaspec公司,批號23026;Trizol試劑和EnergicScript?FirstStrandcDNA合成試劑盒,購自上海閃晶分子生物科技有限公司;SYBR?Green Master Mix試劑盒,購自南京諾唯贊生物科技有限公司;小鼠源GnRH單克隆抗體(批號sc-32292)、驢抗小鼠IgG-FITC二抗(批號sc-2099)、山羊抗兔IgG-R二抗(批號sc-2780),購自上海優寧維生物科技有限公司;兔源Kisspeptin初級多克隆抗體和4′,6-二脒基-2-苯基吲哚,購自Abcam(上海)貿易有限公司。
1.2 試驗設計
將大鼠隨機分為試驗組(n=20)和對照組(n=20)。試驗組的大鼠側腦室注射10 μL(600 pmol)[11]溶解于生理鹽水的NKB溶液,對照組大鼠側腦室注射等體積的生理鹽水。所有大鼠均在側腦室后20 min處死。每組10只大鼠斷頸處死,快速分離出完整的下丘腦并凍存于-80 ℃冰箱,用于GnRH和Kiss1mRNA表達量的檢測;每組另外10只大鼠從心臟的心尖處插入針頭,用止血鉗固定后剪破右心耳,通過左心室灌注生理鹽水直至血水變清,然后灌注4%的多聚甲醛直至尾巴變硬,取下丘腦、垂體和卵巢固定于4%的多聚甲醛中,用于GnRH和Kisspeptin蛋白的免疫熒光檢測。
1.3 側腦室注射
大鼠麻醉后固定于腦室立體定位儀(BW-SDA903)上,頭顱頂部剪毛消毒后,用手術刀沿皮膚中線切開表皮暴露出前囪的位置。以前囪為中心原點,距前鹵點后方1.5 mm,左側1.0~1.5 mm的位置進行定位,隨后用牙科鉆在定位點鉆孔,將吸有不同藥物的微量進樣針固定于定位儀上并沿此孔垂直下針8.6~9.0 mm。藥物注射完畢后停留5~10 s后再緩慢將微量進樣針退出。拔針后縫合切口并進行消炎處理。術中注意觀察大鼠生命特征,做好保暖措施。
1.4 下丘腦GnRH和Kiss1 mRNA轉錄水平測定
根據說明書,使用Trizol試劑提取下丘腦總RNA。NanoDrop分光光度計在260 nm處定量總RNA。通過甲醛凝膠電泳評估總RNA的質量,選取質量合格的RNA樣品用于逆轉錄。使用EnergicScript?FirstStrandcDNA合成試劑盒,根據說明書的要求用1 μg RNA在20 μl的總反應體積中進行逆轉錄。
使用Primer Premier 5.0和AlleleID 6.0軟件,根據GenBank數據庫中GnRH,Kiss1和β-actin基因的核苷酸序列(GenBank登錄號分別為:NM_012767.2,NM_181692.1和NM_031144.3)設計引物。引物由生工生物工程(上海)股份有限公司合成,其信息見表1。

表1 RT-qPCR引物信息Table 1 RT-qPCR primers information
RT-qPCR反應體系:2 μL的cDNA模板,10.4 μL 的SYBR?Green Master Mix混合物,0.4 μL的正向引物和0.4 μL的反向引物以及6.8 μL的雙蒸水(ddH2O)。RT-qPCR條件:首先在95 ℃下預變性5 min,然后在95 ℃ 10 s和60 ℃ 30 s的40個循環中進行擴增,最后在95 ℃下15 s,60 ℃ 1 min 和95 ℃ 15 s來確定溶解曲線。通過 2-ΔΔCt法對基因相對表達量進行統計學分析。
1.5 生殖軸中GnRH和Kisspeptin的免疫熒光共定位
將4%多聚甲醛中固定的下丘腦、垂體和卵巢取出放于質量濃度300 g/L蔗糖的磷酸鹽緩沖鹽水(phosphate-buffered saline,PBS)中脫水。次日取出組織用濾紙吸取多余的水分后,將OTC包埋劑(Tissue OCT-Freeze Medium,OTC)包埋組織,隨后放入冰凍切片機內加速凍凝。調整下丘腦切片厚度為7 μm,垂體和卵巢切片厚度為5 μm,收集完整的切片于防凍溶液中并儲存在-20 ℃直至用于免疫熒光。
將下丘腦切片與小鼠源GnRH單克隆抗體(1∶500 稀釋)和兔抗大鼠Kisspeptin多克隆抗體(1∶500 稀釋)在4 ℃下孵育過夜,垂體和卵巢切片僅與兔抗大鼠Kisspeptin初級多克隆抗體(1∶500稀釋)在4 ℃下孵育過夜。次日,切片在室溫下用PBS洗3次(10 min/次)后用驢抗小鼠IgG-FITC(1∶ 200稀釋)和山羊抗兔IgG-R(1∶200稀釋)一起孵育2 h。然后室溫下用PBS洗3次(10 min/次)并加入4′,6-二脒基-2-苯基吲哚(DAPI;藍色核染色),溫育10 min。最后用50%甘油封片固定。為驗證本次試驗沒有非特異性染色,將切片同時設置陰性對照,陰性對照用PBS代替鼠GnRH單克隆抗體或兔抗大鼠Kisspeptin初級多克隆抗體。
1.6 統計分析
分別取試驗組和對照組封片后的組織切片,在熒光顯微鏡下選用綠光(FITC)、紅光(R)、藍光(DAPI)等熒光通道進行觀察、拍照,然后用Image-Pro Plus 6.0軟件對熒光分布圖片進行半定量熒光強度分析,得到其平均熒光強度值。用 Image J軟件統計下丘腦不同核團上單位面積GnRH和Kisspeptin陽性細胞的數量。
試驗數據采用配對樣本T檢驗進行分析,所有數值表示為平均值±標準差(Mean±SEM),運用SPSS Statistics軟件進行統計學處理和相關性分析。P<0.05表示顯著性差異。
2 結果與分析
2.1 NKB對大鼠下丘腦GnRH和Kiss1 mRNA轉錄水平的影響
由圖1可以看出,與對照組相比,側腦室注射NKB組的GnRH的mRNA表達水平顯著升高(P<0.05),Kiss1mRNA水平顯著降低(P<0.05)。
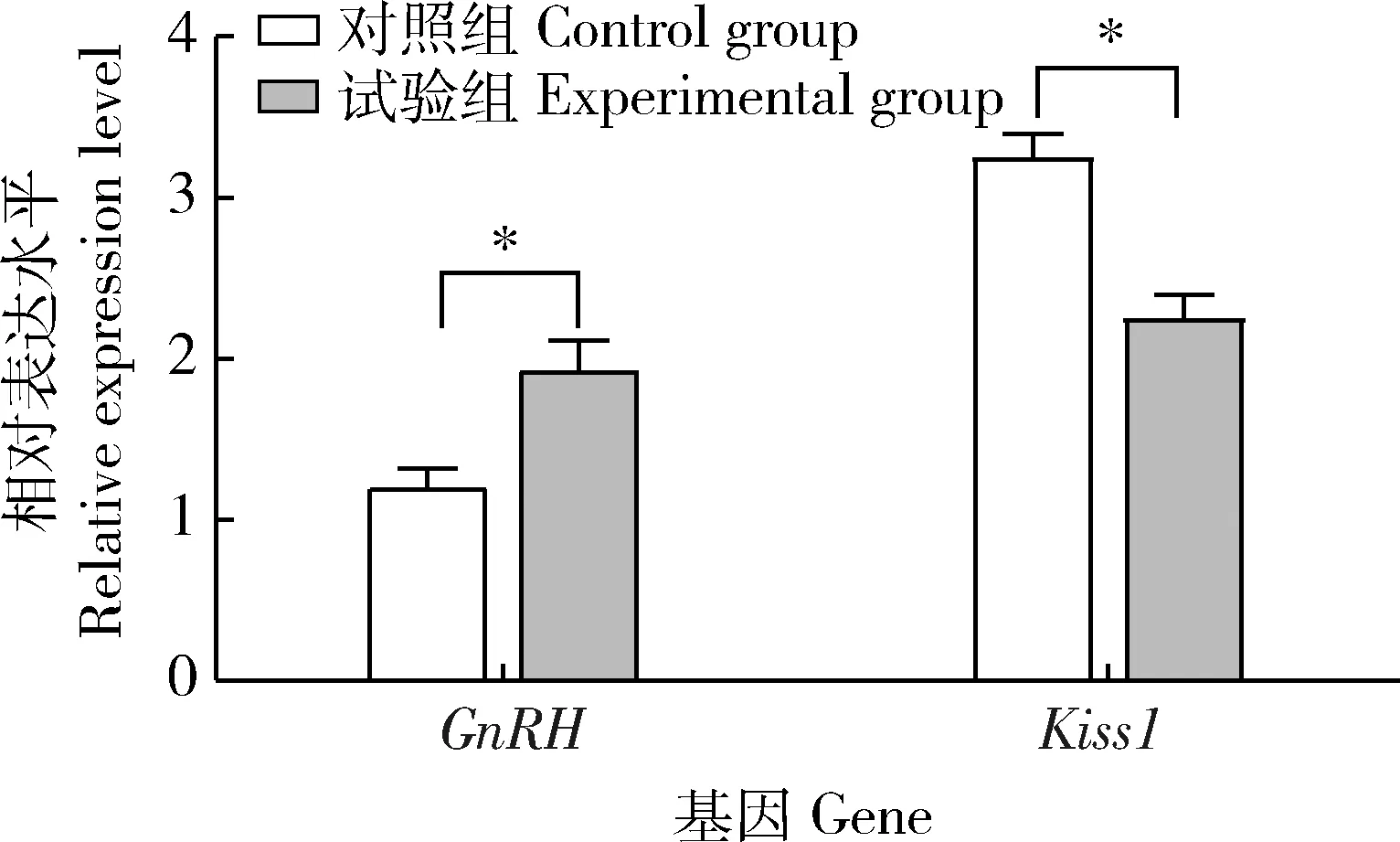
*表示顯著差異(P<0.05)。下同。* indicate significant differences (P<0.05). The same as below.圖1 NKB對大鼠下丘腦GnRH和Kiss1 mRNA轉錄水平的影響Fig.1 Effect of NKB on GnRH and Kiss1 mRNA transcription level in rat hypothalamus
2.2 NKB對大鼠下丘腦GnRH和Kisspeptin分布的影響
試驗組中,GnRH在ARC、POA、ME和室旁核(Paraventricular nucleus,PVN)存在不同強度的免疫熒光表達,其中在ARC處呈現密集的廣泛分布的強熒光表達,而在POA、ME和PVN處為分散的點狀較弱熒光;Kisspeptin在ARC、POA、ME和前腹側室旁核(Anterior ventral paraventricular nucleus,AVPV)有不同強度的免疫熒光表達,其中在ARC、ME和AVPV處為廣泛而密集的強熒光表達,而在POA處為稀疏的較弱熒光(圖2(a));對照組中,GnRH僅在ARC和ME中存在廣泛分布的強熒光表達,Kisspeptin在ARC和AVPV中存在免疫熒光表達(圖2(b))。對下丘腦不同核團中的GnRH和Kisspeptin陽性細胞數進行統計(圖3和圖4),與對照組相比,試驗組中GnRH陽性細胞數量在ARC,POA和ME中增加,但僅在POA核團中呈現顯著增加(P<0.05)(圖3)。但試驗組的Kisspeptin陽性細胞數在ARC、PVN、AVPV和POA中均顯著低于對照組(P<0.05)(圖4)。
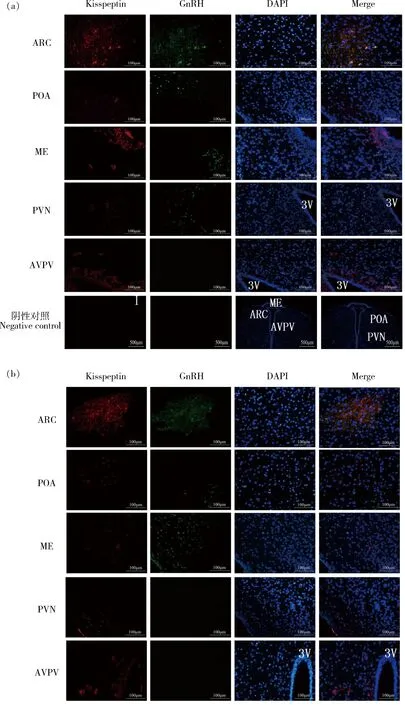
ARC:弓狀核; POA:視前區; ME:正中隆起;PVN:室旁核;AVPV:前腹側室旁核;陰性對照:用PBS代替鼠GnRH單克隆抗體或兔抗大鼠Kisspeptin初級多克隆抗體;3V:第三腦室。ARC:Arcuate nucleus; POA: Preoptic area; ME: Median eminence; PVN: Paraventricular nucleus; AVPV: Anterior ventral paraventricular nucleus; Negative control; PBS instead of GnRH MAb; 3V: The third ventricle。圖2 NKB對試驗組(a)和對照組(b)大鼠下丘腦GnRH和Kisspeptin分布的影響Fig.2 Effects of NKB on the distribution of GnRH and Kisspeptin in rat hypothalamus for experimental and control group
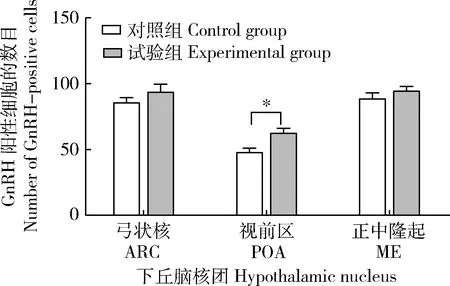
圖3 NKB 對大鼠下丘腦弓狀核(ARC),視前區(POA)和正中隆起(ME)GnRH陽性細胞數的影響Fig.3 The effect of NKB on the number of GnRH-positive cells in the arcuate nucleus (ARC), preoptic area (POA) and median eminence (ME) of hypothalamus in rats
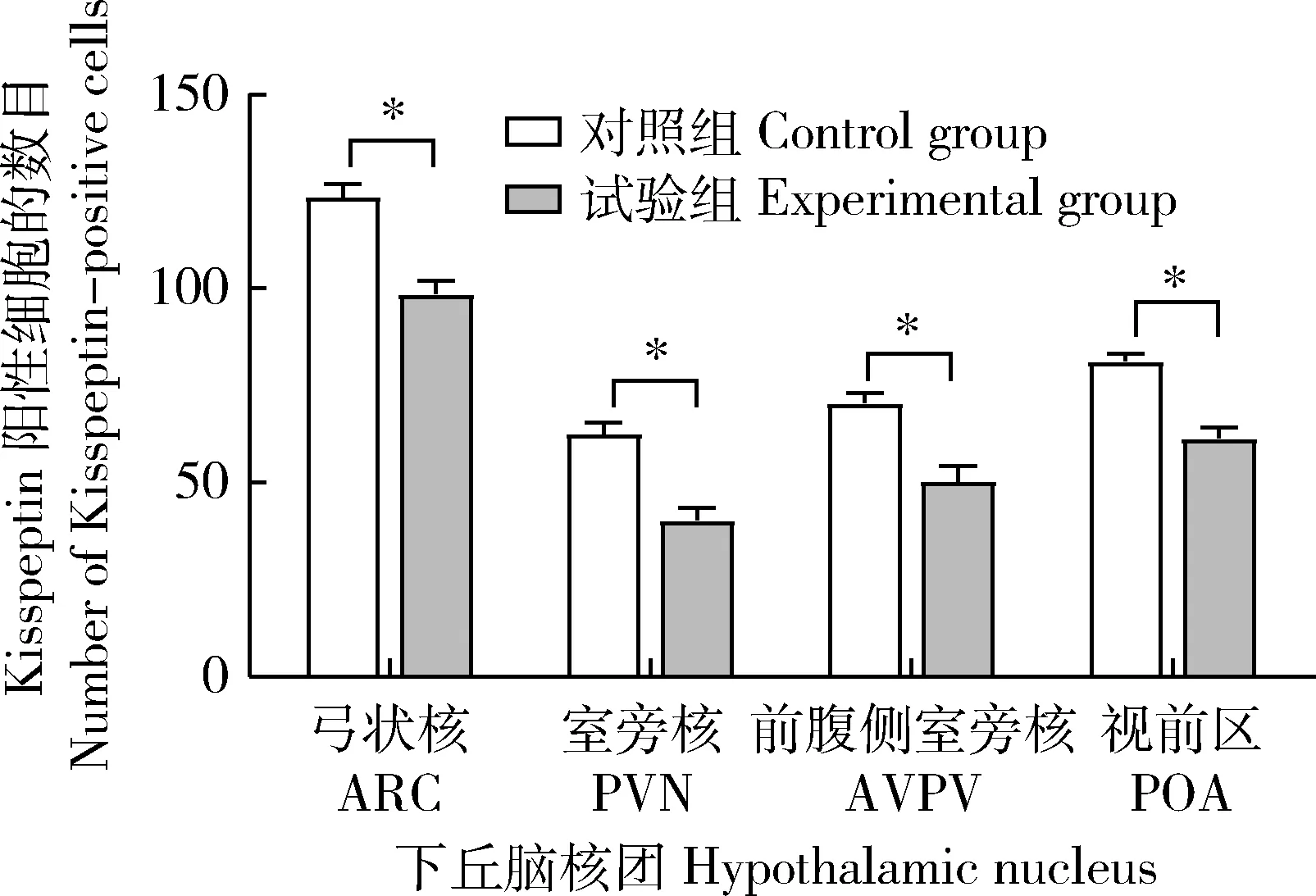
圖4 NKB對大鼠下丘腦弓狀核(ARC),室旁核(PVN),前腹側室旁核(AVPV)和視前區(POA)Kisspeptin陽性細胞數的影響Fig.4 The effect of NKB on the number of Kisspeptin-positive cells in the arcuate nucleus (ARC),paraventricular nucleus (PVN), anterior ventral paraventricular nucleus (AVPV) and preoptic area (POA) of hypothalamus in rats
2.3 NKB對大鼠垂體和卵巢Kisspeptin分布的影響
Kisspeptin主要分布在成年雌性大鼠的腺垂體(圖5),且試驗組Kisspeptin平均熒光強度顯著低于對照組(P<0.05)(表2);在成年大鼠的卵巢上也存在有Kisspeptin的熒光表達(圖6),主要分布于卵巢間質和卵泡膜細胞上,但2組之間沒有顯著性的差異(P>0.05)。
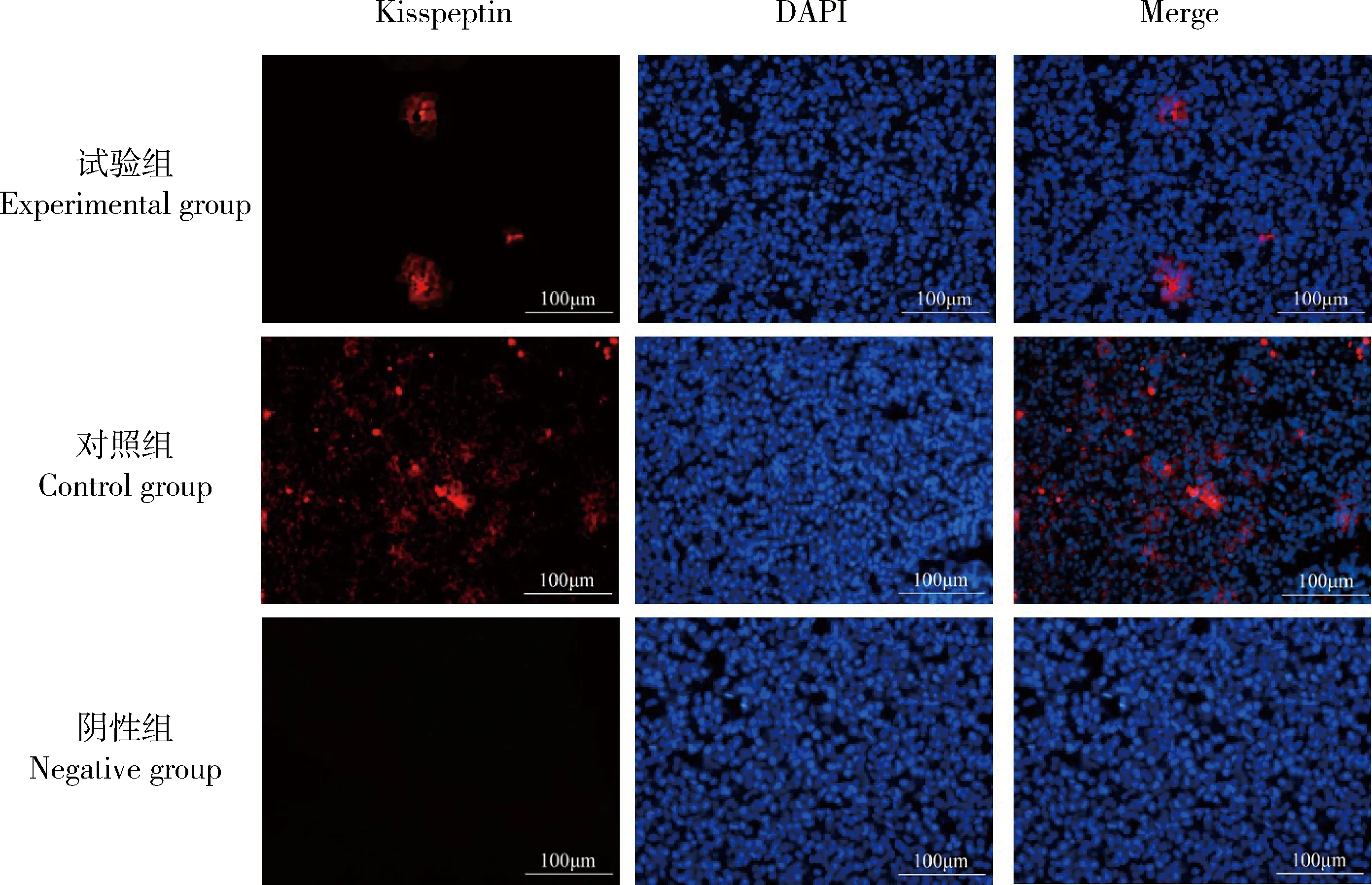
圖5 NKB對大鼠腺垂體Kisspeptin分布的影響Fig.5 Effect of NKB on Kisspeptin distribution in rat adenohypophysis
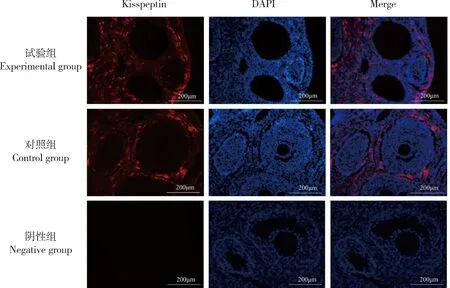
圖6 NKB對大鼠卵巢Kisspeptin分布的影響Fig.6 Effect of NKB on the distribution of Kisspeptin in rat ovary

表2 NKB對大鼠垂體和卵巢上Kisspeptin表達的平均熒光強度的影響Table 2 The effect of NKB on the mean fluorescence intensity of Kisspeptin in the pituitary and ovary of rats
3 討 論
中樞神經通過下丘腦-垂體-性腺軸實現對性腺的調控,生殖軸的信息傳遞路線即GnRH神經元接受其上游機制的調控后,脈沖性釋放GnRH,其作用于垂體,調節促性腺激素的釋放,促性腺激素又作用于性腺,調節生殖功能及性激素的分泌[10]。下丘腦是動物中樞神經系統中的重要器官,可以維持正常代謝并調控動物的生殖活動。下丘腦GnRH的脈沖式分泌是HPG軸功能正常啟動和維持的關鍵[9]。近年來,研究者對NKB、Kisspeptin及其受體在人、獼猴、豬、大小鼠等多種動物下丘腦定位分布已做了大量的研究。目前大多數研究者認為 NKB 和 Kisspeptin 主要共表達于弓狀核[12]。本研究免疫熒光結果顯示,Kisspeptin在ARC、PVN、AVPV和POA中均有不同強度的熒光表達,且與對照組相比,試驗組ARC、PVN、AVPV及POA中Kisspeptin陽性細胞數顯著降低。這與不同生理時期大鼠體內下丘腦Kisspeptin免疫熒光分布表達結果相似[13]。前期研究表明,給雄鼠同時注射NKB和Kisspeptin,其LH分泌量高于單獨注射Kisspeptin[14],另外研究者在動物和人類中均發現,NKB 神經元同時表達Kisspeptin和強啡肽(Dynorphin,Dyn)神經元,而弓狀核的 Kiss-1、Tac2能夠增加 LH 的分泌,表明NKB可以增強Kisspeptin在生殖發育的促進作用。小鼠[15]和山羊[16]側腦室注射NKB激動劑后Kiss1mRNA表達量和LH脈沖釋放增加,提示TAC3可能為Kiss1的上游基因,通過直接或間接作用調控Kisspeptin神經元從而調控生殖功能。本研究中,試驗組大鼠下丘腦的Kiss1 mRNA表達量與對照組相比顯著降低,該結果與小鼠[15]和山羊[16]側腦室內注射NKB激動劑后Kiss1mRNA表達量增加不一致,表明不同物種可能會對NKB對Kiss1的表達產生影響。與對照組相比,試驗組GnRHmRNA的轉錄水平增加,Kiss1mRNA轉錄水平卻顯著降低,該結果與注射Kisspeptin促進GnRH的結論[17]相反。對于這種差異,可能的原因:一是可能與樣品來源有關,因為GnRH與Kisspeptin在下丘腦不同核團分布不同,本試驗中樣品為整個下丘腦,并非下丘腦某個核團,導致GnRH與Kisspeptin的表達不一致;二是因為Kisspeptin是GnRH上游調控因子[18],其基因轉錄水平未必同時增加,可能Kisspeptin增加在GnRH之前;三是NKB還可能直接或者間接通過其他通路如Dyn等影響GnRH釋放,ARC中的單個細胞群(在綿羊中)產生3種神經肽:Kisspeptin,Dyn和NKB,并且這3 種神經肽都與GnRH分泌相關[19]。因此,NKB調節Kisspeptin和GnRH的確切機制仍需進一步探究。
垂體包括神經垂體和腺垂體,其中腺垂體是內分泌系統的重要調控樞紐,受下丘腦釋放激素和靶腺激素的雙重調節[20]。本研究表明,外源性給予NKB可使腺垂體中Kisspeptin高表達。這與在雌性恒河猴垂體上Kisspeptin的定位研究結果一致,即Kisspeptin主要存在于雌性恒河猴的垂體前葉及中葉[7]。本研究中側腦室注射NKB導致腺垂體Kisspeptin表達的變化,可能是通過影響下丘腦GnRH和Kisspeptin的表達來實現的。有研究表明下丘腦ARC上的NKB通過傳出神經元進入垂體門脈循環影響垂體前葉LH和FSH釋放[21-22]。Billings等[23]在母羊上發現NKB受體激動劑可以促進LH分泌,且Navarro等[11]研究發現NKB受體激動劑對雌性大鼠LH分泌有持續性的興奮作用。也有研究表明NKB通過腦垂體的GH3細胞系促進催乳素的分泌[24]。提示NKB可以通過腺垂體參與生殖軸的調控作用,也可以直接作用于腦垂體,影響促性腺激素的分泌,進而調控生殖。
雌性動物卵巢的功能受下丘腦腺垂體系統的調節。本試驗側腦室注射NKB,不僅影響了大鼠下丘腦和垂體Kisspeptin的表達,還發現試驗組卵巢的卵泡膜、顆粒細胞和間質細胞Kisspeptin的熒光強度高于對照組。該結果與性腺切除小鼠側腦室注射NKB激動劑后Kiss1mRNA表達增加相似[25-26],即NKB增加Kiss1的含量進而促進Kisspeptin的表達。已有的研究表明雌性大鼠卵巢上具有Kisspeptin分布,并且在排卵前Kiss1 mRNA的表達增加,表明Kisspeptin可能參與卵泡形成、黃體生成和排卵的過程[27]。Patterson等[28]發現先天性促性腺激素缺乏癥(Isolated hypogonatropic hypogoadism,IHH)患者都存在GPR54 基因的突變,發現給GPR54基因缺陷的動物模型注射GnRH后可以緩解停滯的性成熟癥狀,由此認為啟動初情期的關鍵因子之一是GPR54,Kisspeptin-GPR54 系統在青春期發育過程中發揮著重要的作用。Seminara等[29]發現,在未成熟雌性小鼠腦室內長期注入 Kisspeptin 可引起生殖軸的提前發育,如陰門的提前開放、卵巢和子宮重量增加,這可能是由于它的內源性受體GPR54信號與GnRH所釋放的激活信號偶聯的緣故,而Kisspeptin很有可能是通過激活GnRH來實現對生殖軸的調節作用。本試驗中也可能是NKB直接調節下丘腦GnRH和Kisspeptin,進而影響垂體的分泌來調控卵巢的功能。已知雄激素由卵泡膜細胞和間質細胞合成,并通過卵泡細胞或顆粒細胞最終轉化為雌激素,與此同時顆粒細胞還可以產生孕酮[30],提示NKB可能通過顆粒細胞、卵泡膜細胞和間質細胞調控性激素分泌,從而對生殖軸產生作用,調控雌性大鼠的生殖活動。

