NTPHGPX基因過表達和敲除對煙草苗期耐鹽性的影響
郭鵬誠 楊曉 毛輝 王學波 申展 劉旦 楊愛國 王元英

摘要:為研究NIPHGPX基因對煙草耐鹽性的影響,通過轉基因技術獲得VIPHGPR基因過表達和CRISPR/Cast9敲除材料,利用150mmol/LNACI對轉基因材料處理14d,研究鹽處理下轉基因材料根長、GPx酶活性、丙二醛(MDA)和過氧化氫(H2O2)含量的變化。結果表明,NIPHGPX基因表達在鹽脅迫3h后即受到誘導;鹽處理顯著抑制了野生型煙草根部的生長,提高了丙二醛和過氧化氫的積累;鹽脅迫下過表達株系的根長比野生型更長,MDA和HO2含量較低,而基因敲除材料根的生長則進一步受到抑制,GPx酶活性明顯降低,地上部MDA和H2O2的積累顯著高于野生型。綜上所述,過表達NIPEGPX基因提高了煙草的耐鹽性,而敲除NIPHGPX3基因則減弱了煙草的耐鹽性,推測NIPHGPX基因可能通過影響煙草體內活性氧物質的清除活性參與植株對鹽害的脅迫響應。
關鍵詞:磷脂氫谷胱甘肽過氧化物酶;耐鹽性;基因功能;煙草
鹽害是影響植物生長發育和產量的重要非生物脅迫叫,尋找植物耐鹽基因能夠幫我們了解植物耐鹽機理,為耐鹽種質資源的發掘提供參考,也為培育優質耐鹽品種或改良優良品種的耐鹽性提供依據。鹽脅迫可以改變土壤滲透勢導致植物吸水困難,過量的鹽離子還會對植物產生離子毒害,使植物無法維持體內離子平衡2。鹽脅迫對細胞膜破壞巨大,高濃度的Na*和C會影響植物對Ca2+的吸收,細胞膜上的Ca2被Na取代,使細胞膜的選擇透過性變差,營養物質外泄,膜脂過氧化程度提高,有害物質積累,植物生長發育受損。鹽脅迫使烤煙葉片葉綠體和線粒體嚴重受損,細胞核液濃度下降,核內異染色質化明顯,影響烤煙品質,與鹽脅迫類似的干旱脅迫造成烤煙葉片活性氧含量增加,葉綠體受到破壞,光合速率降低,植物生長發育受到抑制。
除滲透脅迫外,鹽害還會造成活性氧物質(ROS)在體內的積累,對植物產生氧化脅迫。低濃度的ROS作為信號分子調控脅迫相關基因的表達,但高濃度的ROS會破壞細胞結構。植物受到氧化脅迫后迅速積累多種抗氧化酶來清除ROS,包括谷胱甘肽過氧化物酶(GPx)、超氧化物歧化酶SOD)、過氧化氫酶(CA)、谷胱甘肽還原酶(GR)及抗壞血酸過氧化物酶(APX)等01。茄科植物中GPx研究較少,DEPEGE等發現機摩擦能誘導番茄GPx的表達,并參與ROS的清除,而ALEIARBY等發現鹽處理抑制了番茄中GPx的mRNA水平。
相比其他GPx家族成員,PHGPX能特異性清除膜上的磷脂氫過氧化物,對于維持細胞膜的穩態具有重要意義1611。楊曉東等對蘿卜磷脂氫谷甘肽過氧化物酶基因(RSPHGPX)進行研究,發現其上游調控序列含有多個響應激素、脅迫、光信號的元件,RNA印跡分析發現RSPHGPX受到脫落酸、連續光照和冷脅迫的調控。劉賽等2克隆了茶樹中的CSGPXL基因,其具有PEGPX特有的結構域,過表達CSGPX1使煙草抗旱性得到提升。HERBETTE等2在番茄中過表達家鼠的GPx5基因類似于植物中的PHGPX)發現轉基因番茄更能抵抗機械損傷的影響,但易受到生物脅迫。CHEN等2在煙草葉片中瞬時表達番茄LEPHGPX,發現LEPHGPX可保護煙草葉片免于氧化脅迫和凋亡因子Bax引起的細胞凋亡。
目前有關煙草NTPHGPX的基因功能還鮮有報道。本研究發現在鹽處理下NTPHGPR的表達急劇上升,推測NTPHIGPX能夠參與煙草抵御鹽脅迫的過程,進一步將該基因從煙草中克隆,利用基因過表達及敲除株系研究其在煙草抵抗鹽脅迫響應中的作用,為解析NTPHGPX參與煙草響應鹽脅迫的分子機制提供科學數據。
1材料與方法
1.1供試材料和處理
試驗于2020年在山東青島中國農業科學院煙草研究所進行,試驗材料為煙草品種凈葉黃,由中國煙草種質資源庫提供。為了研究NTPEGPX是否受到鹽脅迫的誘導,將煙草種子播于營養土,待苗長至4片真葉時,洗去根部雜土,置于150mmol/LNaC溶液處理0、1、3、6、12和24h,取幼苗真葉的最上部完全展開葉用于分析NTPHGPX基因在鹽脅迫下的表達模式,每個處理取3次重復,每個重復取3棵煙株混樣,液氮研磨提取RNA。正常條件下生長至4片真葉時,分別取煙草根、莖、葉等部位的組織,每個處理取3次重復,每個重復取3棵煙株混樣,液氮研磨提取RNA,用于分析NTPHGPR基因表達的組織特異性。煙草植株在25℃、光周期為16h光照8h黑暗的培養室中進行培養。
為了研究轉基因材料耐鹽性是否發生改變,將煙草種子經消毒后播于MS培養基,瓊脂濃度08%,發芽后選取生長一致的幼苗分為兩組,一組移至MS培養基中,另一組移至含有150mmo/LNACI的MS培養基,生長14d后測量根長,每個處理4次重復,取地上部分用于測定GPx酶活性、MDA和H2O2含量等生理生化指標,每個處理3次重復。
1.2NTPEGPX基因克隆、載體構建及轉基因材料的獲得
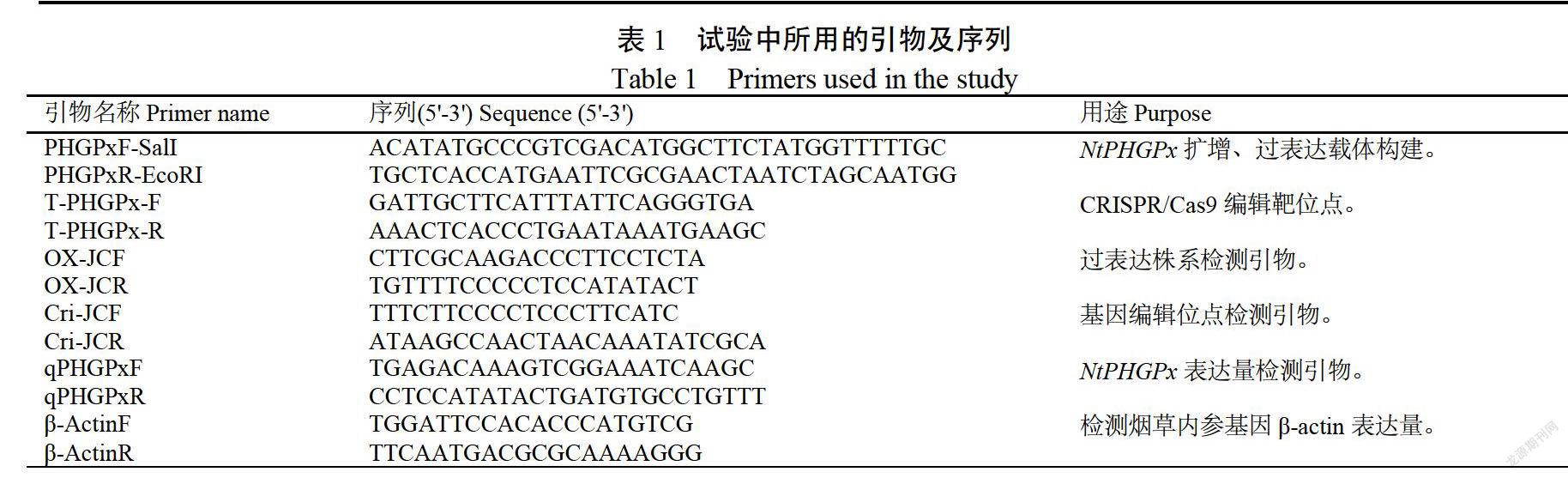
參考茄科基因組網站(https://solgenomics.net上收錄的煙草品種K326基因組信息,從K326的DNA中分離克隆磷脂氫谷胱甘肽過氧化物酶(序列號:mRNA_136682),命名為NtPHGPX,利用ln-FusionHDCloningKit(Takara公司)將克隆到的基因連接于用ECORI和SalI雙酶切后的表達載體PRI-eGFP,參照XING等2的方法,使用載體pKSE401構建NTPHGPX基因敲除載體,將T-PHGPX-F和T-PHGPX-R稀釋成50umol/L,加入5×DNA寡核苷酸退火緩沖液(碧云天生物技術公司)退火形成雙鏈DNA,使用BsaI(NEB公司單酶切pKSE401載體,回收酶切產物,利用T4連接酶將靶位點連接到酶切后的pKSE401載體上。將構建好的載體轉化至大腸桿菌DH5,陽性克隆進行菌落PCR及測序驗證,提取質粒采用熱激法轉化農杄菌感受態細胞EHA105。采用葉盤法轉化凈葉黃品種,獲得過表達T2代株系及基因敲除位點純合突變體。在靶位點上下游設計引物,PCR擴增靶位點附近序列,將序列與野生型進行比對,靶位點比對無差異說明未編輯,靶位點是雙峰說明是編輯雜合狀態,靶位點純合且有差異表明成功編輯且編輯位點純合。本試驗所采用的引物見表1。
1.3構建系統進化樹
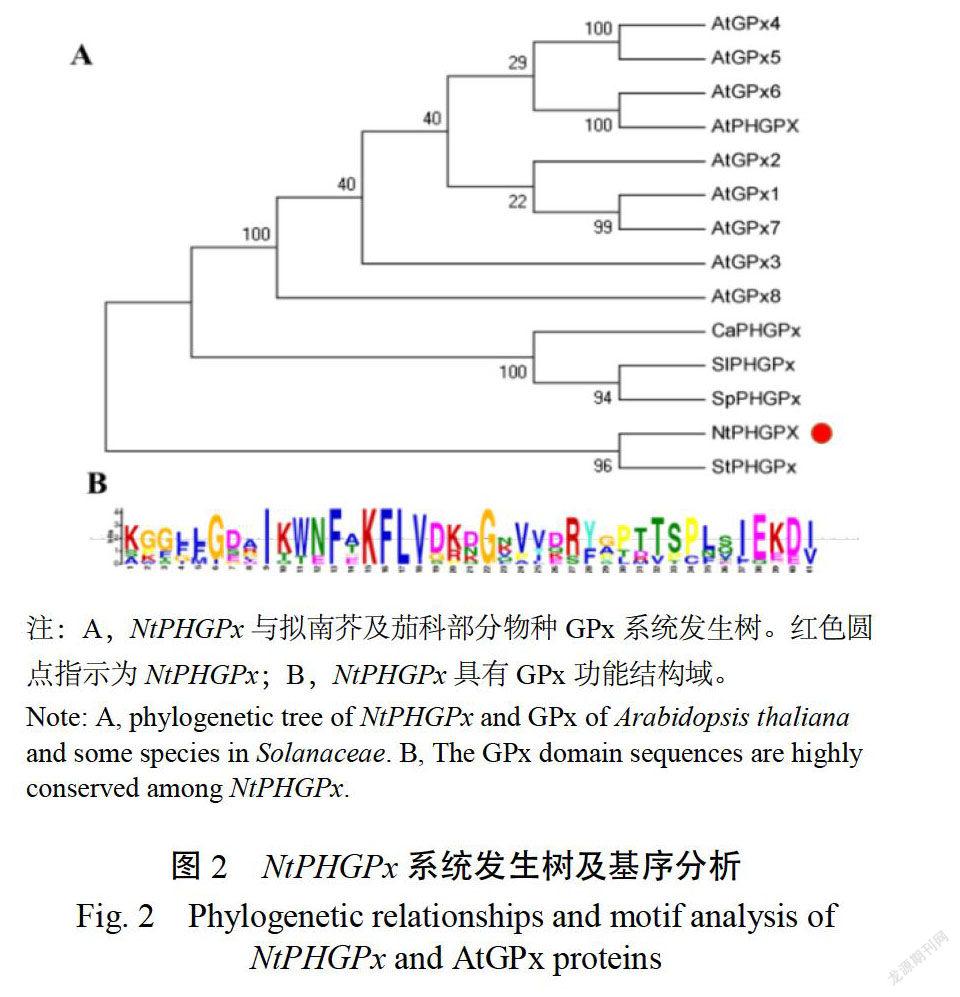
在美國國家信息中心(National Center for BiotechnologyInformation,NCBI)數據庫進行BLAST檢索,下載擬南芥(arabidopsis thaliana)中已知的GPx蛋白序列,分別為ATGPX1(NP180080.1)、ATGPX2(NP_194915.2)、ATGPX3(NP001189742.1)、ATGPX4(NP_566128.1)ATGPX5(NP191867.1)、ATGPX6(NP192897.2)、ATGPX7(NP_194915.2)、ATGPX8(NP564813.1)、ATPEGPX(OAO9876),馬鈴薯(Solanum tuberosum)中STPHGPX(XP0151687441)栽培番茄(Solanumlycopersicon)中SIPEGPX(XP_004245287.1)、野生番茄(Solanum pennellii)中SPPHGPX(XP_0150846271)、辣椒(Capsicum annuum)中CAPIGPX(XP_016554525.1);使用MEGA5.0軟件對蛋白序列進行多序列比對,并用鄰接法(Neighbor-joining method)構建系統進化樹。
1.4實時熒光定量PCR
取100mg樣品,加入液氮研磨勻漿,使用Trizol法提取植物RNA,用Hiscriptr II Q RT SupermixforQPCR(諾唯贊)反轉錄獲得cDNA。使用Lightcycle96型熒光定量PCR儀(Roche公司)進行qRT-PCR,配置20L反應體系,其中2Chamq SYBRColor QPCR MasterMix(諾唯贊)10uL、dIHO7.2uL,cDNA2uL、上游引物(10 umoL)和下游引物(10 umol/L)分別0.4uL,NIPHGPR基因表達量檢測引物和煙草內參基因p-actin檢測引物序列見表1PCR反應程序為:95℃30s;95℃10s,60℃30s,40個循環;95℃10,65℃60s,97℃1s。每個反應3次重復。通過實時熒光定量PCR分析不同組織、鹽脅迫下以及過表達株系葉片中NTPHGPX基因的轉錄水平。
1.5生理生化指標測定
使用丙二醛(MDA)測試盒、過氧化氫(H2O2)測試盒、谷胱甘肽過氧化物酶(GPx)測試盒(蘇州科銘生物技術有限公司),按照說明書進行測定。采用硫代巴比妥酸比色法測定樣品丙二醛含量2,采用硫酸鈦比色法測定過氧化氫含量。GPx酶活性通過比色法測定NADPE的減少量確定。
1.6數據分析
使用SPSS21.0進行數據的顯著性分析,采用LSD法進行多重比較,采用5%的統計檢驗標準使用GraphpadPrism8.0繪制圖表。
2結果
2.1NTPHIGPX基因克隆和進化樹分析
參考茄科基因組網站上序列信息設計引物,從煙草品種K326的cDNA中進行克隆,電泳結果(圖1)顯示克隆出的片段大小約為585bp,與預期結果一致。序列比對結果表明,該序列與參考序列完全一致,將其命名為NTPHGPX。該片段編碼195個氨基酸,推測蛋白質分子量21.7kDa,等電點位971。系統發生樹和序列分析結果表明,VTPHGPR中含有GPx家族的保守結構域,其與馬鈴薯中預測為PHGPX蛋白的序列親緣關系最近,其次為番茄中PHGPX,但與擬南芥中已知的GPx蛋白和PHGPX蛋白親緣關系較遠,并非同源基因(圖2A,B)。
2.2NTPHIGPX基因受到鹽脅迫誘導
圖3A結果表明,NTPHIGPX基因在根莖葉中都有表達,且在葉中表達量顯著高于根和莖中,表達量分別為后兩者的1.66倍和1.74倍。圖3B結果表明,NtPEGPX基因表達量明顯受到NaC溶液處理的誘導,在處理3h后其表達量比處理前升高了120.01%;而鹽處理24h后,其表達量則大幅升高了4倍左右。該試驗結果表明NTPHIGPR基因可能在煙草對鹽脅迫響應中發揮作用。
2.3NIPHGPX過表達促進煙草在鹽脅迫下根的生長
利用NTPEIGPX過表達T2代株系OX-1
(Overexpression line1),OX-2(overexpression line2)及基因敲除純合株系Ci進行表型鑒定。兩個過表達株系OX-1、OX-2的表達量分別為野生型的7.21倍和5.52倍(圖4A)。對CRISPR/Cas9系統編輯材料的突變位點進行PCR擴增,結果顯示基因敲除純合株系Ci在靶位點插入一個堿基G,造成編碼氨基酸發生移碼,導致肽鏈提前終止(圖4B)。
將野生型及轉基因材料分別在正常條件和NaCl脅迫下處理(圖4C,D),在不加NaC的MS培養基上,野生型煙草、過表達株系OX-1、OX-2、基因敲除株系Cri之間根長無顯著差異;在含有150mmol/LNacl的MS培養基上,野生型煙草根的生長受到明顯抑制,比正常條件下的野生型植株根長減少28.16%,而兩個過表達株系根的生長未受到抑制;基因敲除株系Ci在NaCl脅迫下根長更短,相比正常MS培養基上的C株系減少了46.00%。上述結果表明,過表達NTPEGPX能夠增強煙草對鹽脅迫的耐性。
2.4NTPHGPX過表達對鹽脅迫下煙草葉片中GPx酶活性、H2O2和MDA的影響
圖5結果顯示,正常條件下,野生型與轉基因材料葉片中GPx酶活性無顯著差異,NaC處理誘導野生型植株葉片中GP酶活性顯著提高,酶活性比正常條件下升高約69.68%;NaC處理同樣導致過表達和基因敲除株系中GPx酶活性升高,但在基因敲除株系C中,GPx酶活性升高的幅度較低,顯著低于野生型WT和過表達株系OX-2。
正常條件下,野生型與轉基因材料體內H2O2含量無顯著差異,而鹽脅迫下野生型植株葉片內H2O2含量大幅增加了70.74%,過表達材料葉片內H2O2含量也表現為上升的趨勢,但HO2含量顯著低于野生型對照,并與正常條件下野生型沒有顯著差異,這表明過表達NTPHIGPX基因對清除鹽脅迫下H2O2的積累具有一定的作用;基因敲除株系Cri中H2O2積累顯著高于其他材料,相比正常條件下的增加了114.139%(圖6A)。正常條件下,野生型與過表達材料間MDA含量差異不顯著,但基因敲除株系Cn的MDA含量顯著高于野生型。鹽脅迫下,野生型植株葉片內MDA含量明顯上升,增幅16.20%;過表達材料MDA含量無明顯上升,而基因敲除材料MDA含量增幅較大,加了19、54%,且MDA含量顯著高于野生型和過表達材料(圖6B)。試驗結果表明,在鹽脅迫下煙草需要NTPHGPX基因清除過氧化物,維持細胞膜的氧化還原平衡。
3討論
磷脂氫谷胱甘肽過氧化物酶(PHGPX)是生物體內一種重要的抗氧化酶,在動植物中均有存在。研究表明PHGPX能特異性地還原氧化的磷脂和脂肪酸,而磷脂是細胞膜的重要組成成分,因此PIGPX對修復細胞膜的氧化損傷具有重要作用2。本研究克隆了一個煙草中的NtPHGPX基因,發現其具有GPx家族的保守結構域,系統進化分析發現其與茄科代表作物馬鈴薯、番茄等中的PIGPX親緣關系較近,而與擬南芥中已知的GPx家族關系較遠(圖2),表明NTPHGPR可能是擬南芥中所不具有的一類GPx基因,其功能值得進一步研究。有研究表明植物中PHGPX表達量受到多種脅迫反應誘導。WANG等28發現在鹽生植物鹽爪爪(Kalidium foliatum)中PHGPX基因在不同濃度NaCl處理后表達水平顯著增加;LI等2從水稻中分離到一個PHGPX基因,在H1O2和A處理后表達明顯提高;SUGMOTO等在擬南芥中克隆到個可能的PEGPX基因,在NaC和AFe處理后表達量同樣受到誘導。與上述研究結果一致,本研究發現在煙草中NTPHGPX在鹽脅迫的誘導下表達量明顯提高(圖3B),說明PHGPX可能參與植物對不同逆境脅迫的響應。進一步研究表明,過表達NTPHGPR能夠促進煙草幼苗在鹽脅迫培養基上根的生長,而NTPHGPX敲除株系根的生長則對鹽脅迫更敏感(圖4C,D),這暗示了NTPHGPR可能在煙草抵御鹽脅迫中起正向調控作用。
植物在遭受逆境脅迫時往往會產生大量的活性氧物質,過量的活性氧會破壞膜結構穩定性和完整性,對細胞造成損害。植物能夠通過包括GPx在內的多種酶促反應系統清除體內過量的活性氧,維持細胞內的氧化還原穩態。作為GPx家族成員,PHGPX對逆境脅迫的影響可能與其活性氧物質清除能力相關。本研究中總GPx酶活性在過表達株系與野生型材料中均受到鹽脅迫的顯著誘導,但二者之間沒有顯著性差異(圖5),這可能是由于煙草體內含有多種GPx同工酶,過表達一種VTPHGPX對煙草體內GPx酶總活性的影響有限。更為重要的是鹽脅迫下敲除株系中GPx酶活性顯著低于野生型,與之相對應的,鹽脅迫處理下NTPHIGPX基因敲除株系中H2O2和MDA的含量則顯著高于野生型(圖6)。與本研究結果類似,胡楊中PEGPX基因過表達后在鹽脅迫培養基上也表現為根長更長且GPx酶活顯著高于野生型,這表明NTPHGPX在鹽脅迫下植物清除活性氧物質的過程中起到重要的作用。與此同時,還有研究表明水稻中OSPHGPR過表達可提高水稻抵御百草枯氧化傷害的能力3,茶樹中CSGPX1(屬于PHGPX)基因的過表達可提高體內GPx酶活性,從而增加茶樹的耐旱性2,而原核表達蘿卜RSPHGPX和谷胱甘肽共同作用可以減少小鼠NH3T3細胞氧化損傷3,這些研究表明PHGPX可能與植物抵御鹽害、干旱、除草劑等逆境引起的氧化脅迫均有關,但其參與的鹽脅迫響應途徑是如何被上游基因調控等科學問題仍需更加深入的研究。
4結論
本研究首次從煙草中克隆了一個磷脂氫谷胱甘肽過氧化物酶基因NTPEGPX,發現其表達受鹽脅迫誘導。在鹽脅迫下,煙草NTPEGPX過表達株系根長顯著長于野生型,MDA和H2O2積累較野生型低;而敲除株系根長顯著短于野生型,MDA和H2O積累較野生型顯著升高。研究結果表明,NIPEGPX可能通過清除活性氧積累造成的過量脂質過氧化物,從而維持植物體內膜的氧化還原平衡,進而增強煙草的耐鹽性。本研究初步揭示了NTPHGPX的耐鹽功能,為培育和改良優質高產耐鹽煙草新品種提供一定理論基礎,但其參與的鹽脅迫響應途徑是如何被上游基因調控等仍需更加深入的研究。
參考文獻
[1] GUAN C, LI X, TIAN D, et al. Adp-ribosylation factors improve biomass yield and salinity tolerance in transgenic switchgrass (Panicum virgatum L.)[J]. Plant Cell Reports, 2020, 39(12)1623-1638
[2]王佺珍,劉情,高婭妮,等植物對鹽堿脅迫的響應機制究進展生態學報,2017,37(16):5565-57
[3] PARIDA A K, DAS A B. Salt tolerance and salinity effects on plants a review[J]. Ecotoxicology and Environmental Safety, 2005, 60(3)324-349
[4] CHEN D, YIN L, DENG X, et al. Silicon increases salt tolerance b influencing the two-phase growth response to salinity in wheat (Triticum aestivum L.)[J]. Acta Physiologiae Plantarum, 2014, 36(9)2531-2535
[5]楊莎,侯林琳,郭峰,等.鹽脅迫下外源Ca2對花生生長發育、生理及產量的影響應用生態學報,2017,28(3):894-900
[6]曹巖坡,代鵬,戴素英.鹽脅迫對蘆筍幼苗生長和體內Na,K,Ca2+分布的影響.西南大學學報(自然科學版),2014,36(10):31-36.
[7]王程棟,王樹聲,胡慶輝,等NaC脅迫對烤煙葉肉細胞超結構的影響中國煙草科學,2012,33(2):57-61
[8]王發展,金伊楠,李子瑋,等.干旱脅迫下外源ALA對烤煙幼苗光合特性和抗氧化能力的影啊.中國煙草科學,2020,41(1)
[9] MILLER G, SUZUKI N, CIFTCI-YILMAZ S, et al. Reactive oxygen species homeostasis and signalling during drought and salinity stresses [J]. Plant Cell and Environment, 2010, 33(4): 453-467
[10] ARBONA V, MANZI M, de OLLAS C, et al. Metabolomics as a too to investigate abiotic stress tolerance in plants. International Journal of Molecular Sciences, 2013, 14(3): 4885-4911
[11] GONG B, WEN D, VANDENLANGENHERG K, et al. Comparative effects of Nacl and NAHCO3 stress on photosynthetic parameters nutrient metabolism, and the antioxidant system in tomato leaves Scientia Horticulturae. 2013. 157: 1-12
[12]薛鑫,張,吳金霞.植物體內活性氧的研究及其在植物抗逆方面的應用.生物技術通報,2013(10):6-1
[13] AHANGER M A, TOMAR N S, TITTAL M, et al. Plant growth under water/salt stress: ROS production: antioxidants and significance of added potassium under such conditions [J]. Physiology and Molecular Biology of Plants, 2017, 23(4): 731-744
[14] DEPEGE N, VARENNE M, BOYER N Induction of oxidative stress and Gpx-like protein activation in tomato plants after mechanica stimulation [J]. Physiologia Plantarum, 2000, 110(2): 209-214
[15] ALHARBY H F, METWALI E M R FULLER M P, et al. The alteration of MRNA expression of SOD and GPX genes, and proteins in tomato(Lycopersicon esculent im Mill)under stress of NACI and/or Zno nanoparticles [J]. Saudi Journal of Biological Sciences, 201623(6):773-781
[16] AVERY A M, AVERY S V. Saccharomyces cerevisiae expresses three phospholipid hydroperoxide glutathione peroxidases [J]. Journal of Biological Chemistry, 2001, 276(36): 33730-33735
[17]李文君,劉進元,趙南明.苦瓜谷胱甘肽磷脂氫過氧化物酶CDNA
的克隆及其特征分析.生物化學與生物物理進展,2001(6)908-911
[18]雷明光,張舒,張冰,等.谷胱甘肽磷脂氫過氧化物酶研究進展生物學通報,2005(5)
[19]楊曉東,劉進元.蘿卜磷脂氫谷胱甘肽過氧化物酶基因結構及其調控序列分析(英文)生物化學與生物物理進展,2005(7)
649-656
[20]劉賽,劉碩謙,龍金花,等,茶樹谷胱甘肽過氧化物酶編碼基因CSGPXI功能分析.茶葉科學,2019,39(4):382-391
[21] HERBETTE S, de LABROUHE D T, DREVET J R, et al. Transgenic tomatoes showing higher glutathione peroxydase antioxidant activity are more resistant to an abiotic stress but more susceptible to biotic stresses [J]. Plant Science, 2011, 180(3): 548-553
[22] CHEN S R, VAGHCHHIPAWALA Z, LI W, et al. Tomato phospholipid hydroperoxide glutathione peroxidase inhibits cell death induced by Bax and oxidative stresses in yeast and plants[J]. Plant Physiology,2004,135(3):1630-1641
[23] XING H, DONG L, WANG Z, et al. A CRISPR/Cas9 toolkit for multiplex genome editing in plants [J]. BMC Plant Biology, 2014, 14
[24] CUSTODIO-MENDOZA JA, VALENTE IM, RAMOS R M, et al Analysis of free malondialdehyde in edible oils using gas-diffusion microextraction [J]. Journal of Food Composition and Analysis, 201982:103254
[25]劉小為,陳忠林,沈吉敏,等.硫酸鈦光度法測定OHO2體系中低濃度HO2中國給水排水,2010,26(16):126-129
[26]喬新榮,張繼英.植物谷胱甘肽過氧化物酶(GP)研究進展[J].生物技術通報,2016,32(9):7-13
[27] IMAI H, NAKAGAWA Y. Biological significance of phospholipid hydroperoxide glutathione peroxidase (PHGPX, GPX4)in mammalian cells JI. Free Radical Biology and Medicine, 2003, 34(2): 145-169
[28] WANG Z G, ZHANG PX, SHAO Y T, et al. Molecular cloning and the expression pattern of a phospholipid hydroperoxide glutathione peroxidase in Kalidium foliatum under Nacl treatment. Russian Journal of Plant Physiology, 2020, 67(4): 750-757
[29] LI W J, FENG H, FAN J H, et al. Molecular cloning and expression of a phospholipid hydroperoxide glutathione peroxidase homolog in Oryza sativa [J]. Biochim Biophys Acta, 2000, 1493(1): 225-230
[30] SUGIMOTO M, SAKAMOTO W. Putative phospholipid hydroperoxide glutathione peroxidase gene from Arabidopsis thaliana induced by oxidative stress [J]. Genes Genetic Systems, 1997, 72(5311-316
[31]烏鳳章.三個越橘品種對鹽脅迫的生長和生理響應及耐鹽性差異.植物生理學報,2019,55(1):1638-1646
[32] GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants. Plant Physiology and Biochemistry, 2010, 48(12): 909-930
[33]王非,丁明全,鄧澍榮,等.胡楊谷胱甘肽過氧化物酶PEGPX基因的克隆及轉化植株耐鹽性分析.基因組學與應用生物學2012,31(3):231-239
[34]宋建輝,李甜,吳秀云,等.OSPHGPX基因的過量表達增強水稻抗氧化能力.生物技術通報,2014(11):107-11
[35]劉冠蘭,李甜,劉進元,等,原核表達的蘿トPHGPX和谷甘肽對NIH3T3細胞氧化損傷的聯合保護作用.中國生物工程雜志,2010,30(9):13-18

