SLE繼發抗磷脂抗體綜合征合并Libman-Sacks心內膜炎一例
盧麗娟?黃勤
【摘要】臨床部分SLE患者可繼發抗磷脂抗體綜合征(APS),但同時合并非細菌性心內膜炎的患者則較為罕見。該文報道1例SLE繼發APS合并Libman-Sacks心內膜炎患者的診治過程。該患者入院前有發熱、關節痛、咽痛和皮疹,入院后UCG示二尖瓣前葉贅生物形成,查狼瘡抗體、抗磷脂抗體、狼瘡樣抗凝物試驗陽性,經抗感染治療后病情未緩解,后患者突發頭暈、口周麻木、構音不清、吞咽困難,查頭顱MRI見一新發的延髓梗死灶。結合患者臨床表現、體征及輔助檢查,診斷為APS,Libman-Sacks心內膜炎,延髓梗死,SLE。予免疫抑制、免疫調節、低分子肝素抗凝等治療后患者病情好轉出院。該例的診治提示,在UCG發現贅生物時,不僅要考慮感染性心內膜炎,同時需要考慮SLE繼發APS可能,尤其是對于既往無明確心瓣膜病病史的年輕女性,早期診斷APS合并Libman-Sacks心內膜炎,并給予個體化抗凝治療,可取得良好療效。
【關鍵詞】抗磷脂抗體綜合征;系統性紅斑狼瘡;Libman-Sacks心內膜炎;抗凝治療;
感染性心內膜炎;鑒別診斷
Antiphospholipid antibody syndrome secondary to SLE complicated with Libman-Sacks endocarditis: a case report Lu Lijuan, Huang Qin. Internal Medicine Training Base, Shenzhen Peoples Hospital, Shenzhen 518000, China
【Abstract】In clinical practice, partial patients with systemic lupus erythematosu (SLE) can develop secondary antiphospholipid antibody syndrome (APS), whereas simultaneous complication with non-bacterial endocarditis is rarely encountered. In this article, the diagnosis and treatment of one case of APS secondary to SLE complicated with Libman-Sacks endocarditis were reported. Prior to admission, the patient presented with fever, joint pain, sore throat and rash. UCG upon admission revealed the mass in the anterior leaflet of mitral valve. The patient was tested positive for lupus antibody, antiphospholipid antibody and lupus-like anticoagulant test. The symptoms were not alleviated after anti-infection therapy. Subsequently, the patient suffered from dizziness, numbness around the mouth, unclear articulation and dysphagia. Cranial MRI revealed a new medullary infarction lesion. Combined with clinical manifestations, physical signs and auxiliary examinations, the patient was diagnosed with APS, Libman-Sacks endocarditis, medullary infarction and SLE. After immunosuppression, immunomodulation and low-molecule heparin anticoagulation interventions, the patient was improved and discharged from hospital. The diagnosis and treatment of this case prompted that besides IE, the possibility of APS secondary to SLE should also be considered when UCG revealed a neoplasm, especially for young women who had no clear history of valvular heart diseases. Early diagnosis of APS complicated with Libman-Sacks endocarditis and individualized anticoagulation therapy can yield favorable clinical efficacy.
【Key words】Antiphospholipid antibody syndrome;Systemic lupus erythematosus;
Libman-Sacks endocarditis;Anticoagulation therapy;Infective endocarditis;
Differential diagnosis
抗磷脂抗體綜合征(APS)是一種非炎癥性自身免疫病,臨床上以動脈、靜脈血栓形成,病態妊娠(妊娠早期流產和中晚期死胎)和血小板減少等癥狀為表現,血清中存在抗磷脂抗體,上述癥狀可以單獨或多個共同存在。多見于年輕人,男女發病率之比約為1∶9,女性發病的中位年齡為 30歲[1]。APS可出現在SLE的活動期,而SLE繼發APS同時合并Libman-Sacks心內膜炎極為罕見。為提高臨床醫師對該病的認識水平,現將近年我院收治的一例SLE繼發APS合并Libman-Sacks心內膜炎患者的診治過程綜合報告如下。
病例資料
一、病史及體格檢查
患者女,26歲。因發熱2 d、關節痛10 d、皮疹4 d于2019年8月5日收入我院風濕免疫科。10 d前患者無誘因下出現雙膝關節腫脹,伴膝關節以下麻木、疼痛感,后逐漸出現雙肘關節、指間關節等多關節腫痛,自感有低熱,但未測體溫,自行予止痛等對癥處理后效果欠佳。2 d前患者出現發熱,最高體溫39.4℃,伴畏寒、咽痛等不適,并開始出現雙下肢斑疹、淤斑,呈深紫色,伴明顯瘙癢,為進一步診治來我院求診。起病以來,患者訴無寒戰、頭暈,無胸悶、心悸,無咳嗽、咳痰,無腹痛、腹瀉,無皮疹,無口腔潰瘍等不適,平素患者易出現光敏感,精神、飲食、睡眠差,二便正常,近期體質量無變化。否認風濕性心臟病、先天性心臟病、冠狀動脈粥樣硬化性心臟病(冠心病)史,有人工流產史2次,無靜脈吸毒史不良嗜好,發病前也無侵入性操作史。家族中母親有“風濕病”,具體不詳,否認代謝性疾病、遺傳性疾病史。
入院后體格檢查:體溫36.7℃,脈搏83次/分,呼吸20次/分,血壓102/72 mm Hg (1 mm Hg = 0.133 kPa),四肢散在深紫色皮疹,以下肢為主,關節無紅腫、壓痛,無畸形,雙膝關節未觸及骨擦感。面部無皮疹。雙肺呼吸音清,未聞及干濕性啰音。心律整齊,各瓣膜區未聞及雜音,腹平軟,無壓痛反跳痛,雙下肢無水腫,無皮膚破潰。
二、實驗室檢查和輔助檢查
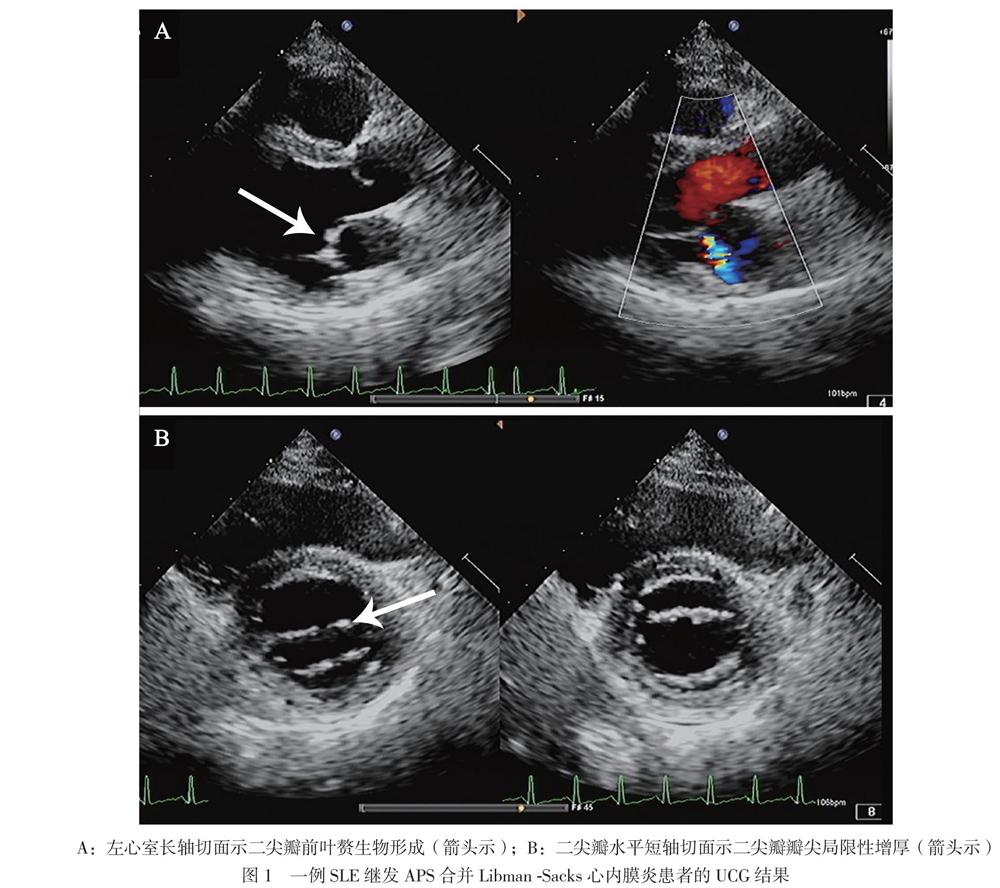
血常規示白細胞、紅細胞、血紅蛋白、血小板大致正常,ESR 115 mm/h,CRP 46.63 mg/L,D-二聚體7.04 mg/L,抗ds-DNA抗體陽性(++),抗核抗體 977 kU/L,抗β2糖蛋白Ⅰ抗體IgG 97.7 kU/L,抗心磷脂抗體IgM 2.3 MPLU/ml。CD4+/CD8+ T淋巴細胞3.00,狼瘡樣抗凝物(+)。Ig及補體正常。心電圖:竇性心動過速,輕度ST段壓低,T波低平(Ⅱ,Ⅲ,aVF,V1 ~ V6導聯)。雙下肢動靜脈彩色多普勒超聲示未見明確血栓征象。于2019年8月9日完善UCG檢查,結果提示二尖瓣前葉贅生物形成?感染性心內膜炎不能完全除外,見圖1A。完善抗“O”試驗陰性,多次血培養均未見異常。
三、診治過程
入院后患者未再出現發熱,考慮感染性心內膜炎不能完全除外,于8月11日加用頭孢曲松鈉抗感染。于8月12日復查UCG,結果示二尖瓣瓣尖局限性增厚。結合患者病史,考慮Libman-Sacks心內膜炎可能,見圖1。予以甲潑尼龍治療,起始劑量為80 mg/d口服,逐漸減量,7 d后減至40 mg/d口服,并予低分子肝素抗凝,加用環磷酰胺0.4 g,每2周1次,同時予營養神經、抑酸護胃治療。8月20日,患者出現發熱,最高體溫為38.3℃,下肢搔抓處皮膚破損分泌物病原學培養出嗜麥芽窄食單胞菌,考慮患者發熱與此相關,根據藥物敏感試驗結果改用左氧氟沙星聯合復方磺胺甲唑抗感染,之后體溫降至正常。8月27日患者午休期間突發頭暈、口周麻木、構音不清、吞咽困難,查頭顱MRI見一新發的延髓梗死灶。結合患者臨床表現、體征及輔助檢查,主要診斷為:APS,Libman-Sacks心內膜炎,延髓梗死,SLE。繼續予甲潑尼龍40 mg/d抑制免疫、羥氯喹調節免疫,加用環磷酰胺0.4 g (累積量為1.2 g)、低分子肝素抗凝,同時抗血小板聚集、營養神經、抑酸護胃治療,定期監測國際標準化比值(INR),調整華法林劑量,復查血常規、肝腎功能未見明顯異常,凝血酶原時間29.1 s,INR 2.80,無出血表現,患者病情好轉,于9月30日出院。出院后門診隨訪,一般情況可,至撰稿日無特殊不適。
討論
本文患者入院前有發熱、咽痛等不適,UCG示二尖瓣前葉贅生物形成,且查狼瘡抗體、抗磷脂抗體、狼瘡樣抗凝物試驗陽性,需明確其是因感染性心內膜炎(IE)還是由原發病導致的心臟瓣膜贅生物?
Libman-Sacks心內膜炎又稱疣狀心內膜炎,是由Libman和Sacks在1924年率先報道,主要見于SLE,在APS患者中更為常見,表現為瓣膜贅生物、瓣膜增厚,是一種發生在心內膜上的多發性非細菌性疣狀贅生物,可侵犯心臟各瓣膜,以二尖瓣和主動脈瓣為多見[2-3]。其發病機制是由于自身Ig及補體沉積導致瓣膜增厚,且在瓣膜上形成纖維蛋白-血小板血栓[4]。Libman-Sacks心內膜炎典型的組織病理學改變是外層為滲出性纖維蛋白、細胞核碎屑和蘇木素小體,中層由增生的毛細血管、纖維母細胞等組織組成,中央可見與薄壁血管相連的新生血管,該血管內可發現Ig與補體的沉積[5-6]。
感染性心內膜炎是指因細菌、真菌、病毒等微生物感染,通過血液流動直接侵犯心內膜而導致的心內膜炎癥。心內膜損傷,內層膠原暴露,血小板、紅細胞、白細胞和纖維蛋白積聚,從而為病原微生物的侵入創造了條件,反復發生的菌血癥可使機體循環中產生抗體如凝集素,有利于病原體在損傷部位黏附而與上述的各種成分一起形成贅生物。贅生物成為微生物的庇護處,使其免受宿主防御機制的作用。感染的贅生物通過血小板-纖維素聚集而逐漸增大,從而使瓣膜破壞加重[7]。
Libman-Sacks心內膜炎極易與IE混淆而誤診[8]。其實兩者在本質上有著明顯的區別。本例患者起病較急,先以雙下肢多發微血栓起病,伴有發熱,2次查UCG可見二尖瓣贅生物形成。從臨床表現看,患者發病前有發熱、畏寒、咽痛等上呼吸道感染癥狀,IE不能完全除外,但仔細分析此患者的病歷資料可見其與IE有著很大的區別:①患者既往體健,無明確風濕性心臟病、先天性心臟病、冠心病等損害心臟的病史,無靜脈吸毒史不良嗜好,發病前也無侵入性操作史,如拔牙、婦科檢查等。②反復幾次血培養均未見異常,病程中以大量足療程抗菌藥物治療情況下仍有反復發熱,而頭孢曲松鈉可使98%的IE患者達細菌學治愈,如若抗菌藥物治療無效,則會出現瓣膜損害逐漸加重,從而誘發心力衰竭或血流動力學障礙等問題[9]。③IE的白細胞計數、CRP水平和血液培養均可見異常[10]。SLE活動時白細胞減少,IE則相反。過高的CRP水平表明是感染的原因,因為SLE患者不太可能對其產生強烈的反應,然而明確的鑒別診斷還需依靠血培養。本例患者的白細胞正常,CRP水平不高,血培養陰性。④本例患者風濕相關抗體陽性,UCG可見贅生物發生在瓣膜的交界處,不活動,邊緣不毛糙。而IE贅生物呈毛絨樣團狀,隨瓣膜的活動而活動[11]。⑤APS可無發熱,本例患者治療過程中仍有反復發熱,考慮可能與雙下肢皮膚感染相關,根據皮膚分泌物藥物敏感試驗改用敏感抗菌藥物后患者體溫即恢復正常,這驗證了患者的發熱與雙下肢感染相關。本例的診治提示,在UCG發現贅生物時,不僅要考慮IE,同時需要考慮SLE繼發APS可能,尤其是既往無明確心瓣膜病病史的年輕女性。心臟瓣膜受累是原發性或繼發性APS常見的心臟表現,國外報道32%的APS可侵犯心臟瓣膜,造成瓣膜損害,包括瓣膜增厚、狹窄、反流及贅生物。多達70%的APS患者有UCG診斷的瓣膜異常,并多見于二尖瓣和主動脈瓣[12]。本例患者可能是因 SLE繼發APS導致無菌性心內膜贅生物和腦梗死。對于該病的治療,長期抗凝是降低血栓事件的唯一手段,部分患者需要終生抗凝治療[13]。
綜上所述,對于非IE患者,需要考慮SLE繼發APS的可能性。通過對SLE及APS的不斷深入探索,期待發現更多的相關病例特點,從而提高臨床診療水平。
參 考 文 獻
[1] 中華醫學會風濕病學分會. 抗磷脂綜合征診斷和治療指南. 中華風濕病學雜志, 2011, 6(15): 407-410.
[2] Galve E, Candell-Riera J, Pigrau C, Permanyer-Miralda G, Garcia-Del-Castillo H, Soler-Soler J. Prevalence, morphologic types, and evolution of cardiac valvular disease in systemic lupus erythematosus. N Engl J Med, 1988, 319(13):817-823.
[3] Doherty NE, Siegel RJ. Cardiovascular manifestations of systemic lupus erythematosus. Am Heart J, 1985, 110(6):1257-1265.
[4] 黃毅,陳昕,王曉冰,楊軍. 超聲心動圖診斷Libman-Sacks心內膜炎1例. 中國臨床醫學影像雜志, 2020, 31(1):72.
[5] Nihoyannopoulos P, Gomez PM, Joshi J, Loizou S, Walport MJ, Oakley CM. Cardiac abnormalities in systemic lupus erythematosus. Association with raised anticardiolipin antibodies. Circulation, 1990, 82(2):369-375.
[6] 秦瑞芳,胡紹先.系統性紅斑狼瘡的心臟瓣膜病變. 內科急危重癥雜志,2008,14(2):92-103.
[7] 接麗莉,楊躍輝.感染性心內膜炎的分類及其藥物治療現狀.中國臨床藥理學雜志, 2018, 34(19):2355-2358.
[8] 時向民, 王玉堂, 王蔚然, 寧清秀.抗磷脂綜合征合并疣狀心內膜炎誤診為亞急性細菌性心內膜炎1例報告并文獻復習. 中國誤診學雜志, 2006, 6(13):2465-2467.
[9] 李琪,高秀玲. 感染性心內膜炎抗菌藥物的應用. 新醫學, 2004, 45(3):140-141.
[10] Hamza MA, Allam L. Libman-Sacks endocarditis, and other echocardiographic findings in systemic lupus erythematosus: case report. Egypt Heart J, 2012, 64(3):171-172.
[11] Brenner B, Blumenfeld Z, Markiewicz W, Reisner SA. Cardiac involvement in patients with primary antiphospholipid syndrome. J Am Coll Cardiol, 1991, 18(4):931-936.
[12] Mohammadi Kebar Y, Avesta L, Habibzadeh A, Hemmati M. Libman-Sacks endocarditis in patients with systemic lupus erythematosus with secondary antiphospholipid syndrome. Caspian J Intern Med, 2019, 10(3):339-342.
[13] Espinosa G, Cervera R. Current treatment of antiphospholipid syndrome: lights and shadows. Nat Rev Rheumatol, 2015, 11(10):586-596.
(收稿日期:2020-07-17)
(本文編輯:林燕薇)

