Cu-In-S納米線促進電催化二氧化碳還原制備一氧化碳
鐘達忠,郝根彥,李晉平,趙 強
(太原理工大學 a.化學化工學院,b.氣體能源高效清潔利用山西省重點實驗室,太原 030024)
隨著化石能源的不斷消耗,大氣中二氧化碳濃度增加以及環境污染問題越來越嚴重[1-2]。利用太陽能等可再生能源發電再電催化還原二氧化碳可以有效地緩解能源危機和溫室效應[3-4]。然而,二氧化碳還原和析氫的熱力學電位接近,而且二氧化碳還原是一個動力學緩慢的過程。相對于二氧化碳還原,動力學有利的析氫反應更容易發生,這導致二氧化碳還原的活性和選擇性往往較低。一氧化碳是重要的化工原料,將二氧化碳還原至一氧化碳具有重要的意義。目前報道的能夠有效地將二氧化碳還原至一氧化碳的催化劑多為貴金屬Au[5-7]、Ag[8]和Pd[9-11]等。但是,貴金屬昂貴稀少的缺點限制了其進一步的大規模應用。開發廉價高效的二氧化碳還原催化劑是提升二氧化碳還原活性和選擇性的有效途徑。銅由于能夠進一步將一氧化碳還原成烴類和醇類,被廣泛認為是潛在的能夠廣泛應用的二氧化碳還原催化劑。但是多晶銅的析氫活性較高,催化二氧化碳還原得到一氧化碳的活性和選擇性依然較低。CuIn雙金屬合金也是一種高效的二氧化碳還原催化劑[12-13]。銦的引入能夠有效地促進二氧化碳在銅上的還原。此外,金屬硫化物被報道具有較好的二氧化碳還原的活性[14-15]。CdS納米棒被報道具有很好的將二氧化碳還原至一氧化碳的活性[15],其具有硫空位的(0002)晶面被認為能夠有效促進二氧化碳活化[15]。然而,CdS毒性較高,對人體和環境傷害較大,不利于其大規模應用。為了開發廉價高效的環境友好型二氧化碳還原催化劑,我們通過在銅上引入硫元素來提升銅的表面粗糙度,提升其電化學活性面積,提升電催化反應的電流密度。通過進一步引入銦制備Cu-In-S,In的引入能夠有效抑制析氫,提高二氧化碳還原至一氧化碳的選擇性。得到的Cu-In-S和Cu-S在-0.8 V vs.RHE的電壓下電流密度都能夠達到-6.23 mA/cm2左右,與Cu NWs的-1.23 mA/cm2的電流密度相比有了明顯的提升。同時,Cu-In-S的CO法拉第效率明顯提升,其在-0.8 V vs.RHE的電壓下到達最高約75%的CO法拉第效率。
1 實驗部分
1.1 試劑
從阿拉丁購買獲得CuCl2·2H2O,葡萄糖(分析純)購自天津化學試劑一廠,十六胺(95%)購自安耐吉化學,正己烷(99%)購自元立公司,硫脲(99%)購自國藥。所有試劑在使用前沒有進一步純化。所有實驗用水為高純水(18.25 MΩ/cm).
1.2 合成Cu NWs
參考文獻[16]制備Cu NWs. 85.5 mg氯化銅和99 mg葡萄糖溶解在40 mL水中,然后加入0.54 g十六胺攪拌5 h形成天空藍的溶液,再將此溶液轉移至100 mL的反應釜中在120 ℃反應24 h.所得樣品經過清洗分散在正己烷中。
1.3 合成Cu-S和Cu-In-S
取10 mg Cu NWs分散在含有22.84 mg(0.3 mmol) 硫脲和30.08 mg(0.1 mmol) 硝酸銦的40 mL PEG600溶液中,在無氧條件下180 ℃回流120 min,制備得到Cu-In-S.不添加硝酸銦制備得到Cu-S.
1.4 電極的制備
將1 mg催化劑和10 μL 5%的Nafion超聲分散在490 μL乙醇中,形成均勻的懸浮液。將50 μL懸浮液滴涂在面積為0.5 cm2的玻碳電極上,催化劑負載量為0.2 mg/cm2;在空氣中干燥后,進行活性測試。
1.5 結構表征
在Bruker D8 Discover衍射儀上獲得X射線衍射圖像(XRD)。 掃描電子顯微鏡照片(SEM)在Hitachi SEM(SU8010,Japan)上獲得。 透射電子顯微鏡(TEM)圖像是在JEM-2100(Japan)上獲得的。
1.6 活性測試
電化學測試在三電極體系下進行,帶隔膜的定制的密閉H型反應池作為反應器,電解液為二氧化碳飽和的0.1 mol/L KHCO3,Ag/AgCl(KCl飽和)和Pt片分別作為參比電極和對電極。測試過程中利用氣相色譜對反應的產物進行檢測。
2 結果與討論
2.1 催化劑的制備與結構表征
如圖1(a),(b)所示,掃描電鏡圖說明成功制備了均一分散的Cu納米線(Cu NWs).光學圖片(圖1(a)中插圖所示)為分散在正己烷中的Cu NWs,其表現出暗紅色,說明成功得到金屬銅。透射電鏡圖表明得到的Cu NWs直徑約為20~30 nm(圖1(c)).高倍透射電鏡對應的晶格條紋來自Cu(111)晶面,進一步說明制備得到的為金屬銅(圖1(d)).XRD衍射圖(圖1(e))也進一步說明成功得到了金屬Cu.
進一步通過液相硫化反應,以硫脲作為硫源,在Cu NWs上引入S制備得到了Cu-S納米線結構,如圖2(a)所示。稱取10 mg Cu NWs分散在含有22.84 mg硫脲的40 mL PEG600溶液中,在排空空氣的條件下加熱至180 ℃,回流120 min,冷卻至常溫,通過清洗干燥得到了Cu-S.通過掃描電鏡照片(圖3(a),(b))可以看出,硫化之后Cu NWs長度變短了,但是依然保持棒狀結構,其表面變得更加粗糙,這樣有利于暴露更多的反應位點,促進電催化反應的進行。圖3(c)透射電鏡圖進一步表明其依然保持棒狀結構,表面由原來的光滑表面變得更加粗糙。高倍透射電鏡(圖3(d))可以觀察到晶面間距為0.3 nm的晶格條紋,這和Cu2S的(101)晶面能夠很好地對應,說明S引入之后成功制得了Cu2S.為了進一步考察Cu和S元素的分布狀態,我們進行了元素分布能譜表征,如圖3(e)所示。結果表明,Cu和S元素是均勻分布的,說明我們成功得到了結構均一的Cu-S,S元素均勻摻入到Cu中。

圖1 Cu NWs的(a),(b)掃描電鏡圖(插圖為Cu NWs的光學照片),(c)透射電鏡圖和(d)高倍透射電鏡圖(插圖為黃色框區域的FFT變換),(e)Cu NWs的XRD衍射圖Fig.1 (a),(b) Scanning electron microscopy, (c) Transmission electron microscopy, and (d) High resolution transmission electron microscopy images of Cu NWs. (Inset in a: optical photograph of Cu NWs, inset in d: FFT image). (e) XRD pattern of Cu NWs.
圖2 (a)Cu-S和(b)Cu-In-S的制備過程Fig.2 Preparation of (a) Cu-S and (b) Cu-In-S

圖3 Cu-S的(a,b)掃描電鏡圖,(c)透射電鏡圖,(d)高倍透射電鏡圖和(e)元素分布圖Fig.3 (a,b) Scanning electron microscopy, (c) transmission electron microscopy, and (d) high resolution transmission electron microscopy images of Cu-S. (e) Elements mapping of Cu and S
類似的,我們取10 mg Cu NWs分散在含有22.84 mg硫脲和30.08 mg硝酸銦的40 mL PEG600溶液中,在無氧條件下180 ℃ 回流120 min,冷卻至常溫狀態,通過清洗干燥得到了Cu-In-S(圖2(b)).通過掃描電鏡對其表面結構進行表征,從圖4(a),(b)可以看出,Cu-In-S展現出類似于Cu-S的表面結構,其長度比Cu NWs稍短,但是其表面變得更加粗糙,有許多堆積的小顆粒。此結果說明In的引入并沒有引起其形貌的進一步改變,S元素的引入對形貌和粗糙度的改變起著關鍵作用。我們進一步通過透射電鏡表征對其結構進行分析,如圖4(c),(d)所示,透射電鏡結果同樣說明了其表面結構變成類似于Cu-S的粗糙表面。高倍透射電鏡可以看到晶格間距為0.32 nm的晶格條紋,對應于CuInS2的(112)晶面,說明In和S的引入生成了CuInS2.同樣的,我們考察了Cu、In和S三種元素的分布情況,如圖4(e)所示,Cu、In和S是均勻分布的。

圖4 Cu-In-S的(a,b)掃描電鏡圖,(c)透射電鏡圖,(d)高倍透射電鏡圖和(e)元素分布圖Fig.4 (a,b) Scanning electron microscopy, (c) transmission electron microscopy, and (d) high resolution transmission electron microscopy images of Cu-In-S. (e) Elements mapping of Cu, In, and S
為了進一步明確制備的Cu-S和Cu-In-S的結構,對其進行了X-射線衍射表征。如圖5所示,可以看出Cu-S主要以Cu2S的形式存在。同時引入In和S后,得到的Cu-In-S的X-射線譜圖衍射峰和CuInS2的PDF卡片(PDF#65-2732)基本吻合,說明Cu-In-S是以CuInS2的結構存在。X-射線衍射的結果和高倍透射電鏡的結果也具有很好的一致性。
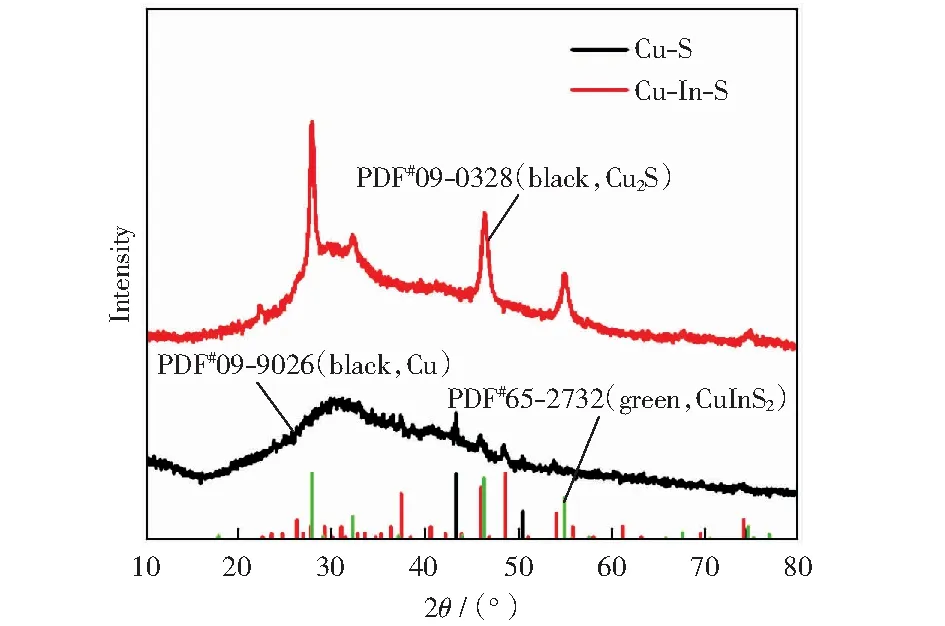
圖5 Cu-S和Cu-In-S的X-射線衍射圖譜Fig.5 X-ray diffraction patterns of Cu-S and Cu-In-S
2.2 催化劑的活性測試
將Cu NWs、Cu-S和Cu-In-S滴涂在玻碳電極上對其活性進行測試,分別以Ag/AgCl(KCl飽和)和Pt片作為參比電極和對電極,電解液為CO2飽和的0.1 mol/L KHCO3.通過極化曲線對其CO2還原電流密度進行考察,結果如圖6所示。在相同的電壓下,相對于Cu NWs,Cu-S表現出明顯更高的電流密度,這可能是S的引入導致表面結構更粗糙從而表現出電流密度的提高。同時,我們發現其起始電位也出現了正移,說明S的引入也會有利于二氧化碳還原或者析氫反應的進行。Cu-In-S的極化曲線和Cu-S重合度較高,說明In的引入并沒有對催化電流有進一步的影響。
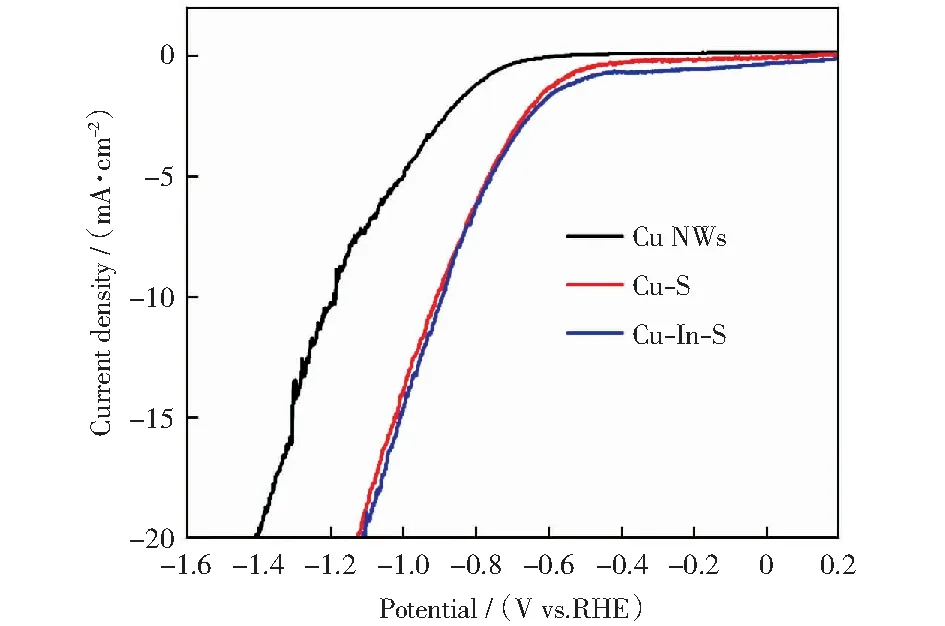
圖6 Cu NWs、Cu-S和Cu-In-S的極化曲線Fig.6 Linear sweep voltammetry curves of Cu NWs, Cu-S, and Cu-In-S
為了探究Cu-S和Cu-In-S表現出較高電流密度的原因,進一步進行了電化學活性面積的測試,以雙電層電容代表電化學活性面積的大小。如圖7所示,Cu-In-S和Cu-S表現出相似的電化學活性面積,和其類似的表面結構結果相吻合。Cu-S和Cu-In-S表現出比Cu NWs高的電化學活性面積,說明S的引入導致電化學活性面積變大,有效地促進了電催化電流密度的提高。
根據極化曲線,選擇-0.5~-1.0 V的電壓進行法拉第效率測試。如圖8(a),法拉第效率測試顯示Cu NWs在所測試的電壓范圍內基本都是產氫的,其CO法拉第效率低于10%.同時,引入S之后,產物分布并沒有觀察到明顯的變化,CO的選擇性依然較低,說明S的引入對產物分布并沒有太大的影響,其主要是促進了催化劑電化學活性面積的提高,從而提升催化電流密度。然而,如果同時引入了In,其產物分布則發生了明顯的變化,Cu-In-S的CO選擇性有了明顯的提升(圖8(c)).改變引入In的量,發現制備過程中適當的In引入量(0.1 mmol)得到的Cu-In-S表現出最好的反應活性(圖8(c)).測試電壓從-0.5 V升到-1.0 V,Cu-In-S的CO法拉第效率表現出先上升后下降的趨勢,其在-0.8 V表現出最大的CO法拉第效率,為75%.說明In的引入能夠有效地促進二氧化碳的還原,提升其二氧化碳還原活性。圖9為In的引入量為0.05和0.15 mmol時制得的樣品的反應活性測試結果。

圖7 Cu NWs、Cu-S和Cu-In-S的電化學活性面積Fig.7 Electrochemical surface area test for Cu NWs, Cu-S, and Cu-In-S
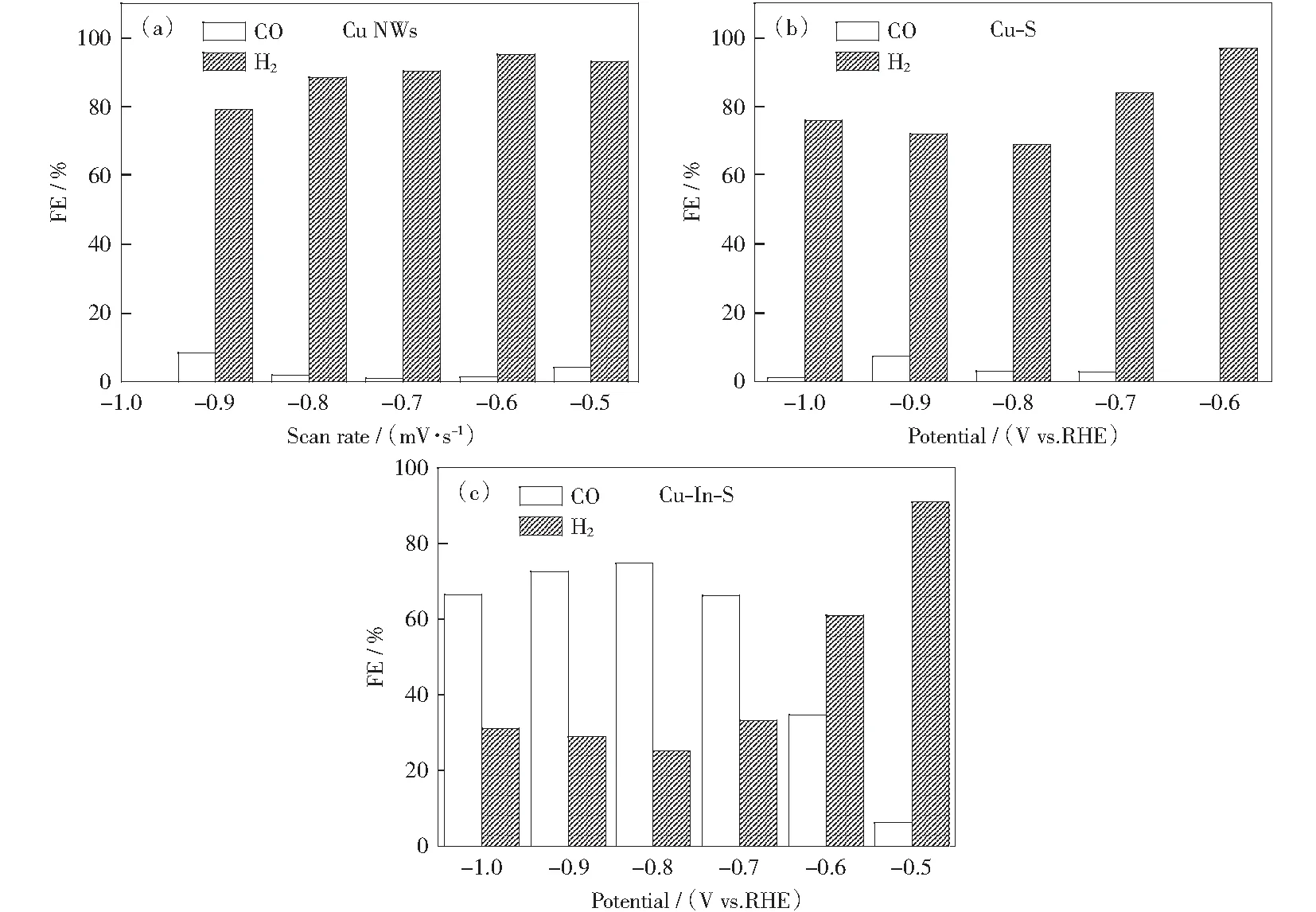
圖8 (a)Cu NWs,(b)Cu-S和(c)Cu-In-S的CO2還原活性測試Fig.8 CO2 reduction activity of (a) Cu NWs, (b) Cu-S, and (c) Cu-In-S
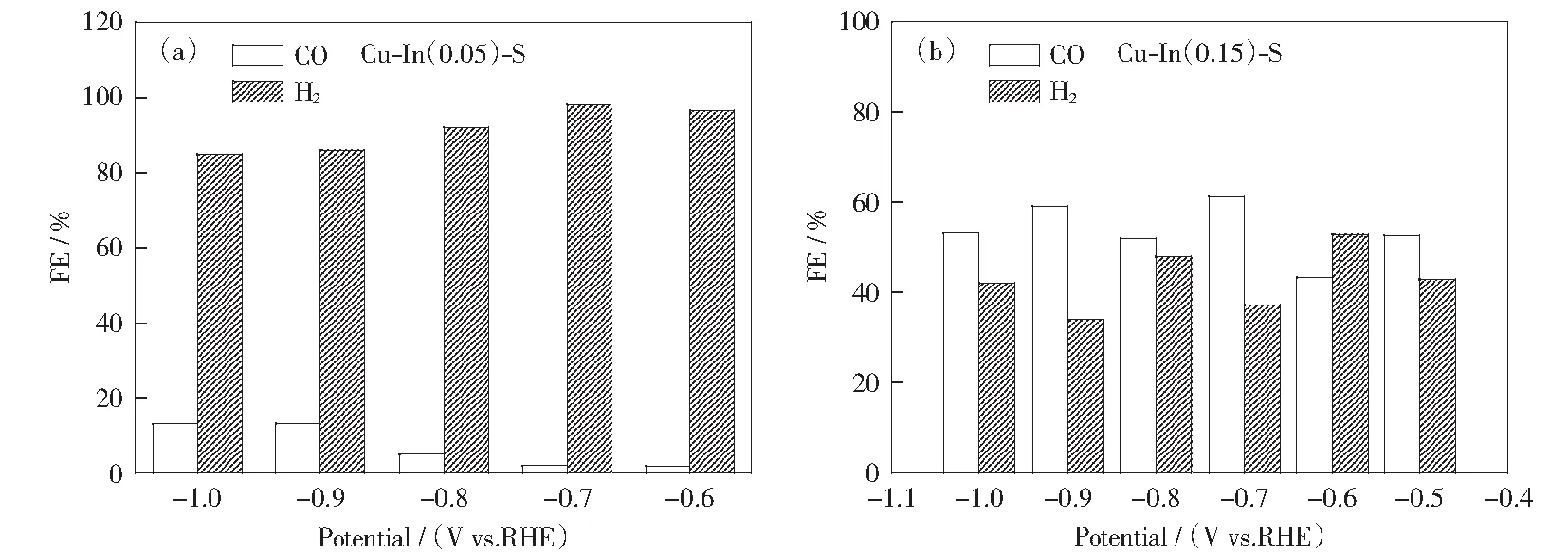
改變加入的硝酸銦量為0.05 mmol制備獲得,Cu-In(0.15)-S為改變加入的硝酸銦量為0.15 mmol制備獲得圖9 (a)Cu-In(0.05)-S和(b)Cu-In(0.15)-S的CO2還原活性測試Fig.9 CO2 reduction activity of (a) Cu-In(0.05)-S and (b) Cu-In(0.15)-S
需要注意的是,Cu NWs和Cu-In-S催化性測試。Cu-In(0.05)-S為反應得到的產物中CO和H2氣體產物的法拉第效率接近100%,說明其基本沒有液相產物。而對于Cu-S而言,它可能會產生少量的甲酸[17]。
3 結論
本文成功制備了Cu NWs、Cu-S和Cu-In-S的棒狀納米結構,Cu-S和Cu-In-S表現出較為粗糙的表面,S的引入對粗糙表面的構建起著關鍵作用。將它們用于電催化二氧化碳還原,Cu-In-S表現出較好的二氧化碳還原能力,其在-0.8 V vs.RHE電壓下表現出最高的一氧化碳法拉第效率,為75%;In的引入是促進其法拉第效率提升的原因。同時,Cu-In-S和Cu-S在-0.8 V vs.RHE電壓下電流密度都能夠達到-6.23 mA/cm2左右,相對Cu NWs的-1.23 mA/cm2有了明顯的提升。

