慢性阻塞性肺疾病患者血清SDC-1、ANGPTL4、PGRN與肺功能及炎性反應的相關性分析
吳明景,陳曉林,舒磊,魏靜,王雪利
早期對慢性阻塞性肺疾病(COPD)患者的病情進行準確評估顯得尤為重要,可為臨床干預措施的制定和實施提供參考依據,繼而達到改善患者預后的目的[1-2]。COPD患者的臨床表現特征包括氣道、肺實質及肺血管的慢性炎性反應,其中有多重炎性細胞因子共同作用[3]。多配體蛋白聚糖-1(SDC-1)是一種跨膜黏蛋白聚糖,亦是經典的生長因子、趨化因子及血管生成因子,其HS鏈存在廣泛結構異質性,可與細胞外基質及多種酶相結合,繼而在細胞增殖、遷移及炎性反應等過程中起至關重要的作用[4]。血管生成素樣蛋白4(ANGPTL4)屬于近年來發現的一種新型蛋白因子,介導了脂質代謝、細胞遷移及多種炎性疾病過程[5]。顆粒蛋白前體(PGRN)屬于分泌性糖蛋白之一,可直接或間接參與炎性反應、損傷修復及生長發育等病理生理過程[6]。鑒于此,現分析COPD患者血清SDC-1、ANGPTL4、PGRN與肺功能及炎性反應的相關性,以及其對COPD的影響機制, 報道如下。
1 資料與方法
1.1 臨床資料 選取2017年2月—2019年12月南京醫科大學附屬逸夫醫院呼吸內科收治COPD患者150例作為研究對象,其中男94例,女56例;年齡50~79(64.22±8.01)歲;文化程度:初中及以下65例,高中及以上85例。急性加重期(呼吸道癥狀加劇,表現為咳嗽、咯痰、喘息加重,痰量增多,且為膿性或黏液膿性痰,伴或不伴發熱)88例,男59例,女29例,年齡50~78(63.52±7.13)歲;體質量指數(BMI)19~28(22.39±2.31)kg/m2;病程3~10(4.22±1.02)年;合并癥:高血壓45例,糖尿病36例;GOLD分級[7]:1級15例,2級26例,3級28例,4級19例;有吸煙史54例,有既往治療史26例,家族遺傳史17例;穩定期(咳嗽、咳痰、喘息等癥狀穩定或較為輕微,病情基本恢復至急性加重前的狀態)62例,男35例,女27例,年齡52~79(65.21±8.79)歲;BMI 19~27(22.78±2.96)kg/m2;病程2~7(4.15±1.67)年;合并癥:高血壓22例,糖尿病17例;GOLD分級:1級7例,2級20例,3級22例,4級13例;有吸煙史37例,有既往治療史22例,家族遺傳史14例。另選同期于醫院體檢的健康志愿者60例作為健康對照組,其中男37例,女23例,年齡48~77(64.09±7.02)歲;文化程度:初中及以下31例,高中及以上29例。2組性別、年齡、文化程度比較,差異無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會批準,受試者及家屬均知情同意并簽署知情同意書。
1.2 病例選擇標準 (1)納入標準:①所有納入對象均符合“慢性阻塞性肺疾病基層診療指南”[7]中的相關標準;②均完成相應的血清學檢測;③能配合完成肺功能檢測。(2)排除標準:①活動性肺結核和/或支氣管擴張者;②肝、腎等臟器發生嚴重病變者;③存在感染性疾病、全身免疫系統疾病、惡性腫瘤者;④意識障礙或無法正常交流者。
1.3 觀測指標與方法
1.3.1 血清樣本采取:健康對照組于體檢當日、COPD患者于入院次日采集清晨空腹靜脈血5 ml,離心獲取上層血清后分裝于1號管、2號管,保存在-30℃冰箱中備用。
1.3.2 血清SDC-1、ANGPTL4及PGRN水平檢測:取1號管血清,采用雙夾心抗體酶聯免疫吸附法進行檢測,具體操作遵循試劑盒說明書完成,相關試劑盒購自美國R&D公司。
1.3.3 血清炎性因子水平檢測:取2號管血清,通過雙夾心抗體酶聯免疫吸附法檢測血清腫瘤壞死因子-α(TNF-α)、白介素-8(IL-8)、IL-17水平,操作流程遵循試劑盒說明書完成,相關試劑盒均由上海酶聯生物科技有限公司提供。
1.3.4 肺功能檢測:借助Masterscope肺功能儀(德國耶格公司)完成第1秒用力呼氣容積(FEV1)及用力肺活量(FVC)測定,并計算FEV1/FVC比值。
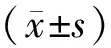
2 結 果
2.1 3組血清SDC-1、ANGPTL4及PGRN水平比較 血清SDC-1、ANGPTL4及PGRN水平比較,急性加重期組>穩定期組>健康對照組,差異均有統計學意義(P均<0.01),見表1。
2.2 3組血清炎性指標比較 血清TNF-α 、IL-8及IL-17水平比較,急性加重期組>穩定期組>健康對照組,差異均有統計學意義(P均<0.01),見表2。

表2 3組受試者血清炎性反應指標比較
2.3 3組肺功能指標比較 FEV1、FVC及FEV1/FVC水平比較,急性加重期組<穩定期組<健康對照組(P均<0.01),差異均有統計學意義,見表3。
2.4 COPD患者血清SDC-1、ANGPTL4及PGRN水平與肺功能、炎性指標的相關性分析 經Pearson相關性分析可得,COPD患者血清SDC-1、ANGPTL4及PGRN水平與FEV1、FVC、FEV1/FVC均呈負相關,與血清TNF-α、IL-8、IL-17均呈正相關(P均<0.05),見表4。
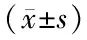
表3 3組受試者肺功能指標比較

表4 COPD患者血清SDC-1、ANGPTL4及PGRN水平與肺功能、炎性反應相關指標水平的相關性分析
3 討 論
COPD屬于臨床上較為常見的呼吸系統疾病,氣流受限是該病患者的主要表現特征,且氣流受限非完全可逆,并呈進行性進展。隨著人們生活環境的日益惡化,加之人口老齡化問題的日益凸顯,COPD的發病率正呈逐年升高趨勢,已然成為嚴重威脅人類生命健康安全的重大疾病之一[8-10]。COPD急性加重期主要是指患者短期內各項臨床癥狀及炎性反應加劇,往往病情較為嚴重,是致使患者住院乃至死亡的主要原因。目前,臨床上用以評估COPD患者病情的主要手段包括肺功能分級、呼吸困難指數評分及COPD評估測試評分等[11-13]。然而,由于部分患者的隱匿性較強,從而增加了臨床評估的難度,繼而無法為治療方案的制定提供指導作用[14-16]。因此,尋找一種更為敏感、可靠的生物學標志物實現病情及預后的評估成為臨床研究的熱點。相關研究報道表明,SDC-1 及ANGPTL4均在多種炎性疾病的發生、發展中起著不可忽視的作用,其水平的高表達往往預示著機體炎性反應的加劇[17-19]。PGRN主要是由多種細胞分泌的糖基化蛋白質,介導機體內的組織損傷修復、炎性反應及腫瘤形成等過程,且近年來不少研究報道證實,其與多種炎性疾病的發病機制存在密切聯系,可能發揮刺激促炎因子表達及誘導巨噬細胞遷移等作用[20-22]。
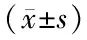
表1 3組受試者血清SDC-1、ANGPTL4及PGRN水平比較
本結果發現,COPD患者血清SDC-1、ANGPTL4及PGRN水平存在明顯的異常高表達,其中ANGPTL4及PGRN水平在COPD患者中升高在既往相關研究中可以得到佐證[23-25],提示二者升高可能與COPD患者的疾病進展有關,然而,國外研究報道顯示,SDC-1在COPD患者血清中明顯降低[26],這與本研究中SDC-1水平升高的結果不同,筆者猜測這可能因為此研究選取的COPD患者大多不能完成肺功能檢測,其病情較為嚴重,故而可能出現SDC-1降低的情況。其中SDC-1可通過促進IL-6等多種炎性介質的合成、分泌,繼而在COPD的發生、發展過程中起著積極促進作用。ANGPTL4具有調控血管生成、糖脂代謝等作用,而血管生成又是炎性反應的重要病理基礎,因此,隨著ANGPTL4表達水平的不斷升高,機體炎性反應隨之加重,促進了COPD患者病情的惡化。PGRN可通過誘導單核巨噬細胞的遷移,以及刺激TNF-α及IL-1β等相關細胞因子的表達,從而加劇炎性反應。同時,PGRN可刺激巨噬細胞于脂肪組織內積聚,且可促進募集的巨噬細胞向炎性細胞轉化,從而在COPD的發生、進展過程中發揮著重要的作用。與王娜等[27]的研究不同的是,本研究著重研究的指標為血清炎性因子及肺功能指標,并未涉及炎性細胞層面的分析,這是本研究的不足之處,今后的研究將納入炎性細胞的考察,獲取更加全面的結論。此外,COPD患者血清TNF-α、IL-8及IL-17水平存在異常升高,且隨著病情的加重,上述指標異常升高情況加劇,這與既往研究中COPD患者血清TNF-α、IL-8及IL-17水平均存在明顯高表達的結論相一致[28]。TNF-α屬于機體內的重要炎性反應及免疫反應介質之一,可通過殺傷、浸潤病原體,以及促進中性粒細胞趨化,進一步啟動炎性反應。IL-8是細胞趨化因子家族成員之一,屬于炎性疾病重要介質之一,可通過促進中性粒細胞的趨化及活化,繼而在炎性疾病的發生、發展過程中發揮至關重要的作用。IL-17是由T細胞所形成的前炎性細胞因子之一,亦屬于炎性反應調控因子,可通過促進TNF-α及IL-8等細胞因子的形成,進一步導致炎性反應的加劇。與此同時,IL-17可通過增強肺部彈性蛋白的活性,從而對肺組織造成損傷,進一步引起免疫平衡紊亂和炎性因子大量合成分泌。COPD屬于一種氣道炎性疾病,隨著病情的不斷加重,氣道炎性反應愈發明顯,炎性因子表達異常程度越高[29]。另外,本研究發現,COPD患者血清SDC-1、ANGPTL4及PGRN水平與肺功能指標及血清炎性因子水平均存在相關性,提示COPD患者血清SDC-1、ANGPTL4及PGRN與肺功能、炎性反應有關,或可作為臨床上輔助評估患者病情的指標。
綜上所述,SDC-1、ANGPTL4及PGRN在COPD患者血清中均呈現異常高表達,且與肺功能、炎性反應密切相關,有望成為臨床輔助評估COPD患者病情的指標。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
吳明景:提出研究方向、研究思路、研究選題,起草論文,修訂論文;陳曉林:設計研究方案和論文框架,論文終審; 舒磊、魏靜:進行文獻調研與整理,實施研究過程;王雪利:數據收集和分析

