枯否細(xì)胞在肝移植脂肪供肝的缺血再灌注損傷中的作用研究進(jìn)展
蔡佳暉,王經(jīng)琳,任昊楨,施曉雷,
(1.南京醫(yī)科大學(xué)附屬鼓樓臨床醫(yī)學(xué)院 普外科,2.南京大學(xué)醫(yī)學(xué)院附屬鼓樓醫(yī)院 普外科,江蘇 南京210008)
缺血再灌注損傷(ischemia-reperfusion injury,IRI)是指缺血、缺氧的組織或器官在重新獲得血液及氧氣供應(yīng)后,損害不但沒有減輕,反而加重的病理生理過程。一般分為四個(gè)階段:器官離開供體到冷凍前的熱缺血期,冷藏器官以降低代謝率的冷缺血期,器官與肝移植患者進(jìn)行血管重建的復(fù)溫期,血流再通的再灌注期。肝臟IRI是肝移植的常見風(fēng)險(xiǎn),影響手術(shù)的成功與否,也決定了移植后器官功能的恢復(fù)情況。
目前,肝移植患者的數(shù)量遠(yuǎn)超可用供肝的數(shù)量,諸如脂肪供肝這類邊緣供肝的應(yīng)用就愈發(fā)普遍[1]。然而,相較于正常供肝,脂肪供肝線粒體ATP生產(chǎn)能力下降[2],這使其對(duì)IRI的耐受能力下降。同時(shí),脂肪供肝內(nèi)的細(xì)胞色素P450酶代謝多余的脂肪酸并生成大量活性氧(reactive oxygen species,ROS),導(dǎo)致枯否細(xì)胞(Kupffer cells,KCs)對(duì)凋亡信號(hào)更為敏感,促進(jìn)了脂肪供肝的細(xì)胞凋亡。細(xì)胞凋亡需要ATP,當(dāng)ATP耗竭,凋亡轉(zhuǎn)變?yōu)閴乃溃灾靖蔚奶攸c(diǎn)是中度凋亡和大量壞死(73%),這種細(xì)胞死亡類型的改變或許增強(qiáng)了脂肪供肝對(duì)促炎因子的敏感性[3]。而在IRI過程中,經(jīng)典活化的KCs將釋放大量炎癥介質(zhì),如腫瘤壞死因子-α(tumor necrosis factor-alpha,TNF-α)、白細(xì)胞介素(IL)-1β、IL-18、血小板活化因子(platelet activating facter,PAF)、不同的前列腺素、干擾素(interferon gamma IFN)等,對(duì)組織產(chǎn)生有害作用。這表明在IRI過程中,KCs對(duì)脂肪供肝有著重要的影響。
移植前,脂肪肝中的KCs 體積增大,數(shù)量增多,且處于激活狀態(tài)[4]。當(dāng)發(fā)生IRI時(shí),KCs進(jìn)一步激活,這與再灌注時(shí)大量?jī)?nèi)毒素(LPS)的涌入有關(guān),也與肝內(nèi)的氧化應(yīng)激反應(yīng)有關(guān),由于KCs本身的細(xì)胞特性,還與其極化狀態(tài)的改變有關(guān),但具體機(jī)制尚未明確。
1 脂肪肝IRI的病理生理
隨著現(xiàn)代人飲食結(jié)構(gòu)的改變,高脂高熱量飲食愈發(fā)普遍,這就導(dǎo)致非酒精性脂肪肝病(NAFLD)人數(shù)日益增多,在亞洲地區(qū)NAFLD的總體患病率為29.62%[5]。當(dāng)肝臟發(fā)生脂肪變性,肝細(xì)胞內(nèi)的脂滴使細(xì)胞脹大,一方面導(dǎo)致肝血竇腔隙減小,血流不足,肝細(xì)胞缺氧壞死,另一方面保存器官時(shí)易發(fā)生脂肪固結(jié),引起再灌注時(shí)肝細(xì)胞崩解。脂肪變性也改變了線粒體膜的脂質(zhì)組成和流動(dòng)性,使其易受到自由基的攻擊,同時(shí),細(xì)胞器的主要抗氧化物質(zhì)還原型谷胱甘肽(GSH)也發(fā)生下降。于是在IRI時(shí),大量氧自由基生成,脂肪肝內(nèi)脂質(zhì)過氧化,氧自由基直接損傷細(xì)胞組成,或產(chǎn)生炎性因子和黏附分子造成間接損害。KCs的激活是脂肪肝IRI加劇的另一原因,這一點(diǎn)將在下文著重介紹。
2 KCs的基本形態(tài)
KCs是一種肝固有巨噬細(xì)胞,來源于骨髓中的單個(gè)核細(xì)胞[6],占全身巨噬細(xì)胞總數(shù)的80%~90%,約占肝臟細(xì)胞總數(shù)的15%[7]。KCs體積較大,形態(tài)不規(guī)則,可伸出絲狀偽足依附于肝血竇內(nèi)皮細(xì)胞表面或經(jīng)窗孔伸入Disse間隙內(nèi),與肝細(xì)胞微絨毛交錯(cuò),這樣的結(jié)構(gòu)方便其協(xié)調(diào)或影響其他細(xì)胞的功能。KCs含有多種溶酶體酶,其質(zhì)膜表面可表達(dá)多種受體,如Toll樣受體(toll like receptor,TLR)、內(nèi)毒素受體、清道夫受體、Fc受體、補(bǔ)體受體、半乳糖胺受體等。KCs的結(jié)構(gòu)及酶學(xué)特點(diǎn)均表明其具備吞噬、分泌、免疫調(diào)節(jié)與監(jiān)視的作用。在受到刺激后,KCs將釋放大量細(xì)胞因子、趨化因子、炎癥介質(zhì)、活性氧中間產(chǎn)物和一些其他的因子[8]。
3 KCs的功能
KCs在多種肝臟疾病中發(fā)揮重要作用。發(fā)生急性肝衰竭時(shí),損傷相關(guān)分子模式(DAMPs)釋放,激活固有免疫,KCs通過釋放炎癥因子和趨化因子產(chǎn)生炎癥環(huán)境;在NAFLD中,KCs被激活,TNF-α、IL等多種細(xì)胞因子,使NAFLD向非酒精性脂肪肝炎(NASH)進(jìn)展;KCs與自然殺傷(NK)細(xì)胞相互作用可能是肝纖維化過程中的一個(gè)調(diào)控因素[9],這對(duì)預(yù)防肝硬化有積極意義。
KCs在肝移植的IRI中也有重要作用。在肝臟IRI的熱缺血期,由于肝臟處于相對(duì)缺氧狀態(tài),無氧酵解增多易引起代謝性酸中毒,同時(shí)ATP的減少導(dǎo)致細(xì)胞膜離子交換紊亂,在這些因素的影響下,細(xì)胞內(nèi)鈣離子濃度上升,形成鈣超載。增多的鈣離子,一方面使黃嘌呤脫氫酶轉(zhuǎn)化為黃嘌呤氧化酶,這一轉(zhuǎn)變將加速氧自由基的產(chǎn)生,另一方面也激活了KCs,釋放細(xì)胞因子損傷肝臟。此外,冷缺血期主要損害肝非實(shí)質(zhì)性細(xì)胞,機(jī)制與熱缺血期類似,在這一階段,NF-κB受到應(yīng)激,活性增強(qiáng),使細(xì)胞因子基因表達(dá)增多[10]。在再灌注期,大量LPS隨血流進(jìn)入肝臟,與KCs表面受體結(jié)合,釋放細(xì)胞因子,導(dǎo)致肝臟炎癥反應(yīng)[11]。顯然,在整個(gè)肝移植IRI過程中,KCs都扮演著重要角色,因此,明確KCs的作用機(jī)制將有助于提高肝移植術(shù)后供體肝的存活率與功能。
4 KCs加重脂肪供肝IRI進(jìn)程的機(jī)制
脂肪供肝一般來源于NAFLD患者,其肝臟內(nèi)的KCs處于激活狀態(tài)[4],這是NAFLD發(fā)展為NASH的重要原因,也就是說相較于正常供肝,脂肪供肝本身的基礎(chǔ)條件較差。當(dāng)發(fā)生肝臟IRI,脂肪供肝內(nèi)的KCs進(jìn)一步激活,這可能與大量LPS的涌入、氧化應(yīng)激反應(yīng)以及極化狀態(tài)的轉(zhuǎn)變有關(guān)。
4.1 加重脂肪供肝IRI時(shí)KCs的激活與大量LPS的涌入有關(guān)
門靜脈血中含有許多微生物相關(guān)抗原,主要為革蘭氏陰性菌細(xì)胞壁成分LPS。正常情況下,外周靜脈血中的LPS含量極低,無法測(cè)得,但在門靜脈血中高達(dá)1.0 μg/L。在肝移植過程中,隨著再灌注的開始,門靜脈血流開放,KCs被進(jìn)入肝臟的LPS進(jìn)一步激活。KCs質(zhì)膜表面可表達(dá)多種受體,LPS一方面與LPS受體CD14結(jié)合,激活KCs釋放炎癥介質(zhì),另一方面與TLR4結(jié)合,通過引起KCs內(nèi)鈣超載激活NF-κB[12],大量釋放炎性因子、氧自由基及趨化因子。正常肝臟內(nèi)的KCs通過上調(diào)抗炎基因精氨酸酶1和IL-10來抑制LPS介導(dǎo)的炎癥反應(yīng),實(shí)現(xiàn)LPS耐受,但當(dāng)肝臟存在脂肪變性時(shí),這種保護(hù)機(jī)制受到了損害[13],所以在脂肪肝中,LPS涌入激活KCs后造成更重的炎癥損傷。
LPS激活KCs分泌多種炎性因子,包括TNF-α、INF、IL等。TNF-α是主要的炎性因子之一,低水平的TNF-α是肝細(xì)胞生長(zhǎng)分化與再生所必需的調(diào)節(jié)因子,而高水平的TNF-α主要誘導(dǎo)肝細(xì)胞的凋亡與壞死。正常狀態(tài)下TNF-α可以調(diào)控細(xì)胞的增殖、炎癥、凋亡等一系列病理生理過程;而在脂肪肝IRI中,大量釋放的TNF-α則導(dǎo)致肝臟損傷。已有研究表明,TNF-α的水平與供肝的損傷程度呈正相關(guān),高濃度TNF-α是LPS引起肝臟炎癥反應(yīng)以及肝細(xì)胞凋亡的主要原因[14]。IL在傳遞信息、激活調(diào)節(jié)免疫細(xì)胞及介導(dǎo)炎癥反應(yīng)中起重要作用,其中IL-1β、IL-18等促炎因子主要來源于NLRP3炎癥小體。NLRP3被KCs激活后發(fā)生寡聚化并招募適配器蛋白,然后與caspase-1結(jié)合,形成炎癥小體,導(dǎo)致caspase-1的裂解和活化,促進(jìn)了IL-1β和IL-18的成熟和分泌[15]。INF是一種主要用于抗病毒的糖蛋白,同時(shí)也有免疫調(diào)節(jié)的作用,它與TNF-α以及IL-2、IL-12都能增強(qiáng)NK細(xì)胞活性,引起更強(qiáng)的移植物免疫排斥反應(yīng)。所有這些細(xì)胞因子,除了介導(dǎo)炎癥反應(yīng),還會(huì)導(dǎo)致細(xì)胞間黏附分子(intercellular adhesion molecule,ICAM)和內(nèi)皮細(xì)胞黏附分子(endothelial cell adhesion molecule,ECAM)表達(dá)的上調(diào),同時(shí),血管內(nèi)皮細(xì)胞產(chǎn)生了PAF[16]。因此,大量白細(xì)胞和血小板聚集于肝血竇區(qū),引發(fā)“無復(fù)流”現(xiàn)象,使肝臟缺血缺氧,間接對(duì)肝臟造成了損害。
趨化因子是一類可溶性細(xì)胞因子,它作為趨化劑引導(dǎo)細(xì)胞,特別是免疫細(xì)胞的遷移[17]。KCs經(jīng)LPS激活后產(chǎn)生的趨化因子CCL2(也稱為MCP1)是肝內(nèi)主要的促纖維化細(xì)胞,它可以聚集淋巴細(xì)胞和中性粒細(xì)胞浸潤(rùn)肝組織,釋放蛋白水解酶,損傷內(nèi)皮細(xì)胞和肝實(shí)質(zhì)細(xì)胞。同時(shí),大量細(xì)胞的聚集加劇了前文所述炎癥因子引起的肝血竇區(qū)“無復(fù)流”現(xiàn)象,使得肝內(nèi)血流灌注進(jìn)一步減少,加重肝組織損傷[18]。
4.2 加重脂肪供肝IRI時(shí)KCs的激活與氧化應(yīng)激有關(guān)
KCs的氧化應(yīng)激是早期損傷的表現(xiàn),此時(shí)KCs產(chǎn)生和釋放活性氧(reactive oxygen species,ROS),包括超氧陰離子和過氧化氫,對(duì)肝臟造成急性損傷[19]。ROS一方面可以損傷呼吸鏈中的酶復(fù)合物,引起細(xì)胞凋亡,另一方面可以上調(diào)促炎因子,造成炎癥損傷。當(dāng)發(fā)生IRI時(shí),由炎癥小體介導(dǎo)的無菌性炎癥反應(yīng)過程被啟動(dòng),其中NLRP3炎性小體發(fā)揮主要作用[20],而KCs產(chǎn)生的大量ROS可通過各種途徑激活NLRP3炎性小體,最終產(chǎn)生炎癥反應(yīng)。在脂肪供肝中,會(huì)產(chǎn)生更多的ROS,加重了肝臟IRI[21]。Yang等[22]認(rèn)為,其中的機(jī)制可能與以下有關(guān):(1)脂肪變性導(dǎo)致細(xì)胞體積增大,肝血竇減小,脂肪肝本就處在相對(duì)缺血缺氧的環(huán)境;(2)線粒體氧化不足,生成的ATP無法滿足缺血再灌注過程中的能量需求,就會(huì)產(chǎn)生更多的ROS;(3)脂肪肝內(nèi)KCs處于應(yīng)激狀態(tài),非IRI狀態(tài)下也會(huì)生成炎癥因子。也有研究指出,脂肪供肝在IRI過程中線粒體損傷加重,線粒體氧化應(yīng)激和脂質(zhì)過氧化作用增加,除了ROS的增多,抗氧化防御機(jī)制也受到損害,因此受到更重?fù)p傷。
4.3 脂肪供肝IRI時(shí)KCs的激活與極化狀態(tài)的轉(zhuǎn)變有關(guān)
KCs有兩種表型,M1型為經(jīng)典激活型,參與機(jī)體炎癥、防御反應(yīng),此時(shí)主要釋放TNF-α等促炎因子;M2型為替代激活型,參與機(jī)體抗炎、修復(fù)作用,此時(shí)IL-10等抗炎因子顯著增多。當(dāng)環(huán)境發(fā)生改變,KCs誘導(dǎo)分化為不同表型,發(fā)揮不同的功能,在適當(dāng)條件下兩種表型還可相互轉(zhuǎn)化[23]。正常狀態(tài)KCs為M2型,當(dāng)肝臟發(fā)生脂肪變性,分解出的一些促炎脂肪酸將募集單核細(xì)胞,并在脂肪組織內(nèi)將其轉(zhuǎn)化為M1型的KCs,在IRI過程中,TLR的激活以及ROS的產(chǎn)生,也會(huì)將KCs轉(zhuǎn)化為M1型。所以在肝移植過程中,脂肪供肝內(nèi)的KCs偏向M1型,其炎癥反應(yīng)也強(qiáng)于正常供肝[24]。
5 KCs減輕脂肪供肝IRI的機(jī)制
除了損傷作用,KCs對(duì)肝臟也存在著保護(hù)作用,前文提到替代激活的M2型KCs參與機(jī)體抗炎,并能修復(fù)組織,這主要通過產(chǎn)生一些生物活性物質(zhì)或上調(diào)表達(dá)一些酶類來實(shí)現(xiàn)。M2型KCs可以產(chǎn)生抑制性細(xì)胞因子IL-10,使T細(xì)胞失功能或無功能,或是表達(dá)凋亡相關(guān)因子配體(FasL)和腫瘤壞死因子相關(guān)凋亡誘導(dǎo)配體(TRAIL),引發(fā)T細(xì)胞凋亡,從而實(shí)現(xiàn)肝臟的免疫耐受[25],這將減輕缺血再灌注損害后移植物的排斥反應(yīng)。另外,KCs可以生成可誘導(dǎo)一氧化氮合酶(inducible nitric oxide synthase,iNOS),KCs激活iNOS后,促進(jìn)了NO的生成。NO是一種重要的血管擴(kuò)張劑,有研究證實(shí)NO因其抑制血小板聚集、擴(kuò)張血管的功能,在肝的缺血再灌注損傷中發(fā)揮了保護(hù)作用[26]。同時(shí),KCs會(huì)生成血紅素加氧酶-1(hemeoxygenase-1,HO-1),主要分布于KCs的內(nèi)質(zhì)網(wǎng)與核周外模,具有抗氧化、抗炎、抗凋亡以及抑制血小板聚集的作用[27]。Zeng 等[11]證明,HO-1增加后,大鼠血清中多種炎性因子的含量下降,從而減輕IRI。還有研究證明,外源性上調(diào)HO-1表達(dá)后,可以顯著保護(hù)肥胖Zucker大鼠的脂肪化肝臟,減少脂肪肝IRI[28]。HO-1還可以通過降解血紅素的產(chǎn)物CO來發(fā)揮保護(hù)作用。CO可以使KCs生成的TNF-α和IL-6減少,也可以下調(diào)因LPS激活KCs產(chǎn)生的炎癥反應(yīng),這些都改善了肝臟IRI。
總的來說,LPS與KCs表面受體CD14及TLR4結(jié)合后激活NF-κB,一方面釋放大量炎癥因子,包括TNF-α、INF、IL-2、IL-12,在造成直接肝臟損傷的同時(shí),導(dǎo)致ICAM與ECAM表達(dá)上調(diào),造成間接肝臟損害;同時(shí)也生成更多的ROS,激活NLRP3炎癥小體生成IL-1β和IL-18,引起炎癥反應(yīng),加重肝臟IRI。另一方面釋放IL-10及HO-1,HO-1還能生成CO,這些細(xì)胞因子都可以抑制炎癥因子,減輕炎癥反應(yīng);而其釋放的iNOS可以生成血管擴(kuò)張劑NO,對(duì)肝臟IRI也有緩解作用(圖1)。
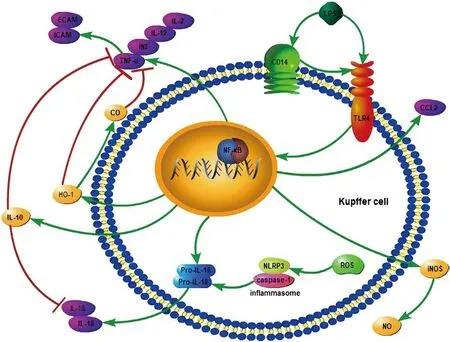
圖1 LPS激活KCs引起雙向作用:LPS與KCs表面受體CD14及TLR4結(jié)合后激活NF-κB,一方面釋放大量炎癥因子,包括TNF-α、INF、IL-2、IL-12,導(dǎo)致ICAM與ECAM表達(dá)上調(diào);同時(shí)生成更多ROS,激活NLRP3炎癥小體生成IL-1β和IL-18。另一方面釋放抗炎因子,如IL-10、HO-1及iNOS,HO-1生成CO,iNOS生成NO。
6 小結(jié)
IRI是肝移植術(shù)后供體肝功能受損和失功能的重要原因,是多因子共同作用造成損傷的持續(xù)過程,KCs在其中起到重要作用。對(duì)于脂肪肝供肝,肝實(shí)質(zhì)細(xì)胞脂肪變性及肝非實(shí)質(zhì)細(xì)胞激活狀態(tài)使其處在一個(gè)相對(duì)缺血缺氧且促炎的環(huán)境。所以當(dāng)IRI發(fā)生,LPS涌入后激活KCs釋放大量細(xì)胞因子,脂肪肝表現(xiàn)出更差的耐受力,而脂肪變性導(dǎo)致的氧化應(yīng)激加劇以及KCs極化狀態(tài)向促炎型改變也使脂肪肝在IRI中受到更重的損傷。除了損傷作用,KCs對(duì)肝臟也存在著保護(hù)作用,激活的M2型KCs參與機(jī)體抗炎,并能修復(fù)組織。當(dāng)前,脂肪供肝在肝移植術(shù)中應(yīng)用增多是無法逆轉(zhuǎn)的趨勢(shì),研究如何減輕脂肪肝IRI具有重要意義,而KCs顯然是一個(gè)重要的靶點(diǎn)。

