磁微粒吖啶酯化學發光法檢測AMH的性能評估及成年女性AMH參考區間的建立
岳朝艷,段朝暉,章 迪,韋 婕,羅曉紅,張倩嵐,伍 勇,應春妹
(1.復旦大學附屬婦產科醫院,上海 200011;2.中山大學孫逸仙紀念醫院,廣東 廣州 510120;3.中南大學湘雅三醫院,湖南 長沙 410205 )
抗苗勒管激素(anti-mullerian hormone,AMH)是轉化生長因子β超家族的一員,由2個相對分子質量為72 000的二聚體單體組成,通過二硫鍵連接。女性AMH由卵泡顆粒細胞合成,是調節卵泡成熟的關鍵激素。AMH反映了卵巢竇狀卵泡和竇前卵泡的數量,也有助于評估卵巢功能[1]。目前,檢測AMH的方法主要為酶聯免疫吸附試驗和化學發光法。酶聯免疫吸附試驗結果易受多種因素影響[2-4],隨著檢測需求的增多,自動化免疫學方法可能更適用臨床。本研究依據美國臨床實驗室標準化協會(the Clinical and Laboratory Standards Institute,CLSI)發布的EP系列文件對國產磁微粒吖啶酯化學發光法檢測AMH的性能進行驗證和評估,并建立我國成年女性AMH的參考區間。
1 材料和方法
1.1 研究對象
選取2018年1—12月女性健康體檢者1 089名,其中349名來自復旦大學附屬婦產科醫院、464名來自中南大學湘雅三醫院、276名來自中山大學孫逸仙紀念醫院。180例用于相關性分析的樣本包括104名健康女性、21例卵巢早衰患者、55例多囊卵巢綜合征患者。健康女性來自復旦大學附屬婦產科醫院體檢中心,卵巢早衰和多囊卵巢綜合征均為復旦大學附屬婦產科醫院生殖內分泌門診確診患者。健康女性納入標準:女性;年齡20~60歲;無自身免疫性疾病或炎癥性疾病;近3個月內無激素治療史,如雌激素、孕激素或口服避孕藥物;無卵巢切除手術史;無多囊卵巢綜合征;體質量指數(body mass index,BMI)<26.9 kg/m2。
1.2 方法
1.2.1 儀器和試劑 iFlash 3000化學發光免疫分析儀(深圳市亞輝龍生物科技股份有限公司)及配套AMH試劑(磁微粒吖啶酯化學發光法)。cobas e601全自動電化學發光免疫分析儀及配套AMH試劑(電化學發光法)。
1.2.2 樣本采集 采用分離膠/促凝劑采血管采集所有對象靜脈血5 mL,靜置30 min,1 000×g離心15 min。所有樣本均在采集后2 h內處理完畢,-80 ℃保存,統一檢測。所有樣本均僅解凍1次。
1.2.3 性能評估 性能評價項目包括空白限、檢測限、定量限、精密度(重復性、批間精密度和總不精密度)及與電化學發光法的比對。所有性能評估實驗均在復旦大學附屬婦產科醫院檢驗科完成。空白限、檢測限和定量限根據CLSI EP17-A2文件[5]的要求確定。精密度根據CLSI EP5-A3文件[6]的要求確定。在CLSI EP6-A文件[7]要求的基礎上,采用多項回歸分析進行線性范圍驗證,線性驗證實驗結果為一階方程式判定為線性,檢測樣本的最低值和最高值之間為線性區間。
1.2.4 方法學比對和偏移評估 以電化學發光法為參比方法,磁微粒吖啶酯化學發光法為實驗方法。采用2種方法同時檢測104名健康女性、21例卵巢早衰患者、55例多囊卵巢綜合征患者的血清AMH水平。2種方法的相關性采用線性回歸方程Y=bX+a評估。偏移評估:將給定的醫學決定水平(Xc)代入線性回歸方程,計算實驗方法(Y)與參比方法(X)之間的系統誤差(systematic error,SE)和相對偏移(SE%),SE=Yc-Xc,SE%=SE/Xc×100%。方法學評估的SE%低于室間質量評價允許誤差范圍,則認為不同檢測系統間的測定結果具有可比性。
1.2.5 不同樣本類型的比較 分別采用不同的采血管[無抗凝劑真空管、分離膠促凝劑管、肝素鋰抗凝管、檸檬酸鈉抗凝管、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝管]采集11名健康體檢者全血,進行配對比較,計算不同抗凝管樣本與無抗凝劑真空管樣本之間的Passing-Bablok回歸方程及平均偏差。試驗均在復旦大學附屬婦產科醫院檢驗科完成。
1.2.6 血清樣本在不同保存時間和保存溫度下的穩定性 收集11名健康體檢者的血清樣本,立即采用磁微粒吖啶酯化學發光法檢測AMH,以此作為基線水平,AMH范圍為0.68~18.48 ng/mL。然后將每份血清等分為17份,分別保存于室溫(20~25℃)、4 ℃、-20 ℃和-80 ℃,每天檢測1份樣本,共檢測7 d。計算不同時間、不同保存溫度的樣本的檢測結果與基線水平的平均百分差值。試驗均在復旦大學附屬婦產科醫院檢驗科完成。
1.2.7 磁微粒吖啶酯化學發光法成年女性AMH參考區間的建立 將1 089名健康體檢女性按年齡分組(20~24歲、25~29歲、30~34歲、35~39歲、40~44歲、45~49歲和≥50歲),采用磁微粒吖啶酯化學發光法檢測血清AMH水平。檢測分別在復旦大學附屬婦產科醫院檢驗科、中南大學湘雅三醫院檢驗科和中山大學孫逸仙紀念醫院檢驗科完成,檢測系統校準合格,室內質控在控。選擇AMH檢測結果的第2.5百分位數(P2.5)~第97.5百分位數(P97.5)作為參考區間。
1.3 統計學方法
采用GraphPad Prism 5.0軟件和MedCalc 11.4軟件進行統計分析。呈正態分布的數據以±s表示,2個組之間比較采用獨立樣本t檢驗,多組間比較采用方差分析。呈非正態分布的數據以中位數(M)[四分位數(P25~P75)]表示,組間比較采用非參數Mann-WhitneyU檢驗,Z值<Z*值表示不需分組。以P<0.05為差異有統計學意義。
2 結果
2.1 磁微粒吖啶酯化學發光法檢測性能的驗證
磁微粒吖啶酯化學發光法檢測AMH的空白限為0.001 ng/mL,檢出限為0.02 ng/mL,定量限為0.08 ng/mL。低值樣本的重復性為1.3%、批間精密度為2.2%、總不精密度為3.2%。高值樣本的重復性為1.6%、批間精密度為2.1%、總不精密度為3.1%、線性范圍為0.02~27.22 ng/mL。2種方法的檢測性能見表1。

表1 磁微粒吖啶酯化學發光法和電化學發光法檢測AMH的性能
2.2 磁微粒吖啶酯化學發光法與電化學發光法的相關性
磁微粒吖啶酯化學發光法與電化學發光法的線性回歸方程為Y=0.998 8X+0.179 5(r=0.975 3,P<0.05),2種方法的相關性良好。
2.3 磁微粒吖啶酯化學發光法與電化學發光法檢測AMH的偏移評估
以電化學發光法為參比方法,磁微粒吖啶酯化學發光法檢測AMH低值(1 ng/mL)的相對偏移為17.8%,絕對偏差為0.178 3 ng/mL,可滿足臨床需求。其他濃度的相對偏移和絕對偏差均在允許范圍內。2種方法的一致性較好。見表2。

表2 磁微粒吖啶酯化學發光法與電化學發光法檢測AMH的偏移評估
2.4 不同抗凝管樣本與無促凝劑真空管樣本的比較
不同抗凝管樣本與無促凝劑真空管樣本比較,檢測結果均呈線性相關。因此,血清和血漿均可作為磁微粒吖啶酯化學發光法檢測AMH的樣本。見表3。

表3 不同抗凝管樣本與無促凝劑真空管樣本的比較
2.5 不同保存時間和保存溫度的穩定性比較
血清樣本在室溫(20~25 ℃)條件下可穩定3 d,在4、-20、-80 ℃條件下可穩定7 d,見圖1。

圖1 AMH檢測的穩定性
2.6 成年女性AMH參考區間及變化趨勢
成年女性AMH參考區間的建立基于多中心研究,本研究覆蓋了3個不同的地區,結果顯示,3個地區AMH水平差異均無統計學意義。見表4。
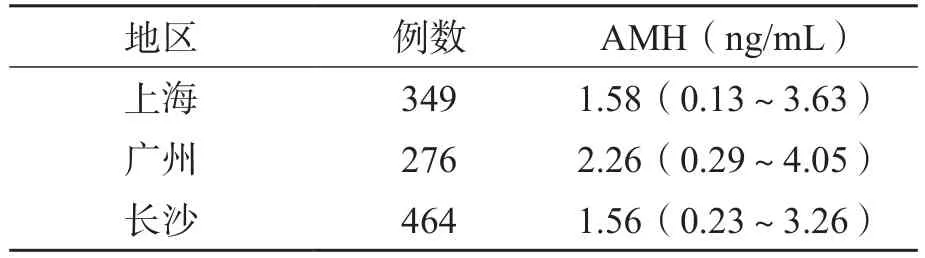
表4 各地區AMH水平比較 M(P25~P75)
按年齡分組后顯示,50歲以上的婦女AMH水平很低,因此歸為1個年齡組。以檢測結果的P2.5~P97.5作為參考范圍。20~24歲、25~29歲、30~34歲、35~39歲、40~44歲、45~49歲和≥50歲的成年女性的AMH參考區間分別為1.20~10.21、1.14~9.17、0.55~8.18、0.25~7.02、0.07~4.59、0.01~2.11、<0.39 ng/mL,見表5。回歸模型顯示血清AMH水平隨年齡的增長而下降,見圖2。
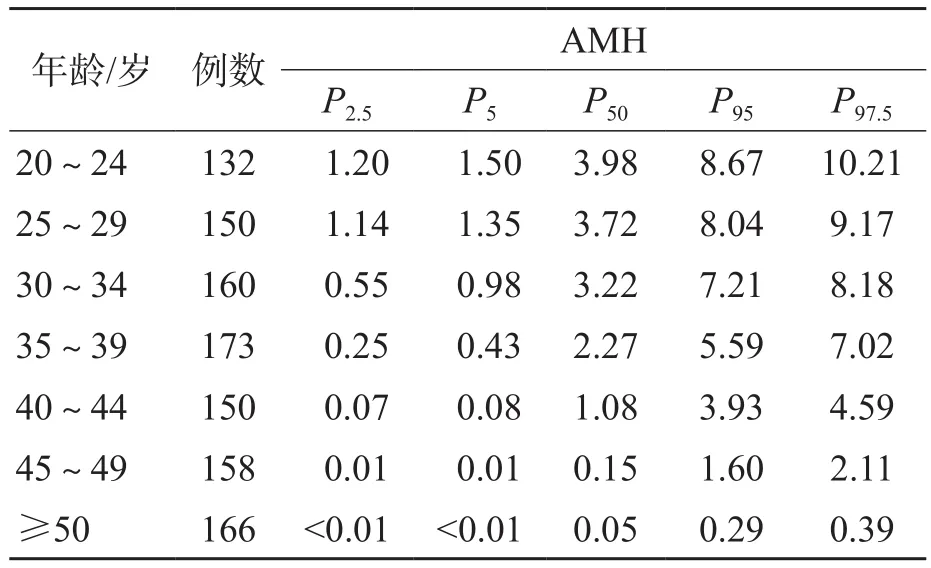
表5 成年女性血清AMH的參考區間 ng/mL
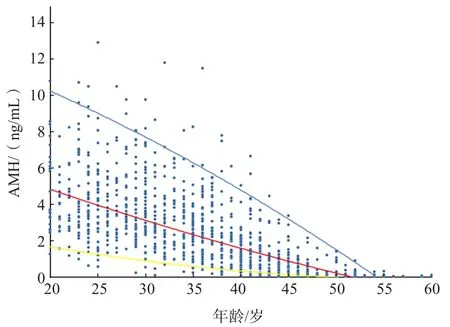
圖2 AMH隨年齡變化的趨勢
3 討論
血清AMH水平可以準確反映竇狀卵泡的儲備,是評估卵巢儲備功能的可靠指標。AMH與經陰道超聲評估的竇狀卵泡數有強相關性,AMH和竇狀卵泡數與存在于卵巢組織中的原始卵泡數量之間也有良好的相關性[8-9]。AMH水平能夠反映卵細胞以及卵泡池隨著年齡增加不斷下降的趨勢,因此可用于判斷卵巢老化程度及更年期預測[10-11]。在卵巢儲備功能降低、早發性卵巢功能不全和卵巢早衰出現癥狀之前,AMH是目前最早、最準確的血清學診斷指標之一[12]。AMH在卵巢功能不全時顯著降低,提示卵泡池過早耗盡。AMH除了預測生殖壽命之外,還可用于優化生育治療,在進行體外受精聯合胚胎移植術時可用AMH來預測結果,其中最重要的是預測卵巢反應情況,有助于判定卵巢超刺激的個體化方案。AMH還有助于評估早期診斷卵巢功能失調,特別是多囊卵巢綜合征,為臨床決策提供合理參考。雖然AMH在臨床上應用廣泛,但目前國內尚無統一的血清AMH參考區間。根據ISO15189:2003(E)標準的要求,實驗室必須為臨床提供本地區檢驗項目可靠的參考區間,以便為臨床上區分健康與患病、診斷、預防及治療提供高質量的保證。
本研究使用的AMH檢測試劑(磁微粒吖啶酯化學發光法)使用了2個小鼠單克隆抗體,分別針對AMH分子上的pro-和mature-區域。樣本中的AMH、抗AMH包覆的順磁性微粒與吖啶標記的抗AMH共軛反應形成“三明治”復合物,同時檢測AMH的非共價復合物形式和未切割的pro-AMH;該方法使用的抗體只特異性地與人源性的AMH結合,避免了其他種屬的干擾,可以有效提高檢測的敏感性和特異性[13-14]。
準確的AMH參考區間是其臨床應用的必要條件。美國貝克曼庫爾特公司和瑞士羅氏公司的AMH檢測系統可以溯源至AMH GEN Ⅱ酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)。雖然美國貝克曼庫爾特公司的化學發光法與瑞士羅氏公司的電化學發光法具有可比性,但這2種方法的檢測結果與ELISA的檢測結果有一定差異。美國貝克曼庫爾特公司新的化學發光法使用了與AMH GEN ⅡELISA方法類似的校正材料,其AMH檢測結果仍比AMH GEN Ⅱ ELISA平均低22%[15]。然而,DEMIRDJIAN等[11]的研究結果顯示,美國貝克曼庫爾特公司的化學發光法AMH檢測結果與AMH GEN Ⅱ ELISA具有可比性[16]。這些互相矛盾的結論可能是由于ELISA的準確性和重復性較低所致。雖然AMH GEN Ⅱ ELISA已被廣泛應用,但使用相同單克隆抗體的試劑盒相對不穩定。為此,美國貝克曼庫爾特公司發布了一份“現場安全通知”(FSN-20434-3),內容涉及在將樣本添加到反應板之前與稀釋液預混合,該程序可消除補體干擾。
血液中AMH由pro-AMH和AMHNC 2個部分組成,前者為非活性的未裂解前體,后者為酶裂解、受體活性形式。AMH GEN Ⅱ ELISA可同時檢測出重組pro-AMH和AMHNC[16]。瑞士羅氏公司和美國貝克曼庫爾特公司的AMH檢測抗體使用了2種小鼠單克隆抗體,第1種是生物素標記的AMH特異性小鼠單克隆抗體(Mab F2B/12H;IgG2a亞類),第2種是磺基釕標記的AMH小鼠檢測單克隆抗體(Mab F2B/7A;IgG2b亞類)。這2種單克隆抗體都來自美國貝克曼庫爾特公司。抗體優先與AMH mature-區域(Mab F2B/12H)和AMH pro-區域(Mab F2B/7A)結合[16-18]。AMH標準品的缺乏是導致AMH檢測結果出現差異的重要因素,因此目前迫切需要對AMH標準品達成一致,以便對AMH的檢測系統進行校準,避免檢測報告與結果解釋的混亂。美國貝克曼庫爾特公司的化學發光法和瑞士羅氏公司的電化學發光法AMH檢測結果可以溯源至AMH GEN Ⅱ ELISA。本研究使用的磁微粒吖啶酯化學發光法可溯源至羅氏的化學發光法Elecsys AMH[19]。
綜上所述,磁微粒吖啶酯化學發光法檢測AMH的性能參數(空白限、檢出限、定量限、精密度、線性范圍)均符合驗證要求,與電化學發光法有較高的相關性,且血清樣本在不同儲存時間和不同貯藏溫度下檢測AMH均有較好的穩定性,可提供可靠的檢驗結果。另外,本研究還初步建立了成年女性AMH的參考區間,可為臨床正確解釋AMH水平提供更可靠的參考,為AMH項目在臨床上的廣泛開展提供科學依據。

