響應面法優化淀粉葡糖苷酶的酶反應體系
張程慧 馮敘橋
(遼寧省食品安全重點實驗室;渤海大學食品科學與工程學院,錦州 121013)
淀粉是人類膳食中重要碳水化合物,是人體內能量代謝葡萄糖的主要來源[1-3]。淀粉葡糖苷酶(Amyloglucosidase, EC 3.2.1.3)是一種單鏈的酸性糖苷水解酶,能夠從淀粉或類似物分子的非還原末端切開α-1,4-糖苷鍵,也能夠水解α-1,6-糖苷鍵和α-1,3-糖苷鍵,是除α-淀粉酶(α-Amylase, EC 3.2.1.1)外能夠將淀粉轉化為葡萄糖的另一重要糖苷酶(Glycosidase, EC 3.2.1),且其水解淀粉最終產物全部為葡萄糖[4-6]。可見淀粉葡糖苷酶能夠參與人體內的糖降解反應,使得血糖高低受其影響較大。
糖尿病是一種以高血糖為主要標志的多病因代謝疾病,控制餐后血糖是目前預防糖尿病及其并發癥的有效手段[2,4,7]。隨著病癥的嚴重化,控制高血糖的難度也增強,而治療糖尿病的常見藥物有胰島素及其類似物、二甲雙胍或糖苷酶抑制劑等[8-10],大多數降糖藥物短期內具有良好降血糖作用,但長期服用則會損害身體各個器官,甚至引發嚴重并發癥[8,11,12]。而糖苷酶抑制劑主要通過抑制小腸刷狀緣糖苷酶的活性,延緩淀粉、蔗糖、麥芽糖等糖類物質轉化為可吸收的葡萄糖[13,14],因而通過糖苷酶抑制劑抑制淀粉葡糖苷酶活性來達到控制糖尿病患者體內的血糖水平的目的具有重要意義,因此建立良好的酶反應體系有利于對糖苷酶抑制劑進行篩選。
酶反應體系受酶、底物、抑制劑、反應時間、溫度等多個因素共同影響[15-17],其中底物濃度、酶濃度以及反應時間對酶反應的影響較大[17-19],本研究就這3個主要因素進行考察,以淀粉葡糖苷酶為代表性糖苷酶,在參照人體生理數值基礎上,為這種酶建立相應優化的酶反應體系。4-硝基-α-D-吡喃葡萄糖苷(pNPG)是一種人工合成物質,常被用來作為糖苷酶抑制研究中的底物,但人體內不存在且也不會通過飲食攝入pNPG,另外其研究費用較高[20];而實驗選用淀粉作為淀粉葡糖苷酶直接作用的天然底物對象,不僅費用低,更期望降低以pNPG為底物模型的較高假陽性率[20,21],通過對可溶性淀粉濃度、淀粉葡糖苷酶濃度、反應時間的控制,使淀粉葡糖苷酶在所建立的反應體系基礎上能夠最大化地發揮優良活性,以便后期獲得糖苷酶抑制劑在此體系下所能發揮最大抑制效果的可信度較高的數據。
1 材料與方法
1.1 材料與試劑
淀粉葡糖苷酶(CAS:9032-08-0;酶活力:275 U/mL;酶來源:黑曲霉);重蒸酚(批號:1129I021);可溶性淀粉、無水亞硫酸鈉、氫氧化鈉、磷酸二氫鈉、磷酸氫二鈉、酒石酸鉀鈉葡萄糖等均為分析純。
1.2 儀器與設備
Perkin elmer Victor X 酶標儀,KK21V1160W 冰箱,HH-2數顯恒溫水浴鍋,FE20實驗室pH計,DHG-9053A電熱恒溫鼓風干燥箱。
1.3 實驗方法
1.3.1 葡萄糖標準曲線的繪制
按照文獻[22]方法稍作修改。配制1 mg/mL 的葡萄糖標準溶液,并分別取2 mL稀釋后的0、0.125、0.250、0.375、0.500、0.625、0.750 mg/mL葡萄糖液于試管,每管加入1.5 mL由實驗室配制的DNS試劑,搖勻后沸水浴5 min,加熱結束后立即冷卻,放置20 min加適量水稀釋,測定540 nm吸光度值。以葡萄糖濃度(x)為橫坐標,吸光度值(y)為縱坐標繪制標準曲線,得到回歸方程y=1.303x+0.003,其中R2=0.999 5。
1.3.2 單因素實驗
1.3.2.1 可溶性淀粉濃度的確定
參照前人方法并稍作修改[16,23]。反應總體積設定為2.00 mL,吸取一定體積的(0.1 mol/L,37 ℃下pH 6.80 ~ 6.81)磷酸鈉緩沖液和質量濃度分別為3.0、6.0、8.0、10.0、12.0、14.0 mg/mL,0.50 mL的可溶性淀粉溶液混合于(37.0±0.2) ℃水浴預孵5 min,同時取(0.50 U/mL,0.10 mL)淀粉葡糖苷酶溶液于(55.0±0.2) ℃下預孵5 min,將酶液與淀粉溶液混合并于(37.0±0.2) ℃下反應10 min,以1.50 mL DNS試劑終止整個反應體系,并在沸水浴中加熱5 min,流水冷卻至室溫后放置20 min,適當稀釋后在540 nm下測定吸光度OD值。以葡萄糖作為終產物進行定量分析,在保證反應總體積不變的情況下,以每個淀粉濃度下不加酶的混合液作為空白對照,可得到一系列不同淀粉濃度下酶的反應速度。
1.3.2.2 淀粉葡糖苷酶濃度的確定
分別在添加了淀粉的固定反應體系中加入經預孵處理的不同酶濃度(0.25、0.50、0.75、1.00、1.25、1.50 U/mL)的淀粉葡糖苷酶0.10 mL,混合反應10 min,加入1.5 mL DNS試劑,沸水浴后立即冷卻至室溫并放置20分鐘,稀釋后測定樣品吸光度OD值。探討不同淀粉葡糖苷酶濃度對葡萄糖生成量的影響,在保證反應總體積和淀粉濃度不變的情況下,以此淀粉濃度下的不加酶混合液作為空白對照。
1.3.2.3 反應時間的確定
在反應體系中酶液與淀粉溶液混合后,分別反應2.5、5、7.5、10、15、20、25 min,以1.50 mL DNS試劑終止整個反應體系,稀釋后測定吸光度OD值,以反應時間0 min為空白對照。
1.3.3 響應面分析法實驗設計
在淀粉葡糖苷酶促反應中,以單位量的樣品在一定時間內生成的葡萄糖的量即酶促反應速度表示酶活力[15,20]。在單因素實驗基礎上,選擇可溶性淀粉濃度(X1)、淀粉葡糖苷酶濃度(X2)、反應時間(X3)因素設計響應面實驗,且以反應速度為響應值(Y)進行響應面分析,通過優化酶促反應條件,建立檢測糖苷酶活性的體外反應體系以便后期進行糖苷酶抑制劑的體外篩選實驗。反應體系的因素與水平設計見表1。

表1 淀粉葡糖苷酶反應體系響應面分析法的因素與水平
1.3.4 數據統計與分析
所有實驗均重復3次或3次以上,所得數據以平均值±標準差表示,采用Excel 2003進行公式計算及數據儲存,用SPSS 20.0進行統計學分析及相關性分析,顯著性檢驗采用單因素方差分析(one-way ANOVA),及利用Design-Expert 8.0.6軟件進行Box-Behnken實驗設計及對實驗結果進行回歸分析與方差分析,并用Origin 7.0軟件對實驗數據進行繪圖。
2 結果與分析
2.1 單因素實驗分析
2.1.1 可溶性淀粉濃度的確定
酶促反應體系中,底物濃度對酶促反應速度的影響較大[24]。從圖1可知,在保持酶濃度不變的情況下,淀粉濃度從0上升到10 mg/mL這一過程中,淀粉葡糖苷酶的酶活不斷增強,因而酶促反應速度呈增大趨勢;但由于酶添加量固定,不斷增大淀粉濃度會使淀粉葡糖苷酶被飽和,以至于在較大淀粉濃度下的酶反應速度呈現保持增長自增長緩慢的趨勢;當淀粉濃度達到10 mg/mL時,此時酶促反應速度已達到最大值且最終趨于穩定(P>0.05),因而淀粉葡糖苷酶的酶反應體系中可溶性淀粉濃度選擇10 mg/mL為宜。
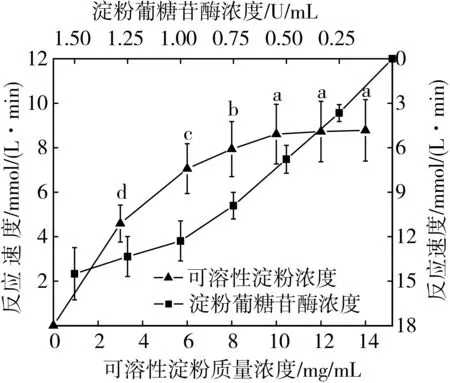
圖1 可溶性淀粉質量濃度、淀粉葡糖苷酶濃度與反應速度的關系
2.1.2 淀粉葡糖苷酶濃度的確定
在底物充足且能夠使酶飽和的條件下,酶促反應速度與酶濃度成正比關系[20,24]。如圖1所示,當酶濃度控制在0~1.00 U/mL時,反應速度與酶濃度呈良好線性關系(R2=0.994 8),當酶濃度超過1.00 U/mL時,其酶促反應速度仍在增加但增長幅度明顯降低,可能是高濃度酶大量消耗淀粉,產物的快速生成抑制了淀粉葡糖苷酶活性,以致反應速度后呈緩慢增長趨勢,因此,淀粉葡糖苷酶的酶反應體系中淀粉葡糖苷酶濃度選擇1.00 U/mL為宜。
2.1.3 淀粉葡糖苷酶酶促反應時間的確定
如圖2所示,在反應10 min時間內,吸光度與葡萄糖生成量成正比,因而以OD540值與反應時間作圖,得出反應時間與葡萄糖生成量呈良好的線性關系(R2=0.992 6)的結果;同樣,在反應前10 min內,淀粉葡糖苷酶的酶促反應速度可達到最大,但反應到第10 min時,反應速度已略有下降但下降并不明顯(P>0.05),隨著反應時間延長,反應速度顯著下降。過早停止反應會導致產物濃度低,因此,在淀粉添加過量的前提下,為保證一定的葡萄糖生成量和較大的反應速度,淀粉葡糖苷酶的酶反應體系中反應時間選擇10 min為宜。
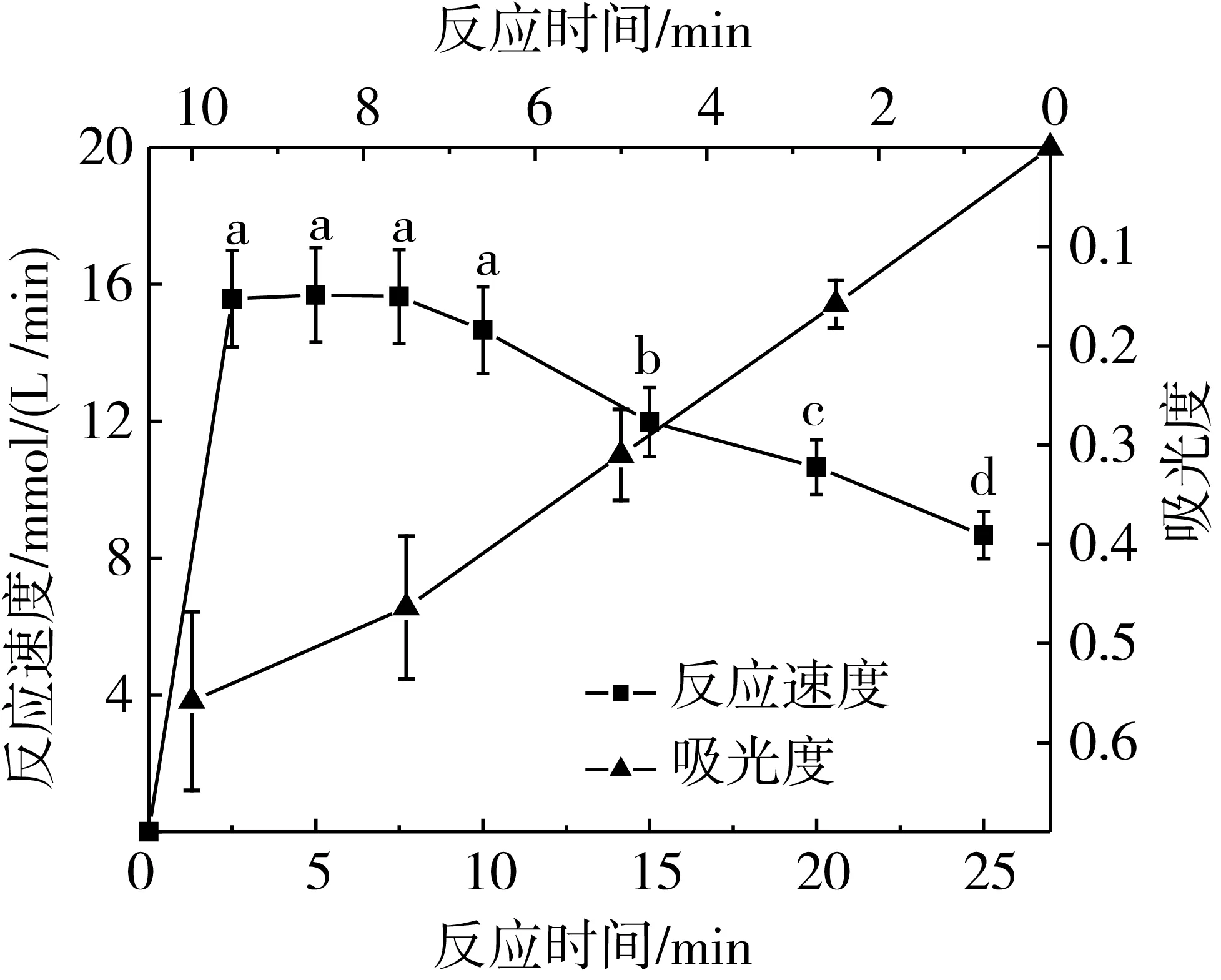
圖2 淀粉葡糖苷酶酶促反應時間與葡萄糖生成量、反應速度的關系
2.2 淀粉葡糖苷酶反應體系響應面優化結果與分析
2.2.1 Box-Behnken實驗模型的建立與方差分析
對數據進行二次多項回歸擬合,建立二次響應面回歸模型,尋求最優響應因子水平,實驗設計與結果見表2。獲得描述淀粉葡糖苷酶的酶促反應速度與自變量可溶性淀粉濃度、淀粉葡糖苷酶濃度、反應時間的二次多項式:
Y=14.14+0.11X1+2.61X2-1.63X3+0.48X1X2-0.46X1X3+0.04X2X3-2.07X12-2.21X22-1.40X32
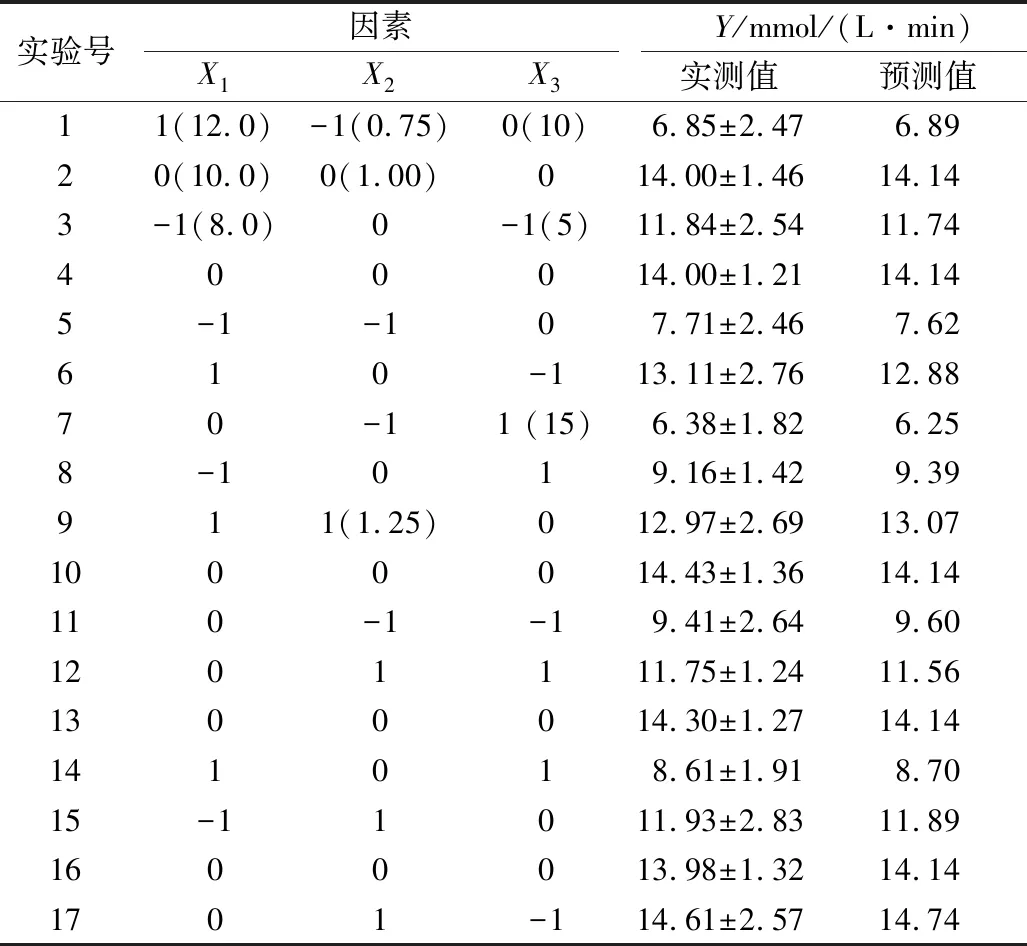
表2 Box-Behnken實驗設計及結果

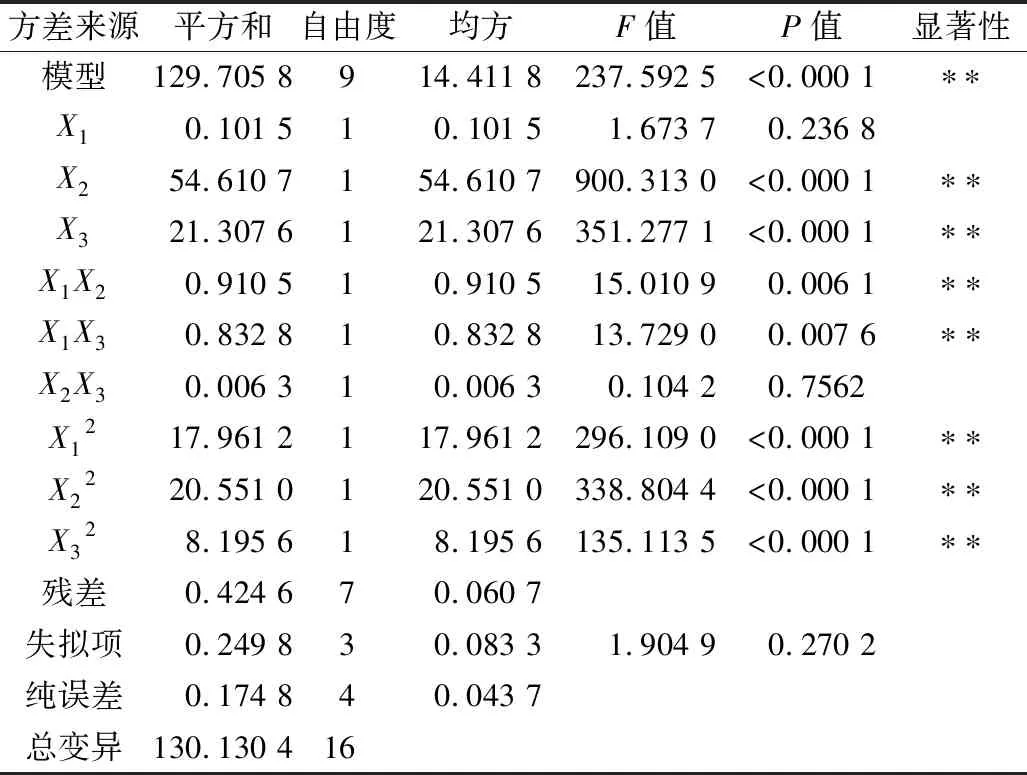
表3 回歸方程各項的方差分析
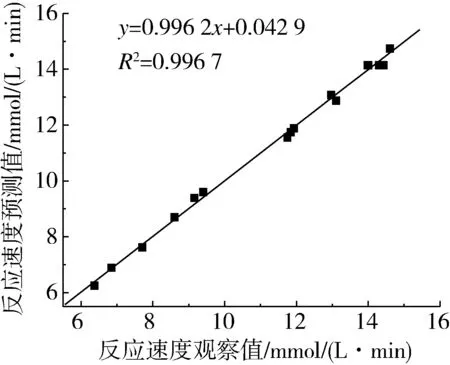
圖3 反應速度預測值與觀察值之間的相關性
2.2.2 響應曲面圖和等高線圖的分析
圖4是對響應值反應速度影響很大的兩因素交互作用的響應面圖,其等高線呈橢圓形且根據方差分析可知,因素之間的交互作用極顯著(P<0.01),其他因素交互作用不顯著。從圖4a可知,可溶性淀粉濃度與淀粉葡糖苷酶濃度的交互作用極顯著(P<0.01),說明可溶性淀粉濃度改變顯著影響淀粉葡糖苷酶的用量,反之也成立;當反應時間保持在零水平時,淀粉濃度與酶濃度對酶促反應速度的影響存在明顯的二次關系。可能是淀粉、淀粉與產物葡萄糖的過渡態以及與葡萄糖的結構之間存在相似性,淀粉葡糖苷酶與過渡態結構結合的同時也會部分結合淀粉和葡萄糖,使得酶內部淀粉和葡萄糖的能量狀態與游離淀粉和葡萄糖的不同,造成內、外部化學平衡的不同,其中淀粉葡糖苷酶與淀粉和葡萄糖復合物的相對穩定性由內部化學平衡決定,而相對穩定性則會影響酶活性,即影響體系的反應速度[25]。因而,當淀粉濃度一定時,淀粉葡糖苷酶的酶促反應速度隨著酶濃度的增大而增大,但當酶濃度達到1.15 U/mL后,反應速度的增緩幅度呈下降趨勢;當酶濃度一定時,過高至過低的淀粉濃度變量使得反應速度均呈先增大后變小趨勢,且在淀粉質量濃度為10.33 mg/mL處有最高值,說明淀粉葡糖苷酶的酶活性受到底物的影響,反應體系中淀粉質量濃度達到10.33 mg/mL時有利于酶發揮最大的活性。圖4b顯示了可溶性淀粉濃度與反應時間對淀粉葡糖苷酶的酶促反應速度的影響。可溶性淀粉濃度與反應時間的交互作用極顯著(P<0.01),在淀粉質量濃度為10.33 mg/mL,固定反應時間6.99 min時,兩因素之間的交互作用最好,且可以看出淀粉濃度對酶促反應速度的影響較大。在不添加酶的條件下,固定反應時間后,酶促反應速度隨淀粉濃度的升高呈先增大后變小趨勢,說明酶活性受到底物的影響,較高的底物濃度有利于淀粉葡糖苷酶發揮較大的活性,且在適當的反應時間內有利于酶活性達到最大。
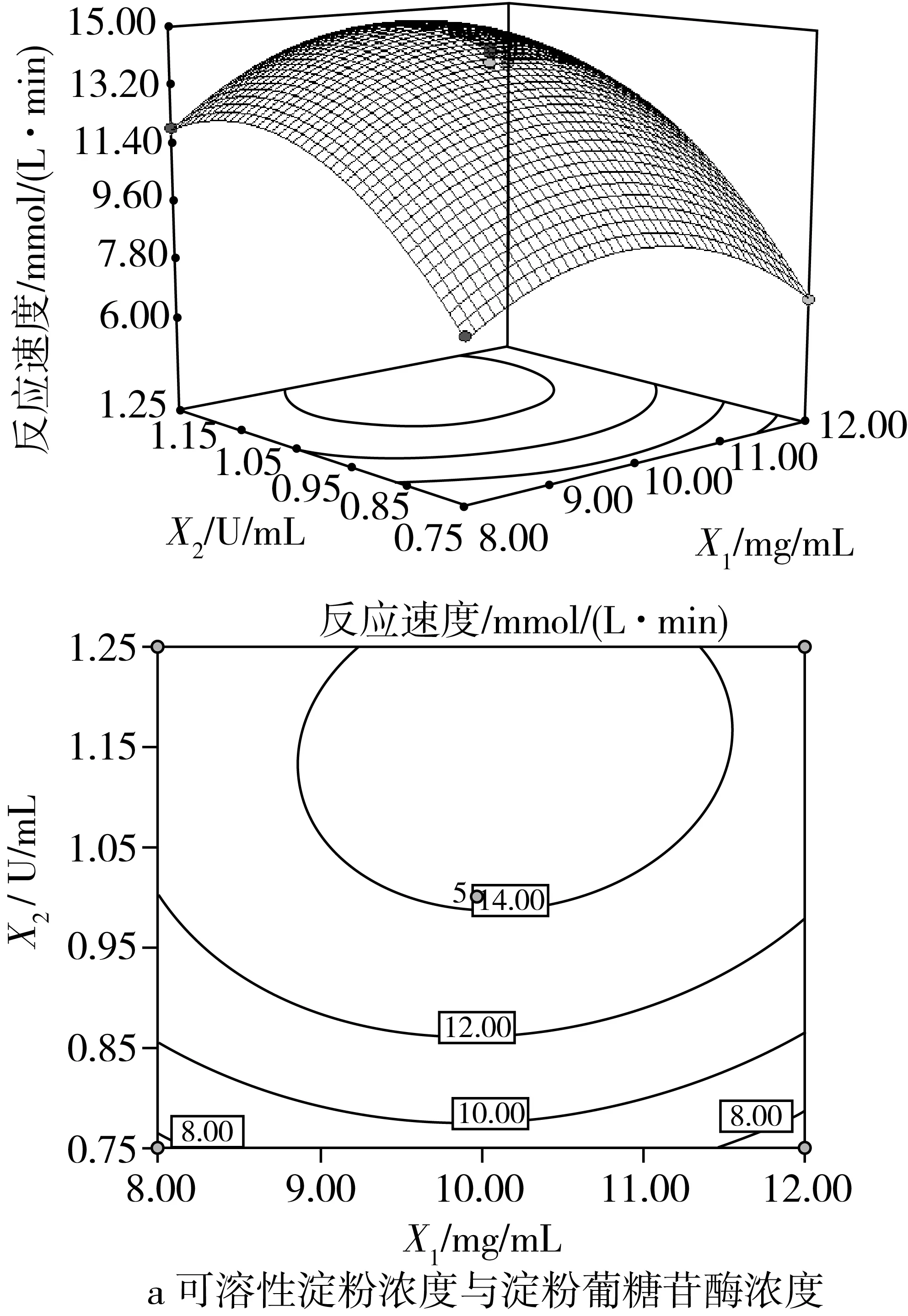
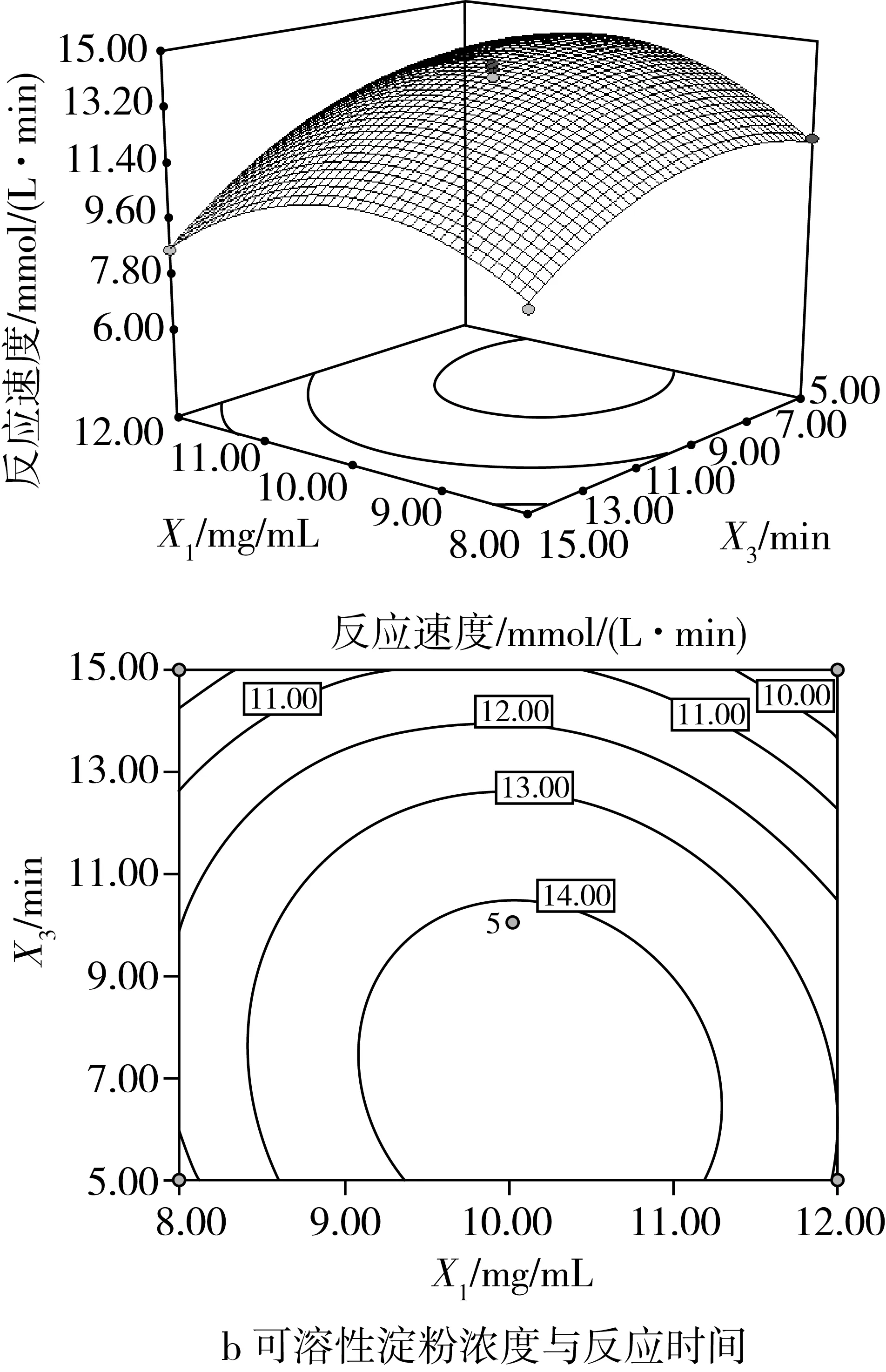
圖4 交互作用對淀粉葡糖苷酶促 反應速度影響的響應面圖和等高線圖
由響應面軟件分析能夠得到發揮淀粉葡糖苷酶良好酶活性最佳反應體系的優化參數:可溶性淀粉質量濃度10.33 mg/mL、淀粉葡糖苷酶濃度1.15U/mL、反應時間6.98 min,預測體系達到的最佳酶反應速度為15.43 mmol/(L·min)。為考察模型的可靠性進行驗證實驗,考慮到實際操作的可行性,將反應條件改進為:可溶性淀粉質量濃度10.30 mg/mL、淀粉葡糖苷酶濃度1.15 U/mL、反應時間7.00 min,驗證實驗得到的酶反應速度為(15.17±1.84)mmol/(L·min),與理論預測值相對誤差為1.69%,說明回歸模型與實際情況擬合良好,充分驗證了所建模型的正確性,所得反應體系能夠促使淀粉葡糖苷酶發揮優良活性。
3 結論
通過單因素和響應面優化實驗,確定了最佳淀粉葡糖苷酶反應體系的條件為可溶性淀粉質量濃度10.30mg/mL、淀粉葡糖苷酶濃度1.15 U/mL、反應時間7.00 min,在此條件下驗證得酶促反應速度為(15.17±1.84)mmol/(L·min)。模型的酶促反應速度預測值與實際值的吻合度較高,說明所建立的反應體系能夠使淀粉葡糖苷酶在此條件下發揮優良的活性,獲得準確可靠的酶活測定數據,以便后期獲得糖苷酶抑制劑在此反應體系下所能發揮的最大抑制效果。

