冷凍誘導對大豆分離蛋白結構和聚集行為的影響
榮薈,湯輝煌,趙婭柔,呂文,鄭志強,李澤昊,汪建明*
(1.天津科技大學食品科學與工程學院,天津 300457;2.天津市利民調料有限公司,天津 300000;3.軍事科學院系統工程研究院軍需工程技術研究所,北京 100010)
大豆蛋白的功能特性不僅與其制備方法及自身結構組成相關,還受到許多外界條件的影響,研究表明熱處理[1]、酶處理[2]、pH值[3]等多種因素可誘發大豆蛋白質發生聚集行為。降低溫度是食品加工領域中的常用手段。隨著冷處理程度的增加,蛋白質組分的微觀結構和宏觀品質也逐漸發生變化[4]。
大豆蛋白制品在冷凍食品領域應用廣泛,冷處理[5]會導致大豆蛋白質性質和特性發生改變。大豆蛋白經過冷凍處理,蛋白質分子內和分子間發生疏水相互作用,氫鍵和二硫鍵的含量增加,蛋白質發生了聚集現象[6]。冷凍對大豆蛋白的保水保油性、乳化特性及其質構特性也有影響[7]。
本文研究不同濃度的大豆分離蛋白經冷凍處理后聚集行為的變化,探討冷凍處理后大豆分離蛋白的微觀結構與宏觀性質之間的關聯性,冷凍誘導大豆分離蛋白的研究為大豆分離蛋白在冷凍食品中的應用提供依據。
1 材料與方法
1.1 材料與儀器
大豆分離蛋白(蛋白質含量90%以上):河北賽億生物科技有限公司;磷酸氫二鈉、磷酸二氫鈉、氫氧化鈉、五水合硫酸銅、酒石酸鉀鈉、碘化鉀:北京鼎國生物技術有限公司;β-巰基乙醇:北京Solarbio科技有限公司;以上化學試劑均為分析純。
SU1510掃描電子顯微鏡:日本Hitachi公司;Tuibiscan ASG靜態多散射穩定性分析儀:北京朗迪森科技有限公司;UV-2550PC全波長紫外/可見光掃描分光光度計:日本島津公司。
1.2 方法
1.2.1 冷凍誘導大豆分離蛋白的制備
將大豆分離蛋白粉末狀樣品與水以一定比例混合,得到不同濃度的大豆分離蛋白溶液,研究不同濃度對其冷凍處理效果的影響。大豆分離蛋白溶液在-5、-20℃下分別冷凍處理 1、3、5、10 d后,烘干過篩(80目),得到冷凍誘導大豆分離蛋白樣品備用[8]。
1.2.2 冷凍誘導大豆分離蛋白溶解性的測定
采用雙縮脲法測定冷凍大豆分離蛋白的溶解性[9],用氮溶解指數(nitrogen solubility index,NSI)表示。
1.2.3 冷凍誘導大豆分離蛋白濁度的測定
參照Chen等的方法[10],將0.02 g冷凍大豆分離蛋白和10 mL磷酸鹽緩沖溶液(0.1 mol/L,pH 7.0)混勻,后取4 mL樣品移入1 cm比色皿中,用全波長紫外分光光度計在600 nm波長處測吸光值,以吸光度表示濁度,以未經冷凍的大豆分離蛋白溶液為對照。
1.2.4 冷凍誘導大豆分離蛋白穩定性動力學指數的測定
采用靜態多散射穩定性分析儀來對蛋白質溶液的穩定性進行測定,將0.1 g的冷凍誘導大豆分離蛋白放入30 mL磷酸鹽緩沖液(0.1 mol/L,pH7.0)中攪拌均勻,將其裝入Turbiscan測試瓶中,在26℃條件下,對6 h內的穩定性動力學指數進行測定,掃描頻率為30 min/次,溶液的穩定性用穩定性動力學指數(turbiscan stability index,TSI)表示[11]。
1.2.5 冷凍誘導大豆分離蛋白的掃描電子顯微鏡(scanning electron microscope,SEM)的觀察
將冷凍前后的大豆分離蛋白樣品處理后,經離子濺射金鍍膜后在掃描電子顯微鏡下觀察樣品的微觀形貌[12]。
1.2.6 冷凍誘導大豆分離蛋白巰基和二硫鍵的測定
采用Ellman法[13]和Richard法[14]結合測定冷凍誘導大豆分離蛋白樣品的巰基和二硫鍵,計算公式如式(1)所示。

式中:X為游離巰基和總暴露巰基的含量,μmol/mg protein;73.53為106/(1.36×104),1.36×104是Ellman′s試劑的摩爾消光系數;A412為412 nm處的吸光光度值;D為稀釋倍數;C為蛋白樣品濃度,mg/mL。
1.2.7 冷凍誘導對大豆分離蛋白紫外吸收光譜的影響
取2mg樣品(蛋白濃度4%;冷凍溫度分別為-5℃和-20℃;冷凍時間3 d)與 10 mL的磷酸鹽緩沖液(0.01 mol/L,pH 7.0)攪拌均勻,在波長 230 nm~300 nm下進行掃描,得出大豆分離蛋白的紫外吸收光譜,再用Origin軟件微分化得到二級衍生紫外光譜。
1.2.8 數據統計分析方法
試驗數據采用Microsoft Excel和Orign 8.0進行統計分析。所有試驗均重復測定3次,試驗結果以平均值±標準差的形式標出。當0.01<p<0.05時為差異顯著,當p<0.01時為差異極顯著。
2 結果與分析
2.1 冷凍誘導對大豆分離蛋白聚集行為的研究
2.1.1 冷凍誘導對大豆分離蛋白溶解性的影響
蛋白質的溶解性可初步表現出蛋白質的聚集程度,而且溶解性對蛋白質的功能特性也有一定的影響[15]。大豆分離蛋白溶解性測定結果如圖1所示。

圖1 不同處理方式對冷凍誘導大豆分離蛋白溶液溶解性的影響Fig.1 Effect of different treatment methods on solubility of cold induced soybean protein isolate solution
由圖1可以看出,不同濃度大豆分離蛋白溶液經冷凍處理后溶解性無明顯差異,大豆分離蛋白溶液冷凍誘導時間對蛋白溶解性的影響極顯著(p<0.01),冷凍誘導溫度對溶解性的影響不顯著(p>0.05)。在-5℃和-20℃的冷凍條件下,隨著冷凍時間的增長冷凍誘導烘干后大豆分離蛋白的溶解性先降低后有輕微上升,在第5天時冷凍誘導大豆分離蛋白的溶解性達到最低,分別為(47.62±1.04)%和(66.34±1.10)%,這可能是因為隨著冷凍誘導時間的增加,蛋白質發生了聚集和交聯從而形成不可溶的聚集體,導致了溶解性的下降。由此可見,大豆分離蛋白溶液冷凍誘導時間越長,蛋白的溶解性越低,而在冷凍誘導5 d后溶解性有輕微上升,這可能是因為過長時間的冷凍使蛋白質分子發生了一定程度的斷裂,與Cropotava等的研究一致[16]。
2.1.2 冷凍誘導對大豆分離蛋白濁度的影響
蛋白質溶液的濁度可以在一定程度上反映出蛋白質的聚集狀態、溶解性和顆粒大小等[17],由此可見,蛋白質溶液的濁度與聚集體的濃度和大小有關,可以作為一個重要指標來評價蛋白質聚集體。不同冷凍誘導后蛋白濁度測定結果如圖2所示。

圖2 不同處理方式對冷凍誘導大豆分離蛋白溶液濁度的影響Fig.2 Effect of different treatment methods on turbidity of cold induced soybean protein isolate solution
如圖2所示,蛋白濁度與大豆分離蛋白溶液冷凍誘導時的濃度成正比關系。這是由于大豆分離蛋白溶液冷凍誘導時的濃度對蛋白溶解性影響很小,此時蛋白質溶液可能處于質量較穩定均勻的懸濁液狀態。濁度在蛋白濃度為6%時達到最高為0.82±0.06,但在5%的蛋白濃度時濁度增加的速度開始減慢,因此選擇5%蛋白質濃度來研究冷凍誘導時間對蛋白濁度的影響。
在-5℃和-20℃冷凍條件下,蛋白質的濁度均有所增加,說明冷凍使蛋白質產生變性,形成聚集體不可溶,阻止蛋白質聚集。而冷凍誘導時間對濁度的影響極顯著(p<0.01),這可能是因為冷凍誘導時間的增加導致了蛋白質溶解性的下降,從而形成更大質量和尺寸的團聚體,最終導致濁度增加,在-20℃冷凍時長為10 d的濁度達到最大,在600 nm波長處的吸光值為0.78±0.065。可見脂質減少的大豆蛋白通過疏水相互作用、靜電相互作用或氫鍵重新包裝形成更大的聚集物。減緩脂質的大豆蛋白濁度增加,顆粒分布更廣。
2.1.3 冷凍誘導對大豆分離蛋白穩定性動力學指數的影響
為了進一步研究冷凍對大豆分離蛋白聚集行為的影響,采用靜態多散射穩定性分析儀對大豆分離蛋白穩定性動力學指數進行測定,結果如圖3、圖4所示。
粒子在一定周期內的狀態變化可以作為動力學穩定指數的指標。動力學穩定指數越高則變化量越大,分散越不穩定。由圖3可知,與未冷凍時相比,-5℃和-20℃條件下的冷凍誘導均使大豆蛋白的穩定性動力學指數有明顯提高,即冷凍誘導使蛋白質分散系變得不穩定。由圖4所示,隨著冷凍誘導時蛋白溶液濃度的增加,蛋白穩定性動力學指數變化逐漸穩定,在蛋白溶液濃度4%、冷凍時長為6 d時達到最大為20.51。結合圖3和圖4分析,冷凍時間對穩定性動力學指數有影響但不顯著,冷凍誘導與蛋白溶液濃度對穩定性動力學指數的影響均不顯著(p>0.05)。

圖3 冷凍誘導對大豆分離蛋白溶液穩定性動力學指數的影響Fig.3 Effect of freezing induction on the stability kinetic index of soybean protein isolate solution

圖4 冷凍誘導時蛋白溶液濃度對大豆分離蛋白溶液穩定性動力學指數的影響Fig.4 Effect of protein concentration on the stability kinetic index of soybean protein isolate during freezing induction
2.1.4 冷凍誘導對大豆分離蛋白微觀結構的影響
圖5為冷凍誘導的大豆分離蛋白放大8 000倍的掃描電鏡圖。

圖5 冷凍誘導大豆分離蛋白的掃描電子顯微鏡圖Fig.5 Scanning electron micrograph of freeze-induced soybean protein isolate
如圖5所示,未冷凍的樣品以顆粒狀相互分離,-5℃條件下冷凍誘導后,蛋白樣品表面呈現大量不規則片狀凸起,且能看到少量孔洞,整體結構看上去較為疏松。而-20℃條件冷凍誘導下,蛋白質樣品表面則看上去片狀凸起明顯減少,幾乎看不到孔洞,且整體結構更為緊致細密。因為低溫冷凍,使蛋白質發生變性,產生聚集體,表面呈現凹凸不平的狀態,而隨著溫度降低,蛋白質聚集體數量增多,結合得也更為緊密,因此-20℃時樣品表面看起來更為緊致細密,隨著冷凍強度的增大,蛋白質發生斷裂形成可溶性聚集體和數目多的小分子多肽,使濁度和溶解性都增大,微觀結構變得疏松,可以看出掃描電鏡觀察得到的樣品微觀結構與冷凍誘導對大豆分離蛋白溶解性和濁度分析的結果一致。
2.2 冷凍誘導對大豆分離蛋白分子結構的研究
2.2.1 冷凍誘導對大豆分離蛋白巰基和二硫鍵的影響
巰基和二硫鍵在維持蛋白分子的空間結構中有重要的作用[18],因此可以通過測定分析巰基和二硫鍵的含量來反映蛋白質的結構狀態。結果如圖6所示。

圖6 不同處理條件對大豆分離蛋白巰基和二硫鍵含量的影響Fig.6 Effects of different treatment conditions on sulfhydryl and disulfide bond contents of soybean protein isolate
一般來說,巰基含量的增加可能是因為蛋白質結構的展開或者是二硫鍵的斷裂[19]。而巰基的減少可能是因為蛋白質的聚集或者是轉化成了二硫鍵[20]。由圖6可知,未冷凍大豆分離蛋白的游離巰基含量為5.16 μmol/g,而在-5℃和-20℃條件下冷凍誘導后游離巰基含量分別為(4.82±0.34)μmol/g和(4.37±0.21)μmol/g,即在冷凍條件下,二硫鍵和總巰基含量在逐漸增加,而游離巰基含量則逐漸減少,且冷凍溫度對二硫鍵和巰基含量的影響極顯著(p<0.01)。
如圖6所示,隨著冷凍誘導時蛋白溶液濃度的增加,二硫鍵和總巰基含量逐漸增加,當蛋白濃度為6%時,二硫鍵含量最大為(26.54±0.78)μmol/g,游離巰基含量則先增加后有輕微減少且一直比對照樣品的游離巰基含量少,但蛋白溶液濃度對二硫鍵和巰基含量的影響不顯著(p>0.05)。這是因為蛋白質中的巰基與水分子間存在氫鍵等相互作用,而冷凍后氫鍵等相互作用被破壞,導致蛋白質表面的游離巰基失衡從而轉化成二硫鍵等。
由圖6可知,隨著冷凍誘導時間的增長,二硫鍵和總巰基含量的變化趨勢逐漸趨于平穩。這是因為初期冷凍時,大豆分離蛋白的體系還不穩定,隨著冷凍誘導時間增長,體系逐漸趨于穩定,各項指標變化趨勢也逐漸趨于穩定,同樣可以說明冷凍時間對大豆分離蛋白巰基和二硫鍵含量的影響不顯著(p>0.05)。
由此可見,冷凍誘導后二硫鍵含量增加,使蛋白質結構變得更加穩定,且蛋白溶液濃度越高二硫鍵含量越高即結構越穩定,而冷凍誘導時間對大豆分離蛋白結構穩定性影響不顯著。
2.2.2 冷凍誘導對大豆分離蛋白紫外吸收光譜的影響
紫外測得的波長和強度的變化與微環境中存在的各種殘留物有關。因此,可以通過紫外吸收光譜來判斷蛋白質的吸收狀態[21]。由于紫外光譜特征比較不明顯,因此采用二階導數光譜法檢測了3個芳香氨基酸殘基在250 nm~300 nm范圍內的結構變化。大豆分離蛋白紫外吸收光譜如圖7所示。

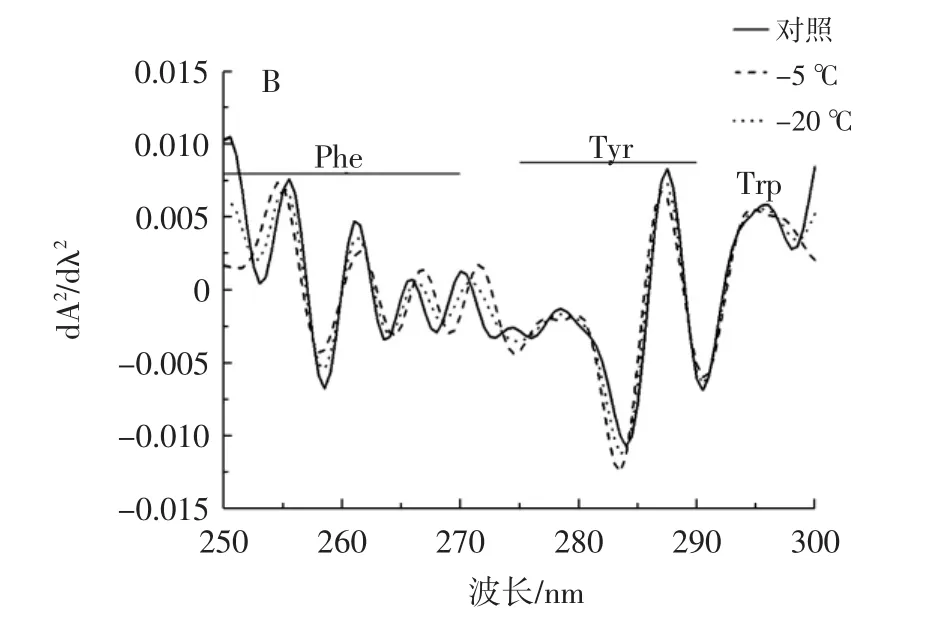
圖7 冷凍誘導大豆分離蛋白聚集體的紫外吸收光譜圖Fig.7 Ultraviolet absorption spectra of freeze induced SPI aggregates
從圖7可以看出,不同冷凍程度誘導的樣品,在與苯丙氨酸(Phe)對應的253 nm和255.5 nm處的谷峰有輕微的藍移,而在 261、263.5、266、268、270 nm 處對應的谷峰有輕微的紅移。在258.5 nm時,苯丙氨酸在-5℃和-20℃的冷凍誘導條件下發生藍移,說明在冷凍誘導條件下一部分蛋白質分子展開,導致其具有輕微的疏水性,即芳香族氨基酸增加。圖7B顯示在278.5、284 nm和287 nm處的谷峰出現藍移,表明經冷凍誘導后從大豆分離蛋白的可溶性聚合體中分離出了酪氨酸,增加了親水性。
3種芳香族氨基酸在-5℃和-20℃冷凍處理下由于蛋白質的部分展開,冷凍聚集使大豆分離蛋白的疏水部分聚集在一起,形成更加緊密的內部結構[22],使其具有輕微疏水性,氨基酸顯著地暴露出來,這與圖5觀察的結果一致。
3 結論
本試驗以大豆分離蛋白溶液為研究對象,在-5℃和-20℃的條件下冷凍誘導烘干后再溶解,通過對溶解性、濁度、穩定性動力系數、微觀結構、紫外光譜的測定,研究了大豆分離蛋白溶液濃度和冷凍誘導時間對大豆分離蛋白的聚集性行為及分子結構所產生的影響。冷凍誘導使大豆分離蛋白溶解性降低。冷凍誘導時間相同,冷凍誘導程度越深濁度越高,微觀結構也越容易達到穩定狀態。蛋白質變性形成大小不一的聚集體,從而對大豆分離蛋白的聚集性行為產生影響。而這些聚集體之間的相互交聯作用則對大豆分離蛋白的分子結構產生影響。
綜上所述,冷凍誘導對大豆分離蛋白的聚集性行為和分子結構產生了積極的影響,以上結論有望為大豆分離蛋白在冷凍食品中的應用提供參考依據。

