宮頸癌患者術后化療耐受性的預測模型構建
李吉想,文丹紅,岳艷玲
(1.邵陽學院附屬第一醫院婦科,湖南 邵陽 422000;2.湖南省腫瘤醫院婦瘤醫學研究中心,湖南 長沙 410000)
宮頸癌是女性常見的惡性腫瘤,近年來,其發病率升高且有年輕化的趨勢。目前,手術是治療早期宮頸癌的主要手段,可明顯改善患者的生活質量,降低其死亡率。但ⅠB~ⅡA期患者術后容易復發,尤其是有淋巴結轉移、陰道切緣陽性等患者,術后更容易復發[1-2]。研究發現早期宮頸癌患者術后輔助化療,有助于預防或降低復發率,但化療引起的毒副反應可能使患者對化療不耐受,出現中斷治療的現象[3]。因此,準確評估宮頸癌患者術后化療耐受性情況,對保證術后化療的順利進行至關重要,但目前關于術后化療耐受性相關的風險預測研究較少。列線圖又稱諾莫圖,是一種圖形預測工具,可個體化預測臨床不良事件的發生風險[4-5]。鑒于此,本研究通過回顧性分析接受手術治療的420例宮頸癌患者的臨床資料,探討與術后化療耐受性差相關的危險因素,并構建風險預測模型,旨在為患者術后化療的順利進行提供幫助。
1資料與方法
1.1研究對象
回顧性分析2017年8月至2020年8月在邵陽學院附屬第一醫院接受手術治療的420例宮頸癌患者的臨床資料。納入標準:①手術方式均為根治性子宮切除術+盆腔淋巴結清除術;②國際婦產科聯合會(International Federation of Gynecology and Obstetrics,FIGO)分期為ⅠB~ⅡA期,且術后病理證實均為宮頸鱗狀細胞癌[6];③術前未接受任何治療;④術后均進行化療。排除標準:①有其他惡性腫瘤病史者;②臨床資料缺失者;③術后接受放療;④肝、腎等臟器功能不全。本研究已經通過倫理審查。
1.2術后化療方法
患者術后2~4周開始化療,化療方案為氟尿嘧啶+順鉑,氟尿嘧啶(批準文號:國藥準字H20050511,規格:0.25g),每天靜脈注射600mg/m2,連用5天;順鉑(批準文號:國藥準字H37021356,規格:30mg),每天靜脈注射15mg/m2,連用5天。每4周為1個療程,共4個療程。本研究將化療期間中斷治療者作為耐受性差組(n=89),將順利完成或延遲完成化療者作為耐受性良好組(n=331)。
1.3臨床資料收集
收集兩組患者年齡、腫瘤直徑、FIGO分期(ⅠB~ⅡA期)、腫瘤分化程度(高分化、中分化、低分化)、毒副反應分級(Ⅰ、Ⅱ、Ⅲ、Ⅳ級)、營養風險篩查2002量表(Nutritional Risk Screening 2002,NRS-2002)評分、是否進行營養干預(針對存在營養風險的患者)、Karnofsky(KPS)評分。化療開始后記錄毒副反應,其分級采用CTCAE 4.0標準:無不適癥狀,即為Ⅰ級;有輕微不適,需干預治療,但不影響正常生活,即為Ⅱ級;不適癥狀較嚴重,需延遲給藥,即為Ⅲ級;不適癥狀特別嚴重,需終止化療,即為Ⅳ級。采用NRS-2002評分評估患者化療前1周的營養狀態,主要包括3個方面,疾病嚴重程度(0~3分)、營養狀態受損程度(0~3分)、年齡>70歲則總分加1分;NRS-2002評分≥3分為存在營養風險。KPS評分共100分,得分越高,患者身體狀況越好。
1.4統計學方法
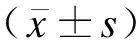
2結果
2.1宮頸癌患者術后化療耐受性差的單因素分析
本研究納入420例宮頸癌患者,術后化療耐受性差的構成比為21.19%(89/420)。兩組患者年齡、腫瘤直徑、FIGO分期相比,差異均無統計學意義(P>0.05);耐受性差組患者腫瘤低分化、毒副反應Ⅲ~Ⅳ級、NRS-2002評分≥3分的構成比均明顯高于耐受性良好組(P<0.05),營養干預構成比、KPS評分明顯低于耐受性良好組(P<0.05),見表1。
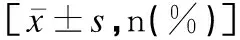
表1 宮頸癌患者術后化療耐受性差的單因素分析Table 1 Univariate analysis of poor tolerance of postoperative chemotherapy in patients with cervical
2.2宮頸癌患者術后化療耐受性差的多因素分析
將宮頸癌患者術后化療耐受性(耐受性良好=0,耐受性差=1)作為因變量,將表1中有統計學意義的因素即腫瘤分化程度、毒副反應分級、NRS-2002評分、營養干預、KPS評分作為自變量進行分析,賦值說明見表2。結果發現毒副反應分級(OR=2.086,95%CI=1.208~3.602)、NRS-2002評分(OR=1.983,95%CI=1.216~3.233)、KPS評分(OR=2.315,95%CI=1.510~3.549)是宮頸癌患者術后化療耐受性差的獨立危險因素(P<0.05),營養干預(OR=0.499,95%CI=0.303~0.824)是宮頸癌患者術后化療耐受性差的保護因素(P<0.05),見表3。

表2 賦值說明Table 2 Assignment description
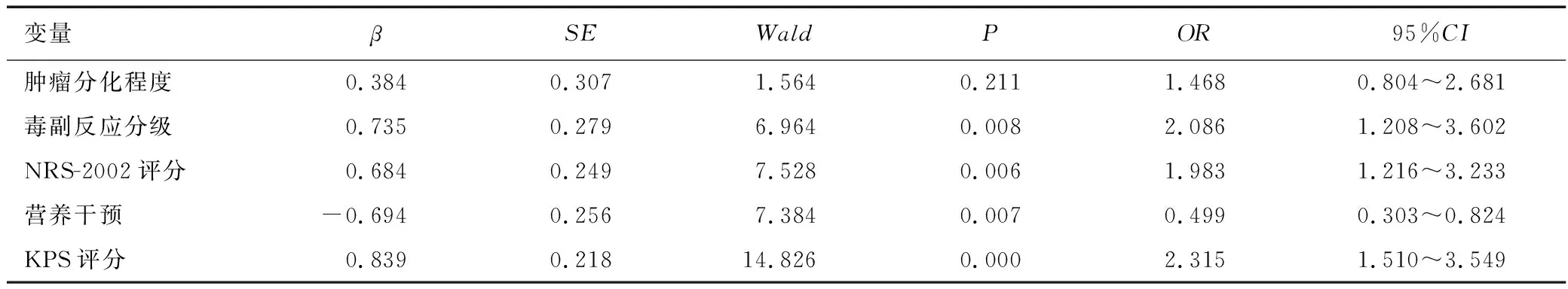
表3 宮頸癌患者術后化療耐受性差的多因素分析Table 3 Multivariate analysis of poor tolerance of postoperative chemotherapy in patients with cervical cancer
2.3預測宮頸癌患者術后化療耐受性差的列線圖模型構建
基于宮頸癌患者術后化療耐受性差的多因素Logistic回歸分析結果構建的列線圖模型,結果顯示KPS評分每降低5分,列線圖模型評分增加14.30分;毒副反應Ⅲ~Ⅳ級列線圖模型評分為54.52分,NRS-2002評分≥3分列線圖模型評分為48.11分,無營養干預為66.20分,見圖1。

圖1 預測宮頸癌患者術后化療耐受性差的列線圖模型Fig.1 Nomogram model for predicting poor tolerance of postoperative chemotherapy in patients with cervical cancer
2.4預測宮頸癌患者術后化療耐受性差的列線圖模型的驗證
列線圖模型預測宮頸癌患者術后化療耐受性差的ROC曲線下面積為0.753(95%CI=0.693~0.813),見圖2。校準曲線斜率接近1,且Hosmer-Lemeshow擬合優度檢驗χ2=8.452,P=0.391,見圖3。

圖2 列線圖模型預測化療耐受性差的ROC曲線Fig.2 ROC curve for predicting poor chemotherapy tolerance with nomogram model

圖3 列線圖模型預測化療耐受性差的校準曲線Fig.3 Calibration curve for predicting poor chemotherapy tolerance with nomogram model
3討論
3.1宮頸癌患者術后化療耐受性列線圖預測模型構建的意義
本研究宮頸癌患者術后化療耐受性差的構成比為21.19%,通過對年齡、腫瘤直徑、FIGO分期、腫瘤分化程度、毒副反應分級、NRS-2002評分、營養干預、KPS評分8個指標進行單因素及多因素Logistic回歸分析,結果發現毒副反應分級、NRS-2002評分、KPS評分是宮頸癌患者術后化療耐受性差的獨立危險因素,營養干預是宮頸癌患者術后化療耐受性差的保護因素。列線圖是用一簇互不相交的線段將多因素Logistic回歸分析確定的危險因素,以圖形化的形式直觀地展現出來,用于個體化預測臨床結局發生的概率,在臨床實踐中有較大的價值[7-8]。近年來相關研究發現,列線圖模型可有效預測晚期胃癌、乳腺癌化療后病理完全緩解[9-10]、子宮內膜癌患者術后化療耐受性[11]等。本研究基于上述4項宮頸癌患者術后化療耐受性的影響因素,構建預測術后化療耐受性差的列線圖模型,對患者術后化療的順利進行具有重要作用。
3.2宮頸癌患者術后化療耐受性差的危險因素分析
本研究構建的列線圖模型,結果發現KPS評分每降低5分,列線圖模型評分增加14.30分,相應宮頸癌患者術后化療越不耐受。原因可能是KPS評分越低,患者身體健康狀況越差,越不能忍受化療帶來的不良反應[12]。因此,宮頸癌患者術后應評估患者的身體狀況,及時進行干預,以保證化療的順利進行。預測模型結果發現,毒副反應Ⅲ~Ⅳ級的患者較毒副反應Ⅰ~Ⅱ級的患者增加列線圖評分54.52分。原因可能是化療毒副反應越嚴重,對機體的正常機能破壞力度可能越大,同時可能會加重抑郁、焦慮等不良情緒,從而導致患者中斷化療[13-14]。因此臨床上應根據患者化療的毒副反應情況,有針對性地進行干預,盡可能地抑制或減少毒副反應的發生,使術后化療順利完成。研究發現營養不良是癌癥患者術后死亡的重要因素,患者在出現與癌癥相關營養不良的情況下,應迅速實施個性化的營養支持[15-16]。秦楠等[17]研究報道,宮頸癌患者在同步放化療期間給予營養干預,可明顯改善患者日常生活能力,降低不良反應發生率。于嬌等[18]研究發現,行根治性同步放化療的宮頸癌患者,治療期間堅持口服營養制劑,可明顯提高放化療耐受性和療效。本研究預測模型結果發現,NRS-2002評分≥3分的患者較NRS-2002評分<3分的患者增加列線圖評分48.11分,且無營養干預的患者較營養干預患者增加列線圖評分66.20分。因此,建議宮頸癌患者術后采用NRS-2002評分評估患者營養狀態,對營養不良的患者給予合理的營養干預,以改善身體狀況,從而提高患者術后化療的耐受性。
3.3宮頸癌患者術后化療耐受性差列線圖預測模型的驗證
本研究采用ROC曲線及校準曲線驗證預測模型的效果,曲線下面積為0.753,校準曲線斜率接近1,且Hosmer-Lemeshow擬合優度檢驗(χ2=8.452,P=0.391),提示本研究構建的列線圖模型,可較好地預測宮頸癌患者術后化療耐受性的情況,值得在臨床實踐中推廣應用。但臨床上影響化療耐受性的因素較多,可能對預測結果會造成一定影響,需要擴大樣本進一步進行驗證。
3.4小結
綜上所述,本研究基于毒副反應分級、NRS-2002評分、營養干預、KPS評分構建預測宮頸癌患者術后化療耐受性的列線圖,有助于針對性地采取措施進行干預,對患者術后化療的順利進行具有積極作用。

