4類碳氫燃料的高溫燃燒反應簡化建模
梁興雨,劉志偉,王昆,朱仕皓,王曉慧,沈位
(天津大學內燃機燃燒學國家重點實驗室,300072,天津)
大分子液態(tài)碳氫燃料由于體積能量密度和質量能量密度的平衡以及良好的存儲運輸特性,在可預見的未來依然是航空航天和地面交通運輸?shù)阮I域推動現(xiàn)代社會發(fā)展的主要能源。碳氫燃料的主要供能方式是燃燒,因此建立能夠準確描述其燃燒特性的動力學模型對進一步提高發(fā)動機燃燒效率和降低污染物排放至關重要。傳統(tǒng)汽油、柴油、航空煤油及多數(shù)可再生燃料等發(fā)動機實際使用的燃料通常是含多種大分子碳氫化合物的混合物;基于分子結構中化學官能團的不同,碳氫燃料可分為直鏈烷烴、支鏈烷烴、環(huán)烷烴和芳香烴等。與其他化學反應類似,燃燒反應非常復雜。基于詳細化學反應機理建模的大分子碳氫燃料的燃燒反應動力學模型通常極為復雜,可包含成百上千個化學組分和成千上萬個基元反應。例如,汽油典型化合物正庚烷和異辛烷、航空煤油組分正十二烷、柴油組分正十六烷,上述碳氫燃料的詳細模型所包含的化學組分均達600~2 000個、基元反應達3 000~10 000個[1]。顯然,準確的實驗測量和可信賴的理論計算很難滿足詳細反應模型所涉及的大量熱力學、動力學和輸運參數(shù),其建立過程很大程度上依靠預估、類比等經(jīng)驗或半經(jīng)驗方式。
同時,規(guī)模龐大、詳細的燃燒反應模型只有大幅簡化,方能耦合計算流體力學(CFD)以用于對真實發(fā)動機系統(tǒng)的仿真模擬,因而當前反應動力學模型的簡化方法如關鍵成分分析法、反應路徑分析法、敏感性分析法、誤差傳播直接關系圖譜法、計算奇異攝動法、近穩(wěn)態(tài)分析法等得到了長足發(fā)展[2-3]。為確保簡化模型的保真性和準確性,以上方法常聯(lián)合使用。盡管如此,可有效耦合CFD的燃燒反應模型依然需要進一步簡化,以減緩或消除數(shù)值計算中化學反應與流體耦合帶來的強剛性問題,并有效降低計算資源和費用。根據(jù)對燃燒反應物理過程的深入分析,在建模初始對其簡化處理,再結合當前較為成熟的模型簡化方法,是實現(xiàn)燃燒反應模型進一步簡化的最有效方式之一。
發(fā)動機或燃氣輪機內的燃燒通常是高溫(1 000 K或以上)化學反應過程。在該反應條件下,大分子碳氫燃料的燃燒過程在時間和空間尺度均存在雙區(qū)特性[4-5]。具體來講,母燃料首先快速熱解轉化為小分子中間產物,之后中間產物發(fā)生較慢的氧化反應。基元反應特征時間分析可較好地解釋以上高溫燃燒過程的物理特性。同時,結合近穩(wěn)態(tài)分析方法而發(fā)展的簡化建模方法可顯著降低大分子碳氫燃料轉化為小分子中間產物的基元反應數(shù)量的規(guī)模。當前對小分子中間產物(又稱基礎燃料,通常包括氫氣(H2)、C1~C4化合物以及苯(C6H6)和甲苯(A1CH3)等單環(huán)芳香烴)燃燒化學反應的基礎研究主要基于較為完備的實驗和理論研究方法,其動力學模型也較為成熟。
基于以上分析的兩步反應過程的簡化建模方法已經(jīng)用于描述辛烷異構物的熱解和氧化特性[4]。本文將該簡化建模方法拓展至對較為復雜的環(huán)烷烴和芳香烴高溫燃燒化學的描述,以進一步驗證該方法的適用性。具體來講,以正辛烷、異辛烷、甲基環(huán)己烷和正丁基苯為研究對象,它們代表真實燃料中4類官能團的大分子碳氫化合物;采用上述簡化建模方法對這4類碳氫燃料建立簡化反應動力學模型,并以熱解反應和氧化反應的中間產物分布、點火延時時間和層流燃燒速率等基礎燃燒實驗數(shù)據(jù)對其進行驗證。
1 模型構建
1.1 簡化建模方法概述
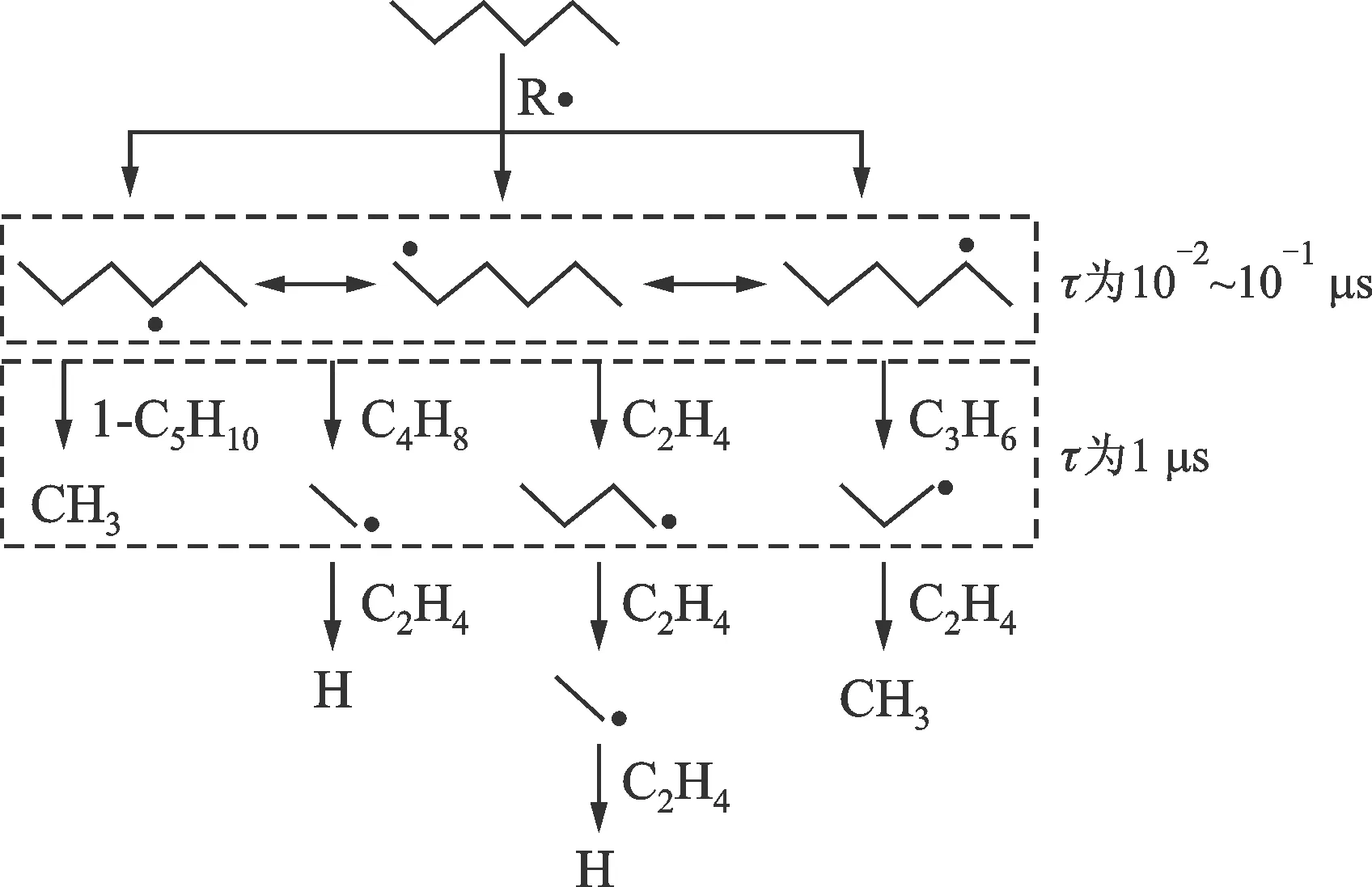
圖1 高溫熱解反應過程和特征時間尺度
高溫條件下,大分子碳氫燃料的燃燒過程分為先后進行的兩個部分,即母燃料分子本身的快速熱解反應和熱解產物較慢的氧化反應。基于該燃燒物理過程,采用反應特征時間分析和近穩(wěn)態(tài)分析的方法,可對該物理反應過程做簡化建模[4]。如圖1所示,以直鍵烷烴正己烷(n-C6H12)為例,由脫氫反應產生的3種烷基自由基,通過氫轉移反應進行異構化反應進而達到熱力學平衡。基于五環(huán)或六環(huán)過渡態(tài)結構的氫轉移反應具有較低的能壘(分別為92和63 kJ/mol),其反應特征時間為0.01~0.1 μs。烷基自由基的C—C鍵β位斷裂產生較小的烷基自由基(甲基或氫原子通過脫氫反應生成甲烷和氫氣)或輕烯烴(包括乙烯、丙烯、丁烯等),但具有較高的能壘(146 kJ/mol),因而反應特征時間也較長,尺度為1 μs。以上分析符合準穩(wěn)態(tài)假設,即正己烷脫氫反應后,其烷基自由基C—C鍵β位斷裂是其裂解的決速步;平衡濃度的自由基決定了小分子烯烴產物的分布。基于上述基元反應特征時間分析和準穩(wěn)態(tài)假設,采用7個總包反應(1個燃料C—C鍵離解反應和6個脫氫反應)描述母燃料通過熱解/氧化熱解反應迅速轉化為小分子中間產物的反應過程(即熱解反應簡化模型)。小分子中間產物進入火焰燃燒區(qū)進行劇烈的氧化還原反應,實際控制整個燃燒過程的放熱和終產物水和二氧化碳的生成。該過程較慢,需用詳細的基礎燃料氧化反應模型描述。
以上方法已經(jīng)用于直鏈和支鏈烷烴的高溫燃燒化學反應的描述[3]。本文將該方法擴展至化學反應動力學更復雜的環(huán)烷烴(以甲基環(huán)己烷為例)和芳香烴(正丁基苯)的高溫氧化反應,進而探究不同官能團碳氫化合物對各自宏觀燃燒特性的動力學控制作用。
1.2 動力學、熱力學數(shù)據(jù)和輸運參數(shù)的確定
7個總包反應的動力學參數(shù)來自各單步反應[6-7],涉及的化學組分熱力學數(shù)據(jù)使用官能團貢獻法獲得[8]。表1~3所示為上述4類燃料熱解反應簡化動力學模型,其中R代表H·、CH3·、OH·、HO2·、O·和O2。本文選擇USC-Mech-Ⅱ模型[9]作為基礎燃料詳細模型,直接用于對正辛烷、異辛烷和甲基環(huán)己烷的描述。對正丁基苯,其氧化和熱解反應的中間產物實驗數(shù)據(jù)顯示[10-11],反應過程中生成了大量乙基苯(A1C2H5)、苯乙烯(A1C2H3)等芳香烴中間產物,而USC-Mech-Ⅱ模型對該類物質及其化學反應的描述不完善,因此,本文加入了部分化學反應,用以描述該類芳香烴物質的消耗。化學反應包括新產生自由基A1CH2·、A1C2H4·參與的正丁基苯脫氫反應及上述R、A1CH2·和A1C2H4·自由基參與的乙苯(A1C2H5)的脫氫反應。需要指出的是,補充該部分反應的目的是闡述該簡化建模方法對烷基芳香烴氧化反應的可行性,未來可進一步完善其動力學描述。
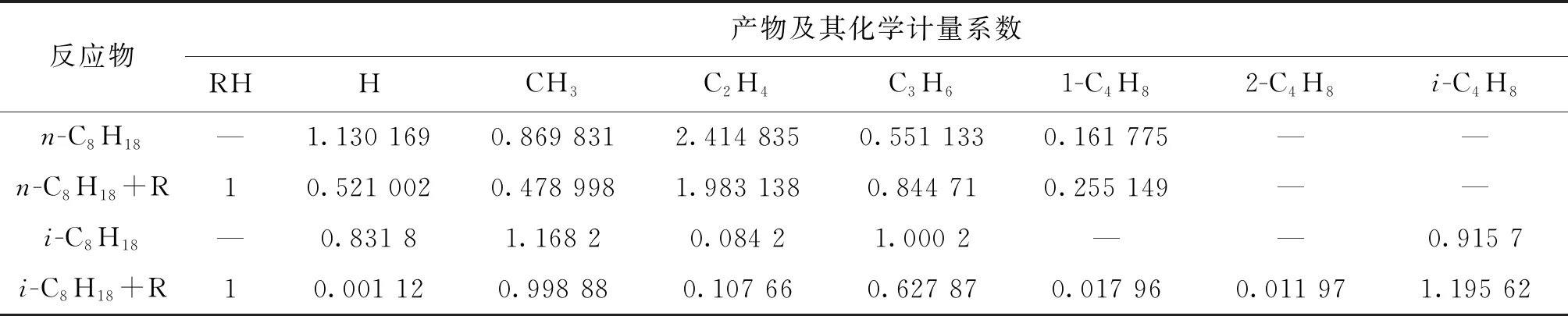
表1 正辛烷和異辛烷高溫熱解反應簡化動力學模型
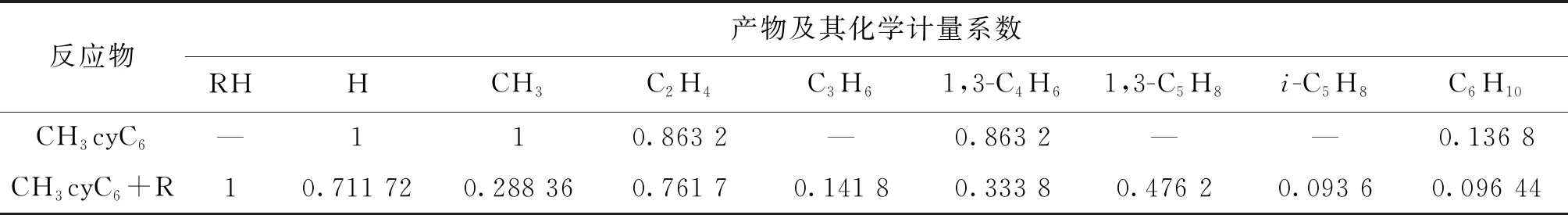
表2 甲基環(huán)己烷高溫熱解反應簡化動力學模型

表3 正丁基苯高溫熱解反應簡化動力學模型
由于表1~表3所示總包反應為不可逆反應,因此母燃料的熱力學數(shù)據(jù)不會對動力學產生影響,但其會影響燃燒系統(tǒng)絕熱溫度等。母燃料的熱力學數(shù)據(jù)和輸運參數(shù)來自勞倫斯實驗室詳細機理(LLNL)或JetSurF v1.1詳細機理,或通過官能團貢獻法確定。
1.3 動力學模型的計算
4類燃料(即正辛烷、異辛烷、甲基環(huán)己烷和正丁基苯)的簡化動力學模型在溫度T=800~1 400 K、壓力p=0.01~5 MPa、當量比φ=0.5~∞范圍內均適用。所有動力學模擬均在動力學軟件Ansys@ChemKin Pro中進行,采用的模塊包括活塞流反應器(PFR)、射流反應器(JSR)、零維全混流反應器和預混層流燃燒火焰。使用來源較寬廣實驗條件的基礎燃燒實驗數(shù)據(jù),包括高溫熱解和氧化反應中間產物分布、點火延時時間和層流燃燒速率等,對簡化模型進行驗證。作為參照,本文同時選取LLNL詳細機理[12-14]進行對比驗證。
2 結果與討論
2.1 熱解反應和氧化反應的重要中間產物
2.1.1 正辛烷 圖2和圖3分別對比了正辛烷(n-C8H18)氧化反應和熱解反應主要中間產物的實驗值與模擬值。其中,氧化實驗數(shù)據(jù)來自流動管反應器系統(tǒng)[15],其具體條件為φ=0.99,T=1 076 K,p=0.1 MPa,nN2∶nO2∶n燃料=66∶1.2∶0.095。實驗及模擬數(shù)據(jù)包括燃料轉化及主要中間產物,后者包括乙烯(C2H4)、丙烯(C3H6)、甲烷(CH4)、1-丁烯(1-C4H8)和氧化終產物,即一氧化碳(CO)和二氧化碳(CO2)。熱解實驗數(shù)據(jù)來自射流攪拌反應器系統(tǒng)[16],其具體條件為停留時間τ=0.9 s,T=873~1 073 K,p=0.1 MPa,nN2∶n燃料=99.6∶0.4。根據(jù)1 000 K下生成量的多少,中間產物依次為C2H4、C3H6、CH4、1-C4H8、1,3-丁二烯(1,3-C4H6)和乙烷(C2H6)。前4種化合物占據(jù)了燃料的大部分碳,1,3-C4H6和C2H6來自以上主要中間產物的二次反應。
需要指出的是,圖2及之后流動管反應器系統(tǒng)的模擬(圖4和圖8)時間均有不同程度的平移,其中,正辛烷的氧化反應模擬中,本模型模擬時間向左平移5 ms,LLNL機理模擬時間向左平移30 ms;異辛烷的氧化反應模擬中,本模型和詳細機理模擬時間均向左平移10 ms;正丁基苯的氧化反應模擬中,本模型模擬時間向左平移11 ms,詳細機理向右平移10 ms。這是由于理想流動管反應器模擬的初始條件會產生初始化的擾動,但不影響反應的時間或空間梯度。平移反應時間或空間是消除初始化擾動最簡單有效的方式,且無其他影響,故在流動管反應器的模擬中適當平移可以使燃料轉化與實驗值匹配[17]。相對于LLNL詳細機理,本簡化模型預測值與實驗值均吻合良好。對于圖3的熱解數(shù)據(jù),LLNL機理的預測值在實驗測量誤差范圍內,而本簡化模型的預測值更接近實驗測量值。
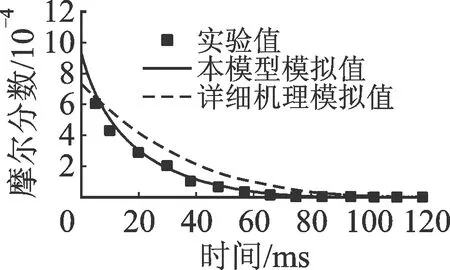
(a)n-C8H18
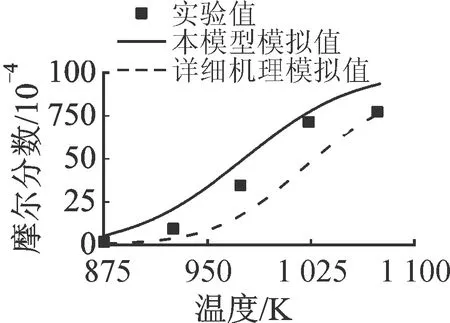
(a)C2H4
2.1.2 異辛烷 圖4和圖5分別對比了異辛烷(i-C8H18)氧化反應和熱解反應主要中間產物的實驗值與模擬值。與正辛烷類似,異辛烷氧化反應和熱解反應實驗數(shù)據(jù)分別來自流動管[15]和射流反應器系統(tǒng)[16],其中氧化反應具體條件為φ=0.99,T=1 080 K,p=0.1 MPa,nN2∶nO2∶n燃料=66∶1.2∶0.095;熱解反應具體條件為τ=0.9 s,T=873~1 073 K,p=0.1 MPa,nN2∶n燃料=99.6∶0.4。相對于正辛烷,異辛烷轉化過程的主要中間產物為異丁烯(i-C4H8)、C3H6、CH4和C2H4(C2H6為以上產物的二次反應產物)。該主要中間產物的不同可能導致正辛烷和異辛烷宏觀燃燒特性不同,包括點火延時時間、層流燃燒速率等。
本文簡化模型與LLNL詳細機理對氧化反應中燃料轉化和產物生成的預測十分接近,均較好復現(xiàn)了i-C4H8和C3H6,而對CH4和C2H4的預測稍顯不足。對于熱解反應,兩類反應模型對CH4的預測差別較大,分別稍高和稍低于實驗值;而對其他產物類似,均較好地預測了其生成和消耗趨勢。
2.1.3 甲基環(huán)己烷 圖6和圖7分別對比了甲基環(huán)己烷(CH3cyC6)氧化反應和熱解反應主要中間產物的實驗值與模擬值。氧化和熱解反應數(shù)據(jù)均來自流動管反應器,其中氧化反應的具體條件為φ=1.3,T=1 161 K,p=0.1 MPa,燃料摩爾分數(shù)為0.181 5%;熱解反應具體條件為T=1 155 K,p=0.1 MPa,燃料摩爾分數(shù)為0.166 4%,O2摩爾分數(shù)為0.018%。由于環(huán)狀結構的出現(xiàn),甲基環(huán)己烷氧化和熱解反應的主要中間產物,除了CH4、C2H4、C3H6等C1~C3組分,1,3-C4H6代替丁烯異構物(C4H8)成為來自燃料直接轉化的主要中間產物(而非來自其他產物的二次反應),同時產生異戊二烯(i-C5H8)。
由圖6和圖7可見,本簡化模型與LLNL詳細機理對部分產物的預測值差別較大。具體地,本模型較好地預測了CH4、C2H4、1,3-C4H6和CO、CO2的生成或生成和消耗趨勢,而對C3H6的預測值過低。相反,詳細模型對C3H6的預測值則過高。對熱解數(shù)據(jù)的預測,兩類模型呈現(xiàn)類似的趨勢。
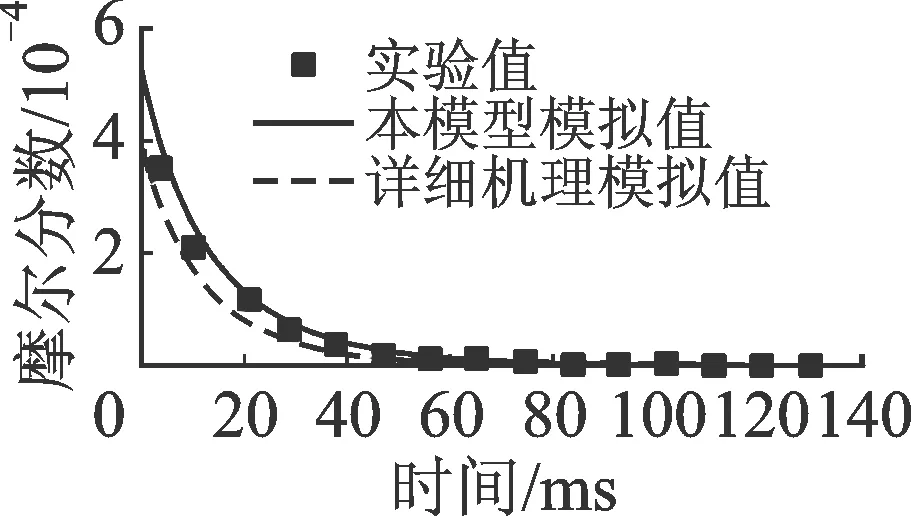
(a)i-C8H18

(a)CH4
2.1.4 正丁基苯 圖8和圖9分別對比了正丁基苯(A1C4H9)氧化和熱解反應實驗值與模擬值。氧化和熱解反應數(shù)據(jù)均來自流動管反應器,其中氧化反應的具體條件為φ=0.98,T=1 069 K,p=0.1 MPa,燃料摩爾分數(shù)為0.062%,O2摩爾分數(shù)為0.85%;熱解反應的具體條件為T=985~1 226 K,p=0.003 947 MPa,nN2∶n燃料=99∶1。由圖可見,由于苯環(huán)結構的出現(xiàn),正丁基苯的轉化除了生成CH4、C2H4、C3H6等C1~C3組分,也生成另外3類芳香烴物質甲苯(A1CH3)、苯乙烯(A1C2H3)和乙苯(A1C2H5),取代C1~C4物質成為主要中間產物。

(a)CH3cyC6
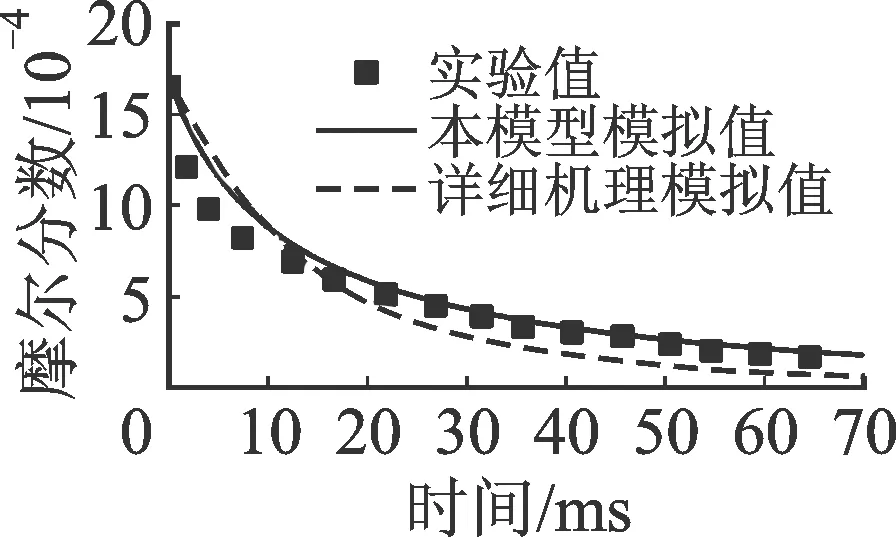
(a)CH3cyC6

(a)A1C4H9
圖9顯示,兩種模型對熱解反應過程的燃料消耗及中間產物濃度變化的預測接近且整體與實驗值吻合良好。而由圖8可見,對于氧化反應,本文模型對燃料消耗的預測過慢,LLNL詳細機理的預測則過快;中間產物預測方面,本模型對CH4、C2H4、C3H6等小分子物質的生成和消耗過程,以及A1C2H5、A1C2H3等大分子物質的生成過程預測良好,而對C6H6、A1CH3的預測過低。相對地,詳細機理除對C2H4和C6H6的預測過高,總體對A1C4H9的氧化過程模擬優(yōu)于簡化模型。這說明本模型對USC-Mech-Ⅱ模型添加的A1C2H5、A1C2H3等芳香烴的化學反應依然不夠完全。
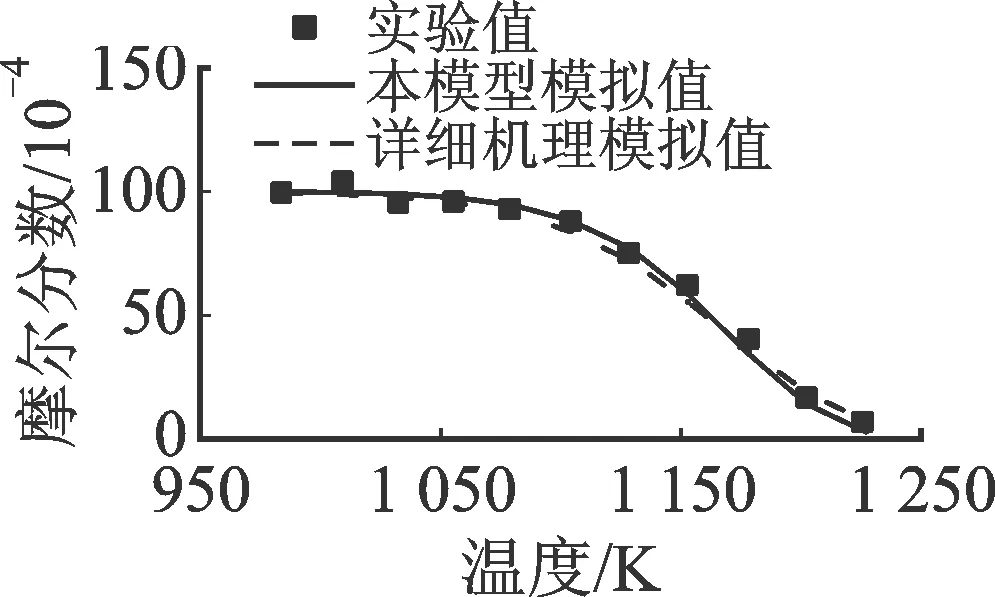
(a)A1C4H9
2.2 燃料熱解產物的碳分布
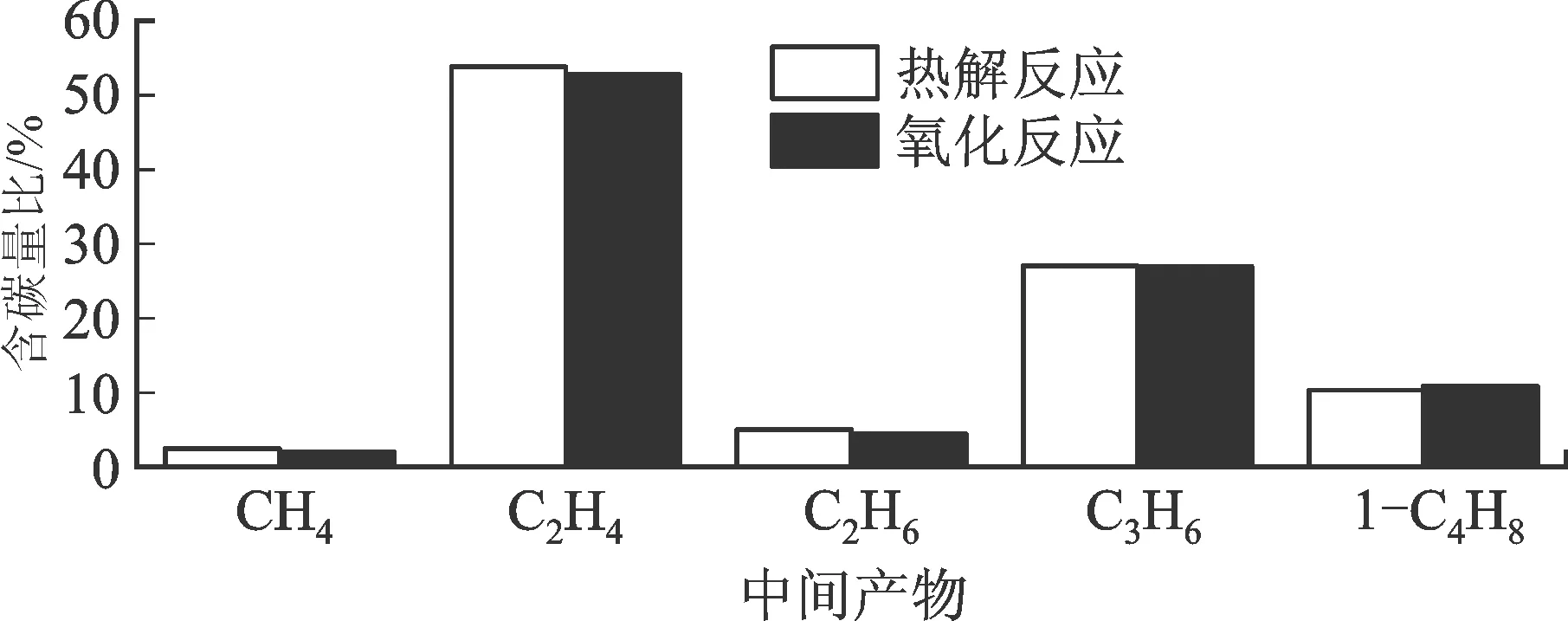
為探究4類燃料的中間產物分布對整個燃燒過程的影響,本節(jié)考察了各主要中間產物的碳分布,即中間產物含碳量與燃料轉化碳量的比值。圖10為4類燃料在燃料轉化率為50%時主要中間產物的碳分布。由圖可見,氧化和熱解反應的碳分布幾乎相同,說明氧氣對中間產物的碳分布影響較小;在燃料消耗盡之前,其作用主要是增加反應系統(tǒng)活性,提升反應系統(tǒng)整體轉化速率。
(a)n-C8H18
4類燃料的縱向比較顯示,正辛烷、異辛烷最主要的中間產物是C1~C4中的烯烴(占燃料轉化碳含量的90%以上)。其中,正辛烷以C2H4為主,其次為C3H6和1-C4H8;異辛烷以1,3-C4H8為主,其次為C3H6。甲基環(huán)己烷的主要中間產物仍然是C1~C4,其中以C2H4和1,3-C4H6為主,但由于加入了環(huán)結構,還產生了1,3-C5H8、i-C5H8以及環(huán)己烯(C6H10);由于正丁基苯含有芳烴環(huán),A1C2H5和A1C2H3等成為主要的中間產物,C1~C4中僅C2H4作為主要中間產物。這也說明正丁基苯中間產物模擬出現(xiàn)偏差的主要原因是基礎燃料模型對芳香烴動力學描述不完善。如2.4和2.5節(jié)所述,以上含不同官能團的4類燃料主要中間產物的不同將導致不同的宏觀燃燒特性。
2.3 熱解模型分析
大分子燃料的高溫熱解簡化模型包含7個總包反應,分別為1個C—C鍵離解反應(R1)以及6個脫氫反應,即燃料+H·(R2),燃料+CH3·(R3),燃料+OH·(R4),燃料+HO2·(R5),燃料+O·(R6),燃料+O2(R7)。為探究以上各反應對燃料轉化的影響,本節(jié)通過敏感性系數(shù)和相對燃料消耗率(即每個反應消耗速率與總消耗速率之比)比較了R1~R7在燃料消耗中的作用。
圖11比較了4類燃料在50%轉化率時反應R1~R7的敏感性系數(shù)和相對燃料消耗率。除了甲基環(huán)己烷中R3是最重要的反應外,其他3類燃料最重要的反應均是R1,其次是R2或R3。正辛烷的相對燃料消耗率由大到小依次是R2、R1、R3和R4~R7,甲基環(huán)己烷為R2、R3、R4、R1和其他,而異辛烷和正丁基苯中則為R1、R2、R3和R4~R7。

(a)n-C8H18
綜上,R1,即燃料C—C鍵離解反應在燃料轉化中作用最顯著,不僅作為起始反應,產生最初的H·、CH3·等活性自由基,而且是燃料消耗的主要方式。R2和R3,即H·和CH3·參與的燃料脫氫反應也對燃料消耗有很大貢獻,而含氧自由基的影響則相對有限。
2.4 點火延時時間
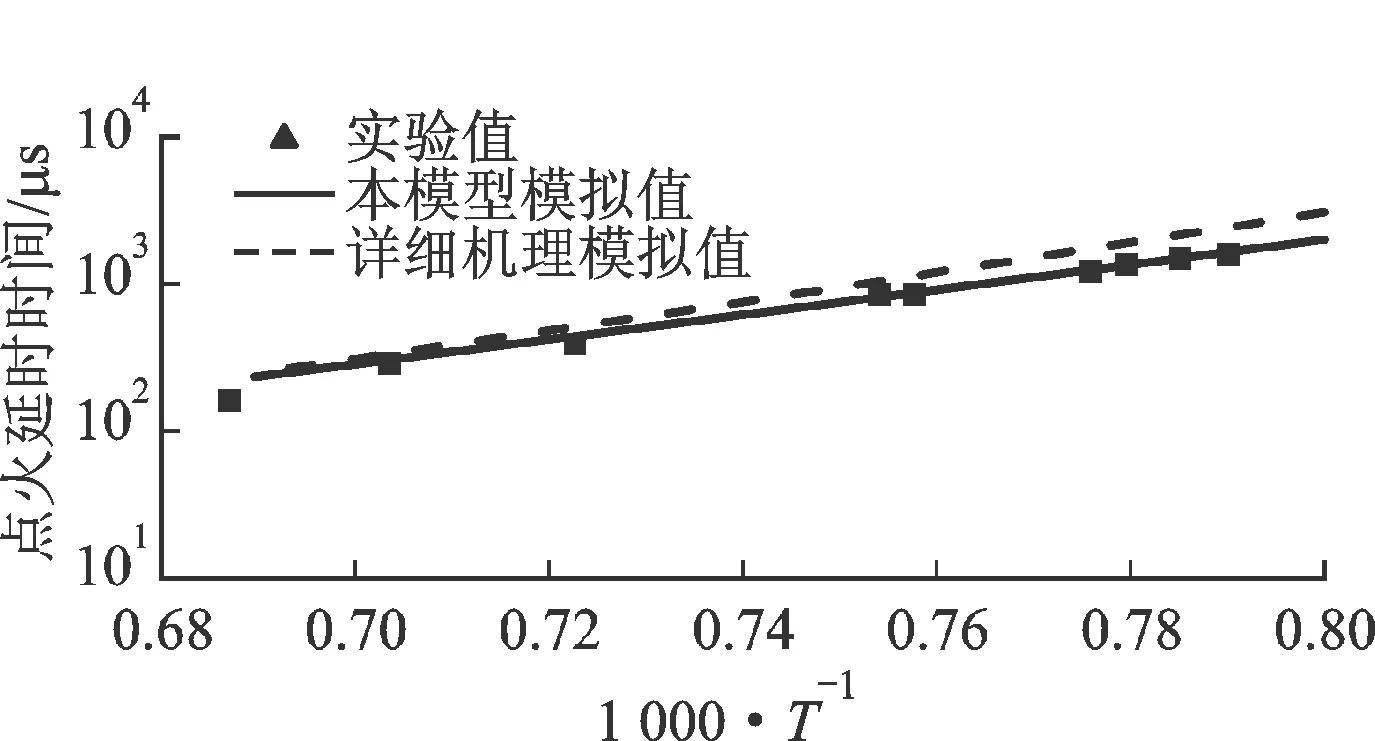
圖12比較了4類燃料的點火延時時間實驗值和模擬值。數(shù)據(jù)均來自激波管,具體實驗條件為:對于正辛烷[22],燃料+4% O2+Ar,φ=0.98,p=0.2 MPa;對于異辛烷[23]和甲基環(huán)己烷[24],燃料+4% O2+Ar,φ=0.98,p=0.15 MPa;對于正丁基苯[25],燃料+空氣,φ=0.98,p=0.1 MPa。總體而言,本簡化模型和LLNL詳細機理的預測值均與實驗值吻合良好。
(a)n-C8H18
4類燃料的縱向對比顯示,相同實驗條件下(注:正丁基苯在空氣中,其他3類燃料在4% O2+Ar中),點火延時時間從小到大依次為正辛烷、甲基環(huán)己烷、異辛烷和正丁基苯。結合2.2節(jié)的碳分布比較,正辛烷的中間產物以C2H4為主、甲基環(huán)己烷以C2H4和1,3-C4H6為主、異辛烷以i-C4H8為主;而C2H4、C4H6、i-C4H8的點火延時時間依次增加[19-21],即各主要中間產物的活性依次降低,從而導致其母燃料類似的點火特性。
2.5 層流燃燒速率的驗證
4類燃料的層流燃燒速率實驗值和模擬值的比較如圖13所示。具體實驗條件為:對于正辛烷[27-28],T=353 K,p=0.1,0.2 MPa;對于異辛烷[29-31],p=0.1 MPa,T=298,353 K;對于甲基環(huán)己烷[26],p=0.1 MPa,T=353,403 K;對于正丁基苯[14],p=0.1 MPa,T=358,398 K。本小節(jié)對正辛烷、異辛烷和正丁基苯詳細機理的層流燃燒速率驗證,來自LLNL或更新過的LLNL詳細機理,而甲基環(huán)己烷來自JetSurF v1.1機理[26](LLNL詳細機理缺少甲基環(huán)己烷反應體系的物質輸運參數(shù))。如圖13所示,除本簡化模型對正丁基苯在稀燃區(qū)的預測處于實驗誤差下邊緣外,兩類模型對所有燃料在不同實驗條件下的預測值均與實驗值吻合良好。正丁基苯出現(xiàn)該模擬結果的原因可追溯至基礎燃料模型USC-Mech-Ⅱ缺少對其熱解產物主要中間產物(A1C2H5、A1C2H3等)的動力學描述,而這也正說明燃料的宏觀燃燒特性主要由中間產物的燃燒化學反應特性決定。

(a)n-C8H18,353 K,0.1 MPa
2.6 模型簡化
以上述已建立好的n-C8H18簡化模型為例,采用誤差傳播直接關系圖譜法對其進一步簡化。原始簡化模型包含124個化學組分和854個基元反應,簡化后,化學反應和基元反應的數(shù)量分別為56個和387個。顯然,結合其他簡化方法,簡化后的模型規(guī)模或可進一步縮小。由圖14可見,模型簡化前后,對點火延時時間和層流燃燒速率的預測吻合良好。該簡化模型的規(guī)模可與先進計算流體力學CFD軟件或代碼有效耦合,用于對真實發(fā)動機系統(tǒng)的仿真模擬。
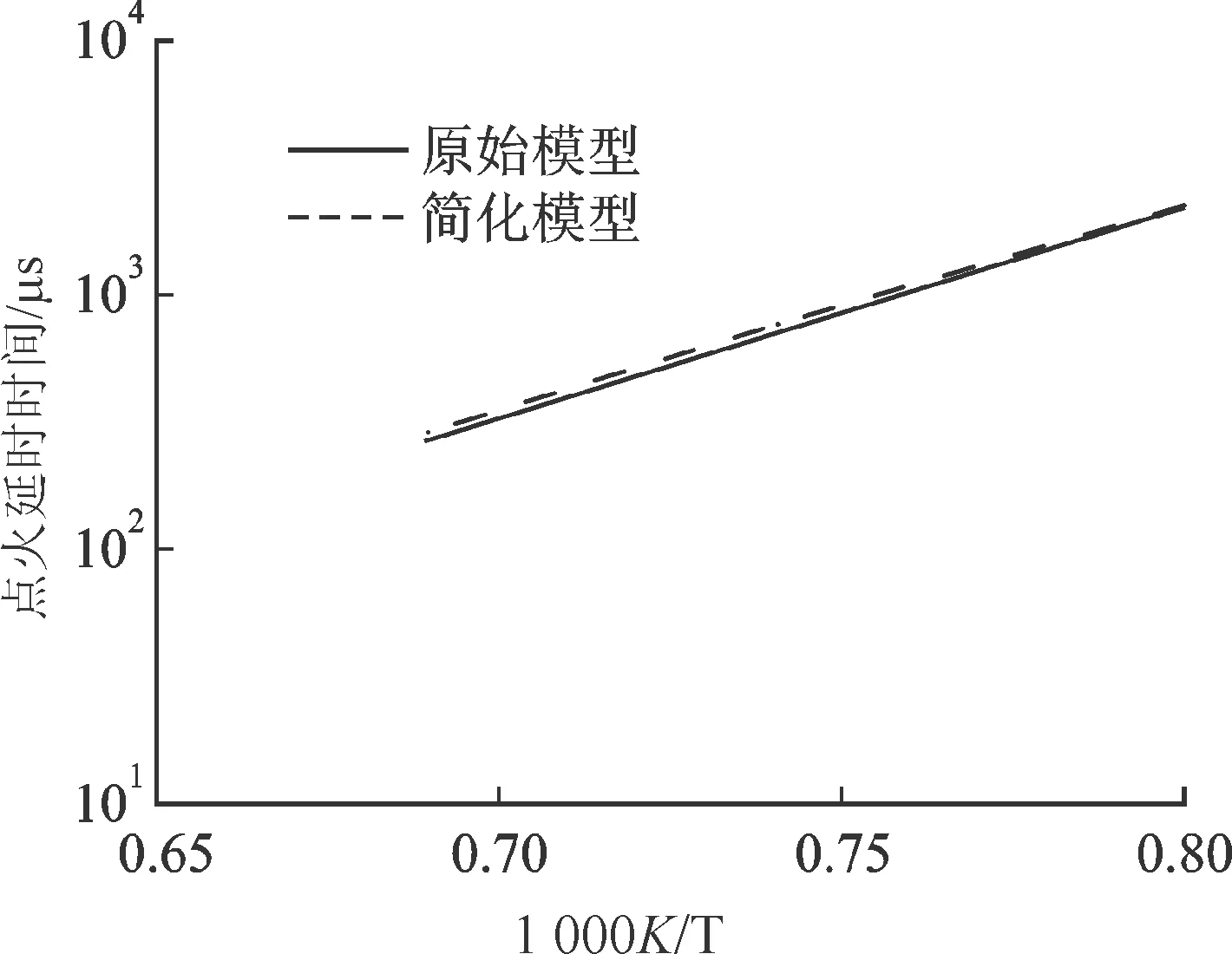
(a)模型簡化前后點火延時時間對比
3 結 論
本文建立了正辛烷、異辛烷、甲基環(huán)己烷和正丁基苯等含4類官能團的大分子碳氫燃料的簡化動力學模型。經(jīng)與基礎燃燒反應動力學數(shù)據(jù),包括氧化反應和熱解反應重要中間產物分布、點火延時時間、層流燃燒速率等的對比,顯示本簡化建模方法不僅對直鏈烷烴和支鏈烷烴有較好描述,同時也適用于環(huán)烷烴和烷基芳香烴的燃燒化學。該簡化模型僅包含124個化學組分和854個基元反應,可進一步縮減。以n-C8H18為例,進一步簡化后,化學反應和基元反應的數(shù)量分別為56和387個。為進一步擴展該方法的使用范圍,下一步研究將探究該類簡化建模方法擴展至較低溫度區(qū)域(包括負反應溫度系數(shù)區(qū)域,即NTC區(qū)域)的情況。

