橡膠樹紅根病病原菌LAMP檢測方法的建立及應用
賀春萍 董文敏 吳偉懷 梁艷瓊 李銳 謝立 黃興 易克賢

摘? 要:由靈芝菌(Ganoderma pseudoferreum)引起的紅根病是橡膠上危害面積最廣、影響最大的世界性根部傳染性病害。本研究利用環介導等溫擴增技術(LAMP),以G. pseudoferreum線粒體Large rDNA特異片段為靶標序列,設計出G. pseudoferreum 特異性LAMP引物,以SYBR Green I為指示劑,建立基于顏色判斷的直觀、快速、靈敏的G. pseudoferreum LAMP檢測方法,優化了反應體系和條件,進行了特異性、靈敏度及田間疑似病樣的檢測驗證。結果表明:整個試驗檢測時間僅需80 min,在等溫64 ℃條件下反應1 h能特異性檢測出G. pseudoferreum;特異性檢測中,G. pseudoferreum菌株擴增后呈陽性(綠色),而其他真菌均為陰性(橙色)。該技術最低檢測限為110?5 ng/μL。田間疑似病樣LAMP體系檢測,病原檢出率為85%。本研究建立的LAMP檢測技術為橡膠樹紅根病菌的快速鑒定提供了新技術。
關鍵詞:靈芝菌;環介導等溫擴增;分子檢測
中圖分類號:S794.1;S763.7? ? ? 文獻標識碼:A
Abstract: Rubber tree red root disease caused by Ganoderma pseudoferreum is proved to be a serious disease, which is the most widespread and harmful to rubber tree (Hevea brasiliensis) production. This study reports the development of a loop-mediated isothernal amplification (LAMP) assay targeting the mitochondria large rDNA for visual detection of G. pseudoferreum. The mitochondria large rDNA-LAMP assay efficiently amplified the target gene within 80 min at 64 ℃ (in 1 hour) and was evaluated for specificity and sensitivity. A positive color or (green) was only observed in the presence of G. pseudoferreum by SYBR Green I as an indicator reaction after amplification; however none of other pathogens changed color (still orange). The lower limit of detection of the LAMP assay was about 110?5 ng/μL of genomic DNA, which was 1000 times more sensitive than the PCR method. Twenty strains of suspected samples in the field were tested by the LAMP system with the pathogen detection rate was 85%. This method would provide a new technology for the rapid identification of G. pseudoferreum.
Keywords: Ganoderma pseudoferreum; loop-mediated isothermal amplification; molecular detection
DOI: 10.3969/j.issn.1000-2561.2021.01.025
天然橡膠是全球重要的工業原料和戰略物資,是國防工業和高端裝備生產中不可替代的重要原料[1]。橡膠樹根病是由植物病原真菌侵染橡膠樹根部引起,常造成根頸部腐爛,嚴重時導致植株死亡。由橡膠靈芝菌(Ganoderma pseudo ferreum)侵染引起的紅根病是天然橡膠生產中危害面積最廣、影響最大的世界性根部傳染性病害,主要分布在東南亞從印度尼西亞到巴布亞新幾內亞和新卡里多尼亞、馬來西亞、菲律賓、科特迪瓦等熱帶地區。在中國所有種植橡膠的地區普遍發生紅根病,發病嚴重林段發病率達40%,若未及時防治,死亡率可達100%[2]。紅根病菌的寄主非常廣泛,除危害橡膠樹外,還侵染刀把木、厚皮樹、三角楓、苦楝樹、臺灣相思、山枇杷、柑橘、可可、咖啡、荔枝、茶樹、雞血藤等多種植物[3]。紅根病病菌生長緩慢,形態學鑒定困難。當植株地上部表現明顯癥狀時,紅根病菌可能已傳染至其他鄰近膠樹,常錯過最佳防治時機。因此建立一種快速鑒定橡膠樹紅根病菌的早期檢測技術,對于生產上指導該病害防治和減少病害損失具有重要現實意義。
目前對橡膠樹紅根病菌的檢測以病癥識別和組織分離病原菌及形態鑒定為主,但傳統方法耗時長、專業性強、靈敏度低,難以達到快速鑒別的目的。利用分子生物學技術檢測該病病原菌的方法有普通PCR法[4-6],雖然能夠較準確檢測出病原菌,但需要PCR儀、電泳儀和凝膠成像系統等高價的專業儀器設備和分子生物學專業的實驗操作人員,不適宜在田間以及基層大規模應用,使病情無法及時、準確地檢測及有效防控。
環介導等溫擴增技術(loop-mediated isothermal amplification, LAMP)是近年發展起來的應用微生物快速檢測的分子生物學技術[7]。該技術可在恒溫條件下,利用高活性的鏈置換DNA聚合酶(Bst DNA polymerase)對目的DNA片段進行特異性擴增[8],60~65 ℃恒溫反應30~60 min便能達到109~1010個拷貝數量級。該技術不用進行變性、退火、延伸等一系列溫度變化,無需特殊高端的儀器設備,恒溫水浴鍋即可滿足實驗需求,具有快速、簡便、高效、靈敏、經濟等特征。目前該技術已在植保等諸多領域得到廣泛應用[9-10],極大地提高了鑒定效率和準確率。建立可視化、快速、靈敏、便捷的橡膠樹紅根病菌LAMP檢測技術可為橡膠樹紅根病的發生和防治提供重要的技術手段。
1? 材料與方法
1.1? 材料
1.1.1? 供試菌株? 橡膠樹紅根病菌(G. pseudoferreum)菌株GP011、GP014、GP021、GP043,橡膠樹褐根病菌(Phellinus noxius)菌株Pn008、Pn012、Pn020,橡膠樹紫根病菌(Helicobasidium compactum)菌株HC001,橡膠樹白根病菌(Rigidoporus lignosus)菌株RL004,橡膠樹臭根病菌(Sphaerostilbe repens)菌株Sr001,橡膠樹炭疽病菌(Colletotrichum gloeosporioides)菌株RC178,柱花草炭疽病菌(C. gloeosporioides)菌株CH008,芒果炭疽病菌(C. gloeosporioides)菌株MT1,橡膠樹白粉病菌(Oidium heveae Steinm)菌株BF1和劍麻斑馬紋病菌(Phytophora nicotianae)菌株BM1,均為中國熱帶農業科學院環境與植物保護研究所熱帶特色經濟作物病害研究組分離、鑒定和保藏。
1.1.2? 供試試劑? 氨芐青霉素(Amp)、E. coli trans T1、pEASY-T1 Cloning vector、10 mmol/L? dNTPs購于北京全式金生物技術有限公司;Plasmid Mini Kit I、Fungal DNA Kit、Gel extraction Kit均購于美國Omega公司;DL2000 Maker、10×rTaq Buffer、2.5 mmol/L dNTPs、rTaq DNA Polymerase均購自TaKaRa公司;甜菜堿Betaine(B8230)、SYBR Green I核酸染料、Golden View I核酸染色劑購自Solarbio公司;瓊脂糖(Agarose)購自西班牙Biowest公司。NEB 3.0 Bst-DNA Polymerase、10×Bst-DNA Polymerase Buffer、100 mmol/L MgSO4均購自北京NEB生物技術有限公司。
1.2? 方法
1.2.1? 病原菌培養及核酸提取? 將供試菌株的菌絲塊分別轉至馬鈴薯葡萄糖液體培養基(PDB)中,置于28 ℃、180 r/min搖床中振蕩培養7~10 d后過濾,收集菌絲,冷凍干燥,提取總DNA。病原菌總DNA的提取參照試劑盒(Fungal DNA Kit)說明書進行。所提取的DNA保存在?20 ℃冰箱中備用。
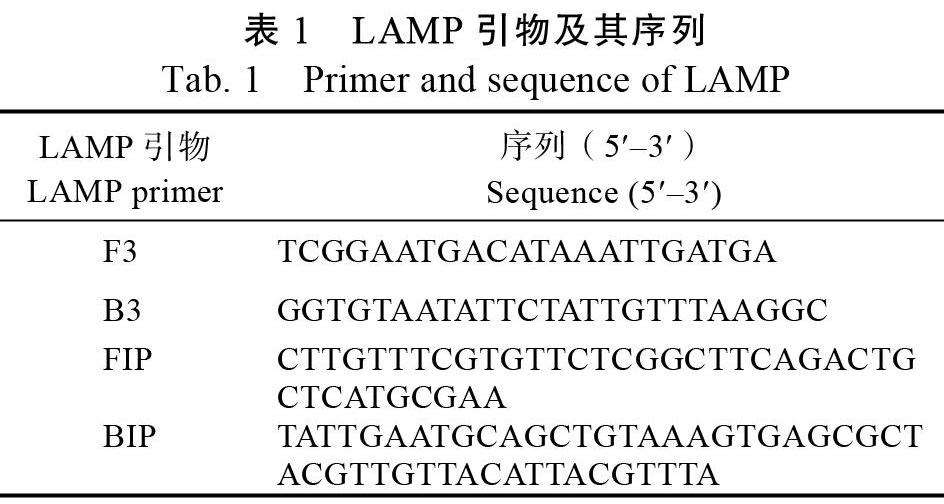
1.2.2? 引物設計與合成? 參照文獻[11]提供的通用線粒體Larage rDNA引物對提取的橡膠樹紅根病病菌橡膠靈芝菌(G. pseudoferreum)進行擴增測序。通過大量比對GenBank中下載不同種和屬的同源性G. pseudoferreum的線粒體Larage rDNA基因的核酸序列,找到多態性豐富區段(特異序列)并應用在線軟件Primer Explorer V4(http:// primerexplorer.jp/e/)設計用于LAMP的外引物F3和B3,內引物FIP和BIP(表1)。設計的引物由英濰捷基(上海)貿易有限公司合成。引物用ddH2O溶解后分裝保存于?20℃備用。
1.2.3? LAMP反應體系及反應條件優化? 參考吳家林等[12]的方法并略作改動,對LAMP反應體系中的各反應組分濃度進行優化。對引物配比進行優化,設定內外引物配比比例分別為2∶1、4∶1、6∶1、8∶1;dNTPs終濃度分別為0、0.2、0.4、0.8、1.0、1.2、1.4、1.6 mmol/L;Mg2+終濃度分別為2、3、4、6、8 mmol/L;甜菜堿終濃度分別為0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mol/L;反應溫度分別設為57、58、59、60、61、63、64、65 ℃;反應時間分別為15、30、45、60、75、90 min。每個因子設置3個重復,以確定最佳反應體系及反應條件。擴增反應結束后,加入1 μL SYBR Green I進行熒光染色,觀察反應管顏色變化,若反應管呈現亮綠色則反應呈陽性,若為橙色,則反應為陰性[13]。將反應產物進行2%瓊脂糖凝膠電泳檢測,如凝膠電泳圖為瀑布狀梯形條帶即為陽性,反之則為陰性。
1.2.4? LAMP檢測的特異性? 利用1.2.3中優化的反應體系對1.1.1中所述供試菌株進行LAMP擴增,驗證其特異性。反應產物分別經2%瓊脂糖凝膠電泳和SYBR Green I染色觀察。
1.2.5? LAMP檢測的靈敏度? 通過超微量分光光度計(NanoDrop 2000c)將橡膠樹紅根病菌菌株GP021基因組DNA初始濃度調整為100 ng/?L,并將其依次稀釋為101、100、10?1、10?2、10?3、10?4、10?5、10?6、10?7 ng/μL 10個不同濃度梯度。每個梯度設3個重復,將3個重復混合,取1 μL不同濃度的模板用于LAMP反應,無菌水作為空白對照。2%瓊脂糖凝膠電泳檢測擴增結果,并通過SYBR Green I顯色驗證。
為了比較LAMP和普通PCR間的靈敏度,使用LAMP外引物F3和B3(表1)進行PCR擴增,DNA初始濃度與LAMP靈敏度檢測設置的濃度一致。PCR反應體系:10 mmol/L dNTPs 2 μL,10×Ex Taq buffer 2.5 μL,2.5 μmol/L引物F3/B3各1 μL,Ex Taq酶0.5 μL(2.5 U),模板1 μL,補充ddH2O至25 μL。PCR反應程序為:94 ℃ 3 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,擴增35個循環,72 ℃ 10 min。PCR擴增產物在2%瓊脂糖凝膠上電泳檢測。
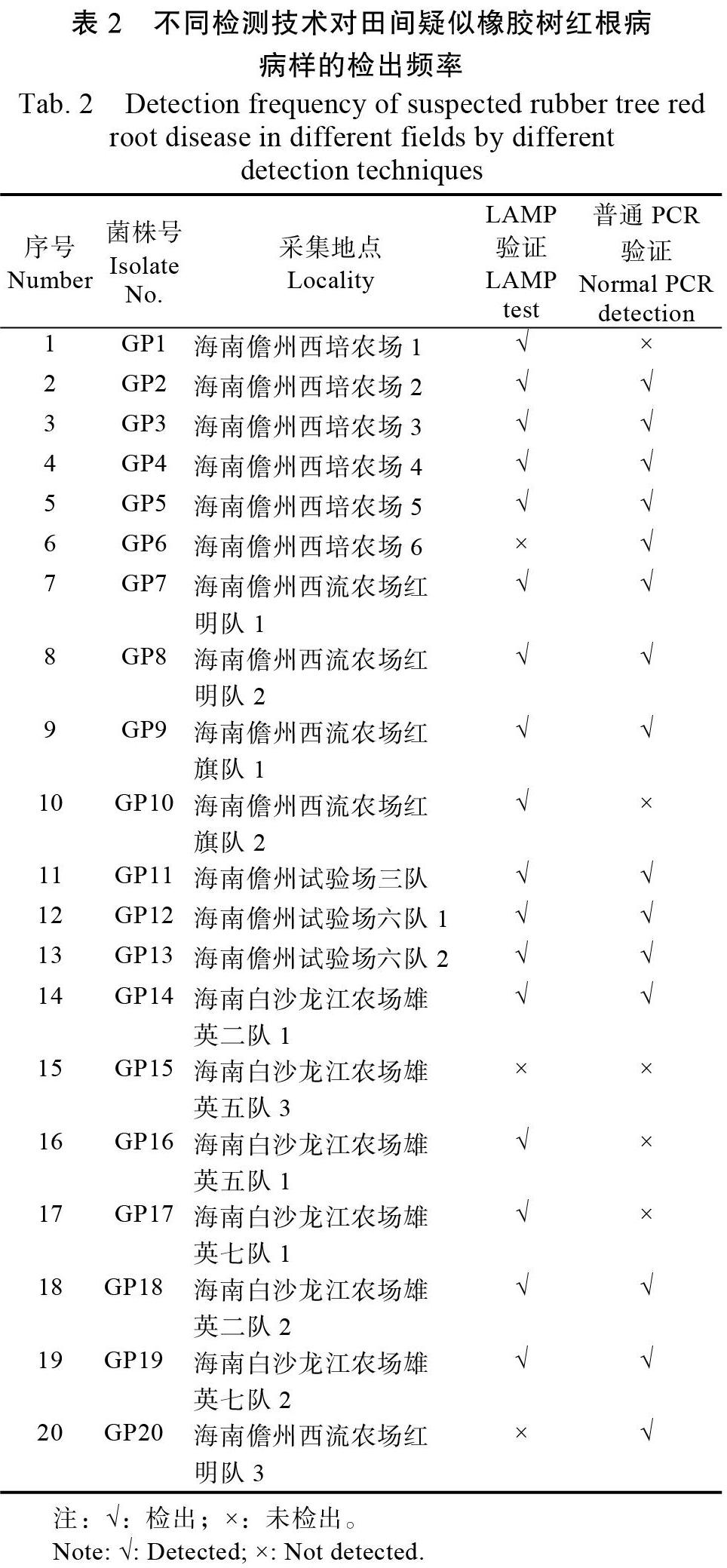
1.2.6? 田間樣本檢測? 選用來自海南儋州、白沙等地樣本共20份(表2)。樣本有褐色壞死的莖基部、根組織,有病根表皮變棗紅色或黑紅色木質部,或木質部變海綿狀濕腐,皮木間有白色至深黃色腐竹狀菌膜,有半圓形或不規則形灰褐色、紅褐色或黑褐色子實體。采用普通PCR法、基于環介導等溫擴增技術(LAMP)方法對20份樣品進行分析診斷。對發病的莖基部、根組織及子實體,取病/健交界處剪碎,將剪碎的樣品利用天根植物組織基因組DNA試劑盒提取病部組織DNA。以橡膠樹健康植株基因組DNA為對照,進行普通PCR和LAMP擴增。普通PCR擴增使用引物F3/B3,反應體系與方法如1.2.5所述;LAMP使用引物F3/B3和FIP/BIP,反應體系與方法如1.2.3所述。
2? 結果與分析
2.1? LAMP檢測體系的優化
2.1.1? 反應體系優化? 通過對LAMP反應體系中各組分濃度的優化,確定用于檢測橡膠樹紅根病菌的LAMP最佳反應體系為:F3和B3各為0.2 μmol/L,FIP和BIP各為1.2 μmol/L,dNTPs為1.4 mmol/L,Mg2+為4 mmol/L,甜菜堿為0.8 mol/L,Bst-DNA Polymerase為8 U/μL,模板DNA為1 μL,10×Bst-DNA Polymerase Buffer?2.5 μL,加ddH2O補足25 μL。
2.1.2? 反應條件優化? 采用上述最佳反應體系進行最適反應溫度的篩選,結果表明,在57、58、59、60、61、63、64、65 ℃ 8個不同的反應溫度下均有擴增,且產物經瓊脂糖凝膠電泳檢測后均可見梯狀條帶,當加入熒光染色劑SYBR Green I后反應液均由橙色變為綠色,但在64 ℃溫度條件下,反應擴增效率高,顏色變化明顯,故確定LAMP反應溫度為64 ℃(圖1A,圖1B)。
如圖2A、圖2B所示,在所設置的6個反應時間下,15 min時不能進行擴增反應,在反應30、45 min時,條帶較為暗淡,在60、75、90 min時均可以很好地擴增。在反應60 min時,條帶較為清晰且加入染色液后產物顏色變化明顯,故確定LAMP反應時間為60 min。
2.2? LAMP特異性檢測
用優化的LAMP反應體系對橡膠樹紅根病菌以及擔子菌的其他屬、其他真菌等15個菌株進行LAMP擴增,以ddH2O作為陰性對照以驗證引物的特異性。凝膠電泳結果表明,4株橡膠樹紅根病菌菌株DNA擴增產物均出現梯狀條帶,而其余11個陰性菌株及空白對照均未出現任何條帶(圖3A)。LAMP擴增反應結束,反應管中加入SYBR Green I染料后,其中橡膠樹紅根病菌反應管呈現綠色,為陽性反應,而其他對照病原菌及空白對照反應管中反應液均保持橙色(圖3B)。表明本LAMP引物對橡膠樹紅根病菌的檢測具有很好的特異性。
2.3? LAMP檢測的靈敏度
以菌株GP021的DNA濃度稀釋梯度(1× 102~1×10?7)ng/μL為模板,進行LAMP擴增反應,凝膠電泳檢測表明:當模板濃度為1× 10?5 ng/μL時,可見明顯的梯狀條帶(圖4A);加入SYBR Green I染料后顯色結果表明,當模板濃度為1×10?5 ng/μL時,反應液顏色由橙色變為綠色(圖4B),與凝膠電泳結果一致。說明LAMP檢測的最低檢測限度為1×10?5 ng/μL,即10 fg/μL。
以菌株GP021的DNA濃度稀釋梯度(1× 102~1×10?7)ng/μL為模板,以LAMP外引物F3和B3進行普通PCR擴增,結果表明:模板DNA含量為(1×102~110?2)ng/uL時均能檢測到明顯的目的條帶,為陽性反應(圖4C);而110?2 ng/uL濃度下的DNA表現為陰性擴增。由此表明PCR檢測的最低檢測濃度為10 pg/uL。從圖4對比中可以得出LAMP檢測的靈敏度是普通PCR的1000倍。
2.4? 田間樣本檢測
對田間采集的20份樣本分別利用普通PCR法和LAMP法進行檢測。結果顯示,用所建立的LAMP方法進行擴增,有17份樣本呈現明顯的擴增片段,表明17份樣本中有G. pseudoferreum,檢出率為85%(表2);利用LAMP特異性外引物的普通PCR進行檢測,檢出15份陽性,檢出率75%(表2)。普通PCR法檢測效率低于LAMP法。綜上所述,LAMP法特異性強、靈敏度高,檢測時間短,適合于田間或基層樣品的快速檢測。
3? 討論
LAMP是一種可以在恒溫條件下,高效、特異、快速的核酸擴增技術。該技術具特異性強、靈敏度高、檢測時間短(1.5 h)、無需高價儀器設備、檢測結果可視化等優點,在植保等諸多領域有廣泛報道。國外學者最初通過LAMP檢測番茄花葉病毒病[14]。Shan等[15]利用LAMP于玉米秸稈內快速檢測出鐮刀菌,從而防止鐮刀菌產生的毒素進入食物鏈。陸辰晨[13]建立的LAMP技術可以檢測大豆根腐病等多種不同病原菌。王賢達等[16]利用環介導等溫擴增技術檢測柑橘黃龍病病原菌,檢測靈敏度達10?6 ng/uL,是普通PCR的1000倍,為柑橘黃龍病早期診斷提供了快速檢測的方法[16]。橡膠樹紅根病病菌生長極為緩慢,分離培養階段易受其他微生物污染,分離成功率低;且不易產孢,病原鑒定困難。因此,相對于傳統病原真菌分離來說,建立高效、靈敏、快速、簡便的病原早期分子檢測技術在病害防治中尤為重要。
LAMP檢測方法的建立中,靶標基因篩選和引物設計是實驗成功的關鍵因素。本研究最初利用G. pseudoferreum ITS、tef-1α、β-tublin基因設計引物均未能得到多態性豐富區域(特異區間),后利用rDNA基因通用引物[11]進行序列擴增獲得G. pseudoferreum的多態性豐富區域,設計了5組LAMP引物反復篩選,結果表明所設計的引物其特異性滿足實驗要求。內、外引物濃度比是影響LAMP成功擴增的重要因素之一,外引物濃度過低,將導致反應不完全,濃度過高將抑制內引物的起始擴增。外引物濃度一般是內引物濃度的1/4~ 1/10[12]。本研究通過優化確定適宜的內、外引物濃度比為6∶1,確定了G. pseudoferreum最優LAMP反應體系及反應條件,結合SYBR Green I的顯色,建立了橡膠樹紅根病菌的可視化LAMP檢測方法。
本文首次報道了應用LAMP技術檢測G. pseudoferreum,相對于傳統PCR技術,該方法具有特異性高(識別靶序列6個獨立區域)、檢測成本低(64 ℃恒溫水浴鍋完成,無需PCR等高價儀器)、反應時間短(擴增反應僅需1 h)、靈敏度高(最低檢測限10 fg/μL)和結果判定簡便(反應液加入SYBR Green I可視化)等優勢;而普通PCR雖能較準確檢測出病原菌,但耗時長,需要PCR儀、電泳儀、凝膠成像系統等高價儀器和專業操作人員;傳統的組織分離、病菌形態鑒定的方法耗時長、專業性強、靈敏度低,難以達到快速鑒定的目的。LAMP技術相比于傳統組織分離培養的繁瑣費時以及PCR儀器的檢測高成本,其優勢突顯,適用于田間、基層樣品的初篩和快速檢測。本研究中通過對20份田間疑似病樣進行分離、檢測,其中利用LAMP檢測出17份樣品呈陽性,普通PCR檢測出15份呈陽性,而病樣組織分離培養僅4份樣品分離出G. pseudoferreum。由于G. pseudoferreum分離培養耗時長、分離成功率低、鑒定專業性強,因此所建立的快速、靈敏、準確、高效、結果可視化的LAMP檢測技術對G. pseudoferreum早期分子檢測具有較大的優勢,對及時、科學、有效防治橡膠樹紅根病和減少經濟損失具有重要現實意義。
參考文獻
王立豐, 陳月異, 田維敏. 巴西橡膠樹光合作用研究與展望[J]. 熱帶作物學報, 2011, 32(1): 176-181.
白建相, 王? 涓, 黃? 林, 等. 云南河口墾區橡膠樹根病普查及治理方法探討[J]. 熱帶農業科技, 2008, 31(4): 7-11.
李增平, 羅大全. 橡膠樹病蟲害診斷圖譜[M]. 北京: 中國農業出版社, 2007: 59-64.
彭? 軍, 張? 賀, 張? 欣, 等. 橡膠樹紅根病病原菌rDNA- ITS序列鑒定[J]. 熱帶作物學報, 2014, 35(7): 1393-1397.
Wang X C, Xi R J, Li Y, et al. The species identity of the widely cultivated Ganoderma, ‘G. lucidum (Ling-zhi), in China[J]. PLoS One, 2012, 7(7): e40857.
Cao Y, Wu S H, Dai Y C. Specids clarification of the prize medicinal Ganoderma mushroom ‘Lingzhi[J]. Fungal Diversity, 2012, 56(1): 49-62.
Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): 63.
Dai T T, Lu C C, Lu J, et al. Development of a loop-mediated isothermal amplification assay for detection of Phytophthora sojae[J]. FEMS Microbiology Letters, 2012, 334(1): 27-34.
Qin W T, Wang Z Y, Zhang H. Application of loop-mediated isothermal amplification in detecting plant pathogens[J]. Journal of Agricultural Science and Technology, 2013, 15(3): 169-174.
彭丹丹, 張源明, 舒燦偉, 等. 植物病原真菌分子檢測技術的研究進展[J]. 基因組學與應用生物學, 2017, 36(5): 2015-2022.
White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//Innis M A, Gelfand D H, Sninsky J J, et al. PCR Protocols: A guide to methods and applications. Academic Press, San Diego, 1990: 315-322.
吳家林, 沙? 丹, 馬廣源, 等. 沙門氏菌LAMP檢測方法的建立[J]. 中國病原生物學雜志, 2015, 10(7): 611-614.
陸辰晨. 基于環介導等溫擴增技術快速診斷大豆根部主要病害的研究[D]. 南京: 南京農業大學, 2015.
Shiro F, Shinro K, Keiko Y, et al. Detection of tomato yellow leaf curl virus by loop-mediated isothermal amplification reaction[J]. Journal of Virological Methods, 2003, 112(1/2): 35-40.
Shan L, Abdul H H, Zhang J, et al. A loop-mediated isothermal amplification (LAMP) assay for the rapid detection of toxigenic Fusarium temperatum in maize stalks and kernels[J]. Intetnational Journal of Food Microbiology, 2019, 291: 72-78.
王賢達, 林雄杰, 胡菡青, 等. 柑橘黃龍病可視化LAMP檢測技術的建立及應用[J]. 熱帶作物學報, 2014, 35(5): 918-924.
責任編輯:謝龍蓮

