微塑料對抗生素的吸附研究
鄒繼穎,劉 輝,呂逸寒,常文晉,王晨宇,甄 妮,王 靜,于久茹,王 雪
(吉林化工學院 資源與環境工程學院,吉林 吉林 132022)
塑料由于其所具有的優異的物理性能和化學性能而在世界范圍內得到廣泛使用.自2014年以來,塑料的生產和消費量每年高達3億噸[1],但只有不到10%的塑料能夠回收[2].據估計,到2050年,將有120億噸塑料廢物堆積在垃圾填埋場或自然環境中[2],這將給全世界帶來嚴重的微塑料污染.微塑料是指小于5 mm的塑料顆粒,其起源于含有塑料微珠的產品的排放或環境中塑料碎片的分解和風化[3].微塑料的化學性質相對穩定,其降解過程非常緩慢[4],因此微塑料在環境中可能會持續很長時間[5].研究表明在水環境中聚乙烯(PE),聚苯乙烯(PS),聚丙烯(PP),聚酰胺(PA)和聚氯乙烯(PVC)是經常被檢測到的微塑料.微塑料能夠聚積不同的毒性物質和化學污染物,并且成為其遠距離遷移的載體.水中存在很多污染物,由于這些污染物對塑料介質的親和力高于水,因此可能會在微塑料顆粒上累積高[6].因此,研究污染物在微塑料上的吸附行為對于了解其在生態系統中的遷移具有重要意義.
微塑料和抗生素是兩類新興污染物,對水生態系統有負面影響.抗生素在微塑料上的吸附可能導致它們的長距離運輸,并可能引起化合物的組合效應.作為一類新興污染物,抗生素由于其對微生物群落的影響以及耐藥基因的產生而受到越來越多的關注[7-8].每年都有大量抗生素釋放到環境中.有研究指出,四環素、大環內酯類、氟喹諾酮類和磺酰胺類是全世界水生環境中經常檢測到的抗生素[9-12].發現甲氧芐啶,氟喹諾酮和磺酰胺等抗生素在地表水中穩定[13].更重要的是,殘留的抗生素可能會對相關水生生物造成較高的生態風險[14].如果微塑料吸附抗生素,則由于污染的協同作用對水生生物的毒性都可能更高[15].因此,有必要了解不同種類的抗生素和微塑料之間可能發生的反應,以評估其環境風險.
1 材料與方法
1.1 儀器設備
電子天平(FA2004N,上海菁海儀器有限公司);超聲波清洗機(JP-010T,深圳市潔盟清洗設備有限公司);紫外分光光度計(T9,北京普析有限公司);旋轉培養器(WH-962B,太倉市華利達實驗設備有限公司).
1.2 材料與試劑
土霉素(C22H24N2O9),環丙沙星(C17H18FN3O3),無水氯化鈣,硫酸鎂,碳酸氫鈉,氯化鉀和氫氧化鈉,產地均為天津市大茂化學試劑廠,以上試劑均為分析純.使用微塑料有氯化聚乙烯(CPE)、聚乙烯(PE)和聚氯乙烯(PVC),粒徑<250 μm,購自淘寶網.
1.3 試驗方法
取適量土霉素標準品分別溶于純水和人工配置的淡水中,配制成250 mg/L的濃度作為貯備液,置于4 ℃的冰箱中避光保存.使用液與所留樣品也均需要避光保存.
吸附實驗環丙沙星設置5個濃度梯度(0.5 mg/L,1 mg/L,2 mg/L,4 mg/L,8 mg/L),土霉素設置5個濃度梯度(0.5 mg/L,1.5 mg/L,3 mg/L,10 mg/L,20 mg/L),每個濃度設置2組平行.用貯備液配置成相應濃度的抗生素使用液,純水組和淡水組分別用純水和淡水稀釋定容,然后將其分別超聲5 min,使其中的物質均勻.
準確稱取一定量CPE、PE和PVC,分別加入不同的EPA玻璃瓶中.在不同的瓶中加入相應濃度梯度的溶液,擰緊瓶蓋使特氟龍膜緊貼瓶口.將玻璃瓶置于旋轉培養器中避光振蕩,過濾,用紫外分光光度計測量.
抗生素在微塑料上的吸附量可用公式(1)計算:
(1)
其中:qe為平衡吸附量(mg/kg);Co、Ce為初始濃度和平衡濃度(mg/L);ρ為抗生素儲備液的濃度
(g/ml);m0為空瓶的質量(g);m1為加完微塑料后的質量(g);m2為加完抗生素使用液后的質量(g).實驗數據利用Origin 2018進行分析.
2 結果與討論
2.1 不同微塑料對抗生素的吸附
環丙沙星和土霉素在氯化聚乙烯、聚乙烯和聚氯乙烯上的Freundlich等溫吸附曲線如圖1所示.所得的擬合參數及其結果如表1所示.

Cw/(mg·L-1)(a)
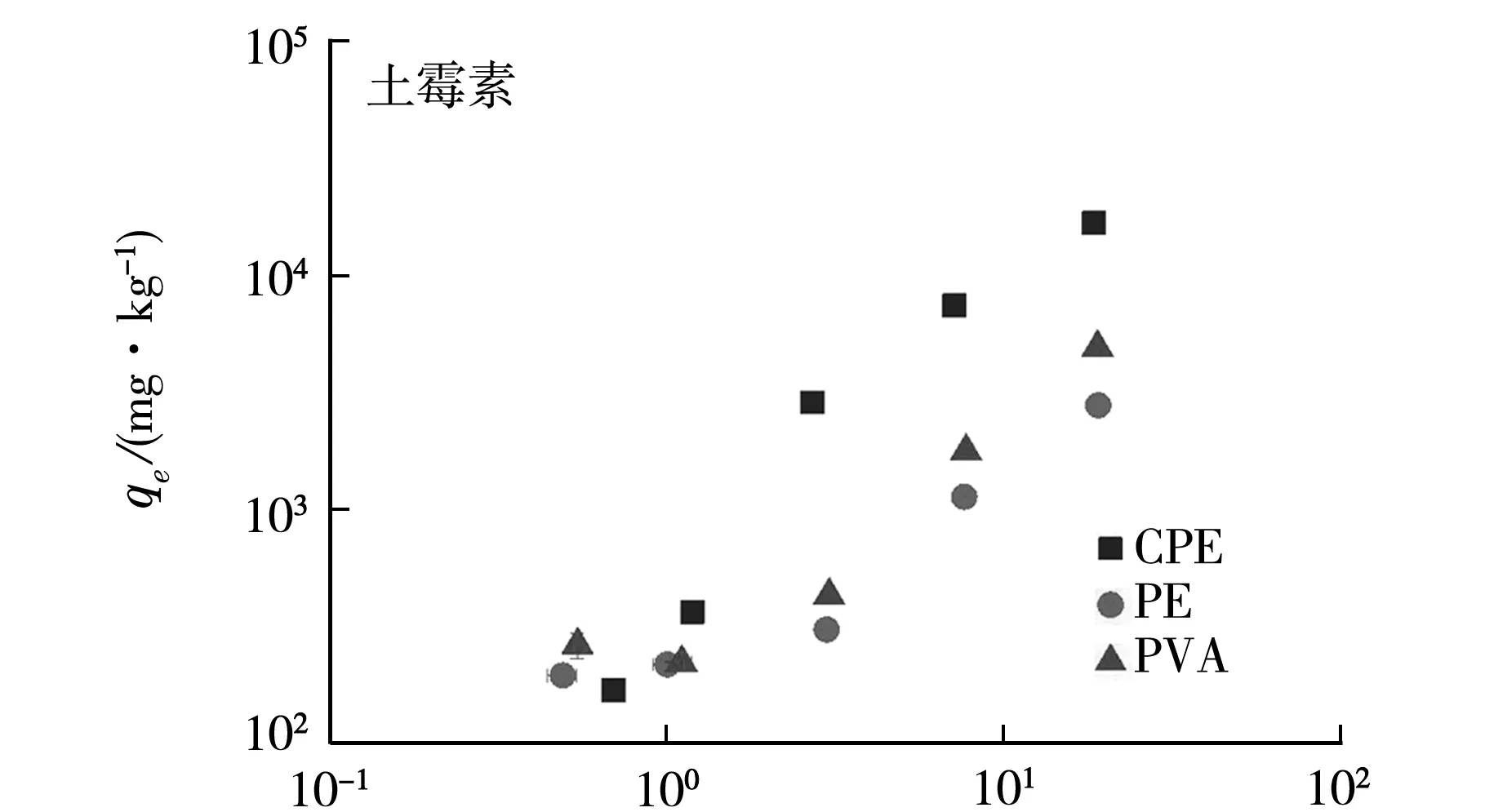
Cw/(mg·L-1)(b)圖1 不同微塑料對兩種抗生素的吸附

表1 純水中抗生素在微塑料上吸附的Freundlich等溫模型參數
在Freundlich模型中,土霉素對CPE的等溫吸附曲線擬合的參數n值為0.95,KF值為1 046 mg1-nLn/kg;土霉素對PE的等溫吸附曲線擬合的參數n值為1.01,KF值為141 mg1-nLn/kg;土霉素對PVC的等溫吸附曲線擬合的參數n值為1.17,KF值為158 mg1-nLn/kg,對比以上數據可知微塑料對土霉素的吸附作用的強弱可按以下順序:CPE>PVC>PE.并且這種現象產生的原因可能是微塑料的理化性質和結構的差異,有研究得出微塑料的理化性質能夠影響其吸附污染物的能力[16].CPE對于土霉素的吸附作業最強,PE和PVC對土霉素的吸附差異不顯著,在不同背景溶液下其吸附特性略有差異,但總體上的吸附能力的強弱還是不變的.由此可見在人類環境中,微塑料對于抗生素的吸附效果是極為顯著的,微塑料能作為抗生素的載體使其的遷移范圍更加廣泛.
在純水環境下,環丙沙星在CPE、PE和PVC上的等溫吸附特性均可由Freundlich模型來描述.微塑料在純水中對環丙沙星的吸附行為由上可知,主要由Freundlich模型擬合來描述其吸附特性.環丙沙星對于CPE、PE和PVC在非線性模型(Freundlich 模型)上的擬合呈現出較高的R2值.實驗研究結果表明,不同種類微塑料對同種類抗生素的吸附反應機制是不同的.在Freundlich 模型中,環丙沙星對CPE的等溫吸附曲線擬合的參數n值為1.24,KF值為1 097 mg1-nLn/kg;環丙沙星對PE的等溫吸附曲線擬合的參數n值為1.46,KF值為86 mg1-nLn/kg;環丙沙星對PVC的等溫吸附曲線擬合的參數n值為0.45,KF值為130 mg1-nLn/kg.在純水條件下,不同類型的微塑料對環丙沙星的吸附容量存在差異.根據3種微塑料對環丙沙星的最大吸附量,可將其按以下順序:CPE>PVC>PE.綜上所述,CPE對于環丙沙星的吸附作用最強,其次為PVC,最后為PE.這種現象可能是由于微塑料的理化性質和結構,或者是背景溶液的差異所引起的.為更清楚的了解其影響因素,則需要對其吸附機理做進一步的探究.
2.2 不同抗生素在微塑料上的吸附
如表1所示,CPE對環丙沙星的吸附KF與對土霉素吸附的KF值差距不顯著,PE和PVC對環丙沙星吸附的KF值明顯低于對土霉素吸附的KF值.如圖2所示同種微塑料對于不同的抗生素吸附量不同.

Cw/(mg·L-1)(a)

Cw/(mg·L-1)(b)

Cw/(mg·L-1)(c)圖2 微塑料對不同抗生素的吸附
由圖2可以看出CPE對環丙沙星的吸附能力大于對土霉素的吸附能力,而PE和PVC對土霉素的吸附能力大于對環丙沙星的吸附能力.結果表明,抗生素的性質會影響吸附結果.土霉素對PE和PVC的親和力要高于環丙沙星,而CPE對環丙沙星的親和力要高于土霉素.由此可見,抗生素的性質對微塑料吸附能力有影響.
抗生素為離子化合物,由于自身性質不同,在不同水環境中會呈現不同的離子形態,如陰離子、陽離子、兩性離子.抗生素不同的離子形態會對微塑料的吸附作用產生影響.3種微塑料在水環境中均帶負電荷,在純水體系中,環丙沙星由于自身的陽離子狀態通過靜電力提高了微塑料的吸附能力.因此抗生素的種類會影響微塑料的吸附能力.
2.3 在不同背景溶液中微塑料對抗生素吸附
圖3是在不同背景溶液中微塑料對抗生素吸附的熱力學曲線,表2是Freundlich等溫模型參數.如圖3,在純水環境中PE對土霉素的吸附作用比在淡水中的吸附作用差異不顯著;CPE在純水中對環丙沙星的吸附能力比在淡水中的更強.表2可以看出,在淡水中CPE微塑料對環丙沙星的吸附KF值為219 mg1-nLn/kg 低于環丙沙星在純水中吸附的KF值1 097 mg1-nLn/kg,在淡水中PE微塑料對土霉素的吸附KF值為219 mg1-nLn/kg 略高于在純水中的吸附KF值141 mg1-nLn/kg.背景溶液的差異會影響微塑料對抗生素的吸附作用,在淡水環境中CPE微塑料對環丙沙星的吸附明顯變小.由于電解質可能與吸附質存在競爭吸附位點的關系,因此離子強度在一定程度上會對靜電力產生影響[17].當離子強度增加時,如 Na+和 Ca2+等陽離子可能由于靜電引力吸附至微塑料表面從而與吸附質競爭吸附位點,此外,無機可交換陽離子(如 Na+)可以代替酸性基團的氫離子,進而抑制氫鍵的合成[18].有研究表明隨著離子強度的升高不同種類的吸附劑(如海底沉積物、土壤)對不同種類抗生素的吸附能力將會降低[19].以上結果表明在純水環境中,抗生素更容易在微塑料上吸附,而抗生素在淡水的遷移過程中可能會發生解吸,并且在食物鏈中發生聚積和生物放大.

Cw/(mg·L-1)(a)

Cw/(mg·L-1)(b)圖3 不同背景溶液對吸附能力的影響

表2 淡水中抗生素在微塑料上吸附的Freundlich等溫模型參數
3 結 論
論文主要研究了土霉素和環丙沙星在氯化聚乙烯、聚乙烯和聚氯乙烯上的吸附行為,進行等溫吸附實驗,得出以下結論:
(1)土霉素在3種微塑料上的吸附可由Freundlich等溫模型來描述.微塑料對土霉素的吸附作用的強弱可按以下順序:CPE>≤PVC>PE.
(2)微塑料在純水中對環丙沙星的吸附行為可以由Freundlich 等溫模型來描述.微塑料對環丙沙星的吸附作用的強弱依次為CPE>PVC>PE.
(3)在純水環境中PE對土霉素的吸附作用與在淡水中的吸附作用差異不顯著;CPE在純水中對環丙沙星的吸附能力比在淡水中的更強.背景溶液中的離子強度對吸附過程有影響.

