伴有TCF3-PBX1重排的兒童急性淋巴細胞白血病的臨床特征和預后效果
楊振中 張 陽 陳 瑜 劉 衡*
(貴州省人民醫院兒內科,貴州 貴陽 550002)
融合基因是血液系統腫瘤主要的分子生物學標志之一,與疾病的診斷、預后評估及療效監測息息相關。t(1;19)(q23;p13)是急性淋巴細胞白血病(acute lymphoblastic leukemia,ALL)的一種染色體結構性異常,該易位導致TCF3-PBX1融合基因的形成,其編碼蛋白導致PBX1靶基因表達失控,進而誘發白血病[1]。既往研究認為,伴有TCF3-PBX1重排的B系ALL對化療反應差,中樞神經系統復發率高,預后不良[2-4]。近年來,有研究發現,增加化療強度可提高此類患者的存活率,改善預后[5-6]。由于該疾病的發病率低,國內目前對此類患者的臨床與實驗室特點、療效與預后的報道較少。本研究旨在探討伴有TCF3-PBX1重排的兒童ALL的臨床特征和預后效果。
1 資料與方法
1.1 一般資料 選取2012年12月至2018年12月我院收治的242例0~14歲兒童ALL中12例為TCF3-PBX1陽性組,以同期B系ALL中危組中32例TCF3-PBX1陰性患兒作為對照組。所有患兒監護人均簽署知情同意書。
1.2 方法 所有病例初診時均采用MICM(細胞形態學、免疫學、細胞遺傳學及分子生物學)分型診斷。采集骨髓標本進行涂片,常規瑞氏染色及髓過氧化物酶(POX)染色、糖原(PAS)染色,在低倍鏡下觀察骨髓有核細胞增生程度,在油鏡下計數分析100個有核細胞。取骨髓標本通過流式細胞儀檢測白血病細胞免疫表型;取骨髓標本經24 h培養G顯帶進行染色體核型分析,部分病例通過熒光原位雜交(fluorescence in situ hybridization,FISH)檢測TCF3-PBX1易位;所有病例均通過多重巢式逆轉錄聚合酶鏈反應(multiplex-nested RTPCR)篩查白血病常見融合基因。所有病例的危險度分組與治療均按照CCLG-ALL2008方案進行,其中危險度分層指標包括年齡、診斷時外周血白細胞計數、潑尼松誘導試驗反應、誘導治療第33天、鞏固治療第8天骨髓緩解狀態(BM)、細胞遺傳學或分子生物學異常[7]。
1.3 觀察指標
1.3.1 微小殘留病監測(MRD) 分別于誘導緩解第33天、鞏固化療第8天采集骨髓標本,采用八色流式細胞術監測MRD,MRD<10-4視為陰性。
1.3.2 CNS分級 根據腦脊液白細胞計數及細胞形態學、臨床表現和影像學檢查結果,將CNS分為3級,即CNS1級、CNS2級、CNS3級,具體參見文獻[8]。
1.3.3 完全緩解與復發標準 完全緩解(CR)標準為骨髓原幼淋巴細胞小于5.00%,且無髓外白血病浸潤表現;復發標準為骨髓細胞形態學檢查原幼淋巴細胞大于25.00%或骨髓外任何部位發現白血病浸潤表現[9]。
1.4 統計學處理 采用SPSS22.0統計學軟件進行處理。計數資料采用[n(%)]表示,兩樣本率的比較采用χ2檢驗;組間均數比較采用t檢驗。采用Kaplan-Meier法評估無事件生存率(EFS)值及總生存期(OS)值;OS時間為從診斷之日起至任何原因死亡或隨訪終點的時間間隔;EFS時間從診斷之日起至白血病復發或任何原因死亡的時間間隔。P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者一般情況及MICM診斷結果 2012年12月至2018年12月筆者所在醫院共收治242例兒童ALL(B-ALL 210例,T-ALL 32例),其中12例伴有TCF3-PBX1重排,占患者總數的4.96%。12例患兒白血病細胞免疫表型均為B淋巴系表型,其中8例為前B細胞型(pre-B),占66.67%,其余4例為普通B細胞型(common-B),占33.33%,無T-ALL、成熟B-ALL、pro-B等其他表型。12例患兒初診時G顯帶法染色體核型分析結果顯示:不平衡易位即der(19)t(1;19)(q23;p13)4例(33.33%),平衡易位即t(1;19)(q23;p13)3例(25.00%),具有正常染色體核型(即46,XY或XX)3例(25.00%)。另外2例(16.67%)未見可供分析的中期分裂相。12例患兒初診時取骨髓標本,采用多重巢式RT-PCR法對TCF3-PBX1基因進行檢測,12例患兒均檢測到TCF3-PBX1基因重排;鞏固強化治療及全程化療結束后,采集骨髓標本應用RT-PCR方法對TCF3-PBX1融合基因進行定性及定量檢測,12例患兒TCF3-PBX1融合基因均轉為陰性。
2.2 初診時TCF3-PBX1陽性ALL與對照組之間臨床特征比較 12例伴有TCF3-PBX1重排的ALL患者初診時乳酸脫氫酶(LDH)水平顯著高于對照組(P<0.05),而性別、年齡、白細胞計數及中樞神經系統受累情況與對照組比較差異無統計學意義(P>0.05)。見表1。
2.3 TCF3-PBX1陽性組與對照組早期治療反應比較 兩組誘導緩解化療第33天骨髓細胞形態學均獲CR。TCF3-PBX1陽性組誘導緩解第33天骨髓MRD12例(100.00%)均小于10-4,對照組28例(87.50%)小于10-4(P>0.05)。鞏固治療第8天兩組骨髓MRD均<10-4。見表2。
2.4 TCF3-PBX1陽性組與對照組遠期預后效果比較 TCF3-PBX1陽性組的12例患兒隨訪均未發現中樞神經系統復發,對照組2例骨髓復發,1例單純中樞神經系統復發。TCF3-PBX1陽性組患者3年無事件生存率為(91.72±8.03)%,OS(91.72±8.03)%,對照組EFS(90.61±5.04)%,OS(93.81±4.33)%,兩組3年EFS或OS比較差異無統計學意義(P>0.05)。見表3。
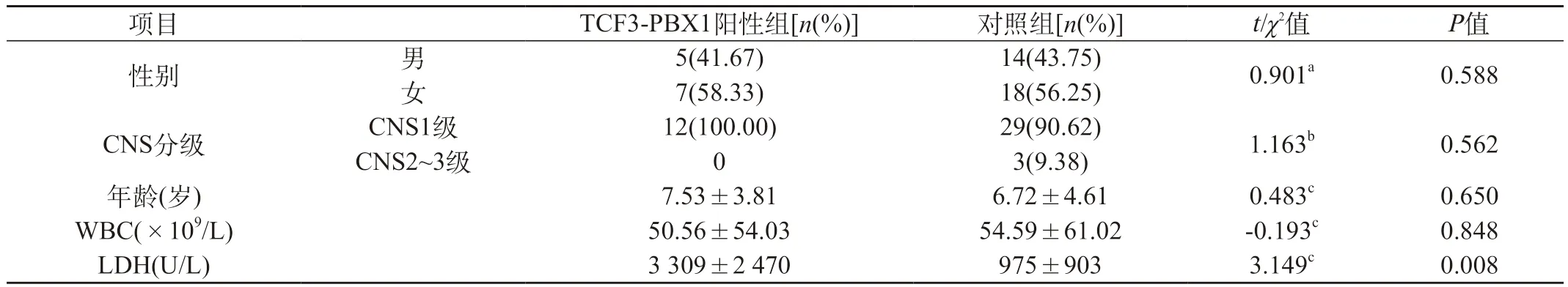
表1 初診時TCF3-PBX1陽性組與對照組之間臨床特征比較

表2 TCF3-PBX1陽性組與對照組早期治療反應比較

表3 TCF3-PBX1陽性組與對照組遠期預后效果比較
3 討 論
ALL是一組異質性很高的疾病,重現性遺傳學異常不僅可作為診斷依據,還與預后效果關聯密切,是ALL分層治療的重要依據。TCF3-PBX1定義為前驅淋巴系腫瘤的一種獨立亞型[10]。E2A是調控B細胞發育的一種螺旋-環-螺旋轉錄因子,而PBX1是一種同源結構域蛋白,t(1;19)(q23;p13)易位導致E2A-PBX1融合基因形成。雖然有研究發現約0.6%的新生兒臍血標本中可檢測出TCF3-PBX1融合基因,但該融合基因的形成目前一般認為是出生后獲得性的[11]。該融合基因編碼的轉錄因子通過RUNX1依賴與非依賴的方式激活生長促進基因或與B細胞轉化相關的基因,導致白血病的發生[12-13]。TCF3-PBX1融合基因陽性在B淋巴母細胞淋巴瘤(B-LBL)中極為罕見,日本的一篇文獻報道記載,在14家核心醫院中的5家醫院中共檢出7例TCF3-PBX1陽性B-LBL[14],相對而言,TCF3-PBX1陽性在B系ALL中檢出率稍高。在北歐國家,TCF3-PBX1陽性兒童ALL占兒童B系淋巴細胞白血病的l.80%[15],美國白人為3.10%[16],英國的1篇研究報道為2.90%[17],普遍較亞洲國家低。日本有研究報道為7.20%[18]。國內來自北大人民醫院和河北燕達陸道培醫院的數據顯示,兒童ALL中TCF3-PBX1陽性率為5.38%[19],臺灣地區報道兒童ALL中TCF3-PBX1陽性率為5.70%[20],香港地區為4.80%[5]。本研究病例資料來自貴州多民族地區,TCF3-PBX1陽性率為4.96%,與上述漢族聚居區的數據相似。
本研究選取32例TCF3-PBX1陰性的中危組兒童B系ALL為對照組,TCF3-PBX1陽性組兒童ALL的發病年齡、性別及診斷時白細胞數均與對照組比較差異無統計學意義(P>0.05)。TCF3-PBX1陽性組初診時LDH明顯增高,與對照組比較差異有統計學意義(P<0.05),提示血清LDH明顯增高是其特征性表現之一。既往較多研究報道,TCF3-PBX1陽性兒童ALL的免疫表型多數為pre-B型[21],本研究中TCF3-PBX1陽性兒童ALL均為B系淋巴細胞表型,以pre-B型為主,但普通B細胞型并不少見,與相關報道[22]相似。
既往研究認為,TCF3-PBX1陽性兒童ALL易出現中樞神經系統復發。圣猶大兒童醫院41例TCF3-PBX1陽性的兒童ALL中有4例出現中樞神經系統復發[4]。我國臺灣地區兒童腫瘤協作組報道TCF3-PBX1陽性ALL的CNS復發高達8.70%[20]。實驗動物模型顯示,TCF3-PBX1陽性小鼠易于并發CNS白血病,可能與PBX1、MER、IL-15、ZAP70等生存途徑因子或趨化因子CXCR4、CCR7的上調有關[23]。本研究12例TCF3-PBX1重排的ALL患兒診斷時均無CNS受累(CNS-1),隨訪均未出現CNS復發,與相關報道[5]相似,可能與近年來采用更高強度的中樞神經系統白血病預防方案有關。但本研究例數較少,且隨訪時間相對較短,有待進一步增加觀察病例數、延長隨訪時間得出更為確切的結論。
微小殘留病(MRD)反映腫瘤細胞對化療的敏感性,是評估療效、判斷預后的可靠因素。將MRD水平用于危險度分層、指導個體化治療已取得顯著的成果[24]。目前,MRD檢測方法有流式細胞法、融合基因定量RT-PCR、IgH/TCR重排定量PCR、新一代測序(指導NGS)4種方法[25],本研究采用流式細胞術分別在誘導緩解第33天及鞏固治療第8天采骨髓標本檢測骨髓MRD,結果顯示TCF3-PBX1陽性組誘導緩解第33天骨髓MRD均小于10-4,而對照組仍有4例未小于10-4,鞏固治療第8天兩組MRD均全部轉陰(10-4),不同時間點組間MRD水平比較差異無統計學意義(P>0.05)。本研究12例TCF3-PBX1陽性組患者,中位隨訪時間37個月(10.0~74.5個月),1例早期骨髓復發,家屬放棄治療死亡;對照組隨訪時間與TCF3-PBX1陽性組差異無統計學意義,2例骨髓復發,均死亡,1例中樞神經系統早期復發,按BFM-2002復發方案化療獲CR2,隨后給予放療及維持化療,目前仍在隨訪中。既往報道,低強度化療下TCF3-PBX1陽性ALL預后不良[2-3]。目前多數研究均把TCF3-PBX陽性ALL歸入中危組或高危組,給予高強度的化療,增加鞘注氨甲蝶呤次數,明顯改善了患兒的預后效果[5,26-27]。在成人ALL中也得到類似的研究結果,既往成人TCF3-PBX1陽性ALL的5年OS在31%~51%,美國MD安德森癌癥中心對TCF3-PBX1陽性的成人ALL給予包含大劑量氨甲蝶呤與阿糖胞苷的高強度化療方案,加強CNSL預防,延長維持治療期,使該類患者5年OS達到82%,明顯優于其他亞型的ALL[28]。本研究兩組患兒均按CCLG-ALL08中危組方案化療,相對標危組,中危組誘導緩解化療階段增加了兩劑柔紅霉素,早期強化階段多了一輪CAM方案,鞏固化療階段氨甲蝶呤為5 g/m2,延遲強化階段增加了一輪VDLD+CAM方案化療。TCF3-PBX1陽性組ALL患兒3年EFS為(91.72±8.03)%,OS率為(91.72±8.03)%,對照組3年EFS為(90.61±5.04)%,OS率為(93.81±4.33)%,組間3年EFS或OS比較差異均無統計學意義(P>0.05)。由此可見,按CCLG-ALL08中危組方案化療,TCF3-PBX1陽性ALL患兒可獲得與TCF3-PBX1陰性B系ALL同樣的療效。
總之,按CCLG-ALL08方案加強化療,TCF3-PBX1陽性ALL患兒可取得良好的療效,且未觀察到中樞神經系統復發事件增加。但本研究存在樣本量少、隨訪時間較短等缺陷,有待進一步增加觀察病例、延長隨訪時間得出較為確切的結論。

