納米Fe3O4/H2O2體系對水中溶解性有機物礦化效果的研究*
花俊峰 孫文瑩 黃 梅,2#
(1.浙江大學化學工程與生物工程學院,浙江 杭州 310027;2.浙江大學衢州研究院,浙江 衢州 324000)
污水中的溶解性有機物,由于其小分子特性和良好親水性,具有溶解性好、存在時間長、遷移范圍廣等特點,同時也因為分子結構簡單和化學性質穩定,使得普通吸附劑對其吸附作用小,很難通過化學反應被去除。由于它們的存在會增加水體中總有機碳含量,導致水中溶解氧過量消耗而危害生態系統平衡,因此溶解性有機物的去除一直是環保領域中需要解決的重要問題[1-4]。水中溶解性有機物既可直接來源于生產過程,也能產生于各種污水處理工段,如城市污水站的二級生化出水以及工廠納管出水等[5-6]。產生原因與污水生化處理的特點和工廠污水站內各種預處理工藝過程有關,即污染物經傳統物理化學和生物處理后,通常難以完全去除。某些城市生活污水處理廠二級生化出水COD為100 mg/L左右[7];焦化廢水的二級生化出水COD約為200 mg/L[8];制藥二級生化出水COD可達700 mg/L左右[9]。以上研究表明,各類廢水經二級生化處理后仍含有較多難以降解的有機物。可選用高級氧化技術作為污水站內去除有機物的深度處理手段,雖然其強氧化能力可使難降解有機物的去除率或脫色率接近100%,但在應用中具有局限性,如反應過程中氧化劑對有機污染物的選擇性低、反應pH適用范圍窄[10-11]、降解中間體的毒性增加[12-13]以及有機物僅轉化成各種溶解性有機小分子產物而不是完全礦化等[14-15]。
礦化處理有機廢水,即將有機污染物完全轉化為礦物質,如水、二氧化碳和無機鹽等,是實現含有機污染物污水綠色環保處理的關鍵技術。而作為其中的一個重要環節,研究溶解性有機物的降解特點,提高其在非酸性條件下氧化反應的礦化率,對各類有機物在寬pH范圍內的完全去除具有指導意義。由于二級生化出水中溶解性有機物多為酸性物質[16],因此本研究選擇乙酸、丁二酸和乙二胺四乙酸(EDTA)作為目標有機物。考慮到它們是大多數有機污染物生化或高級氧化降解的中間或最終產物,而且EDTA還是各種金屬離子的強絡合劑,所以通過研究它們在納米Fe3O4/H2O2非均相高級氧化下的降解結果,可以確定溶解性有機物分子的碳鏈長短、官能團類型和物理化學特性等對礦化反應的影響,以及氧化劑H2O2在非酸性條件下的氧化活性和利用率,這對了解和掌握不同溶解性有機物在深度處理過程中的行為和規律有重要意義。
1 材料與方法
1.1 實驗材料
乙二胺四乙酸二鈉(Na2EDTA·2H2O,用于產生EDTA)、丁二酸、乙酸、FeCl3、FeSO4、氨水、HCl、NaOH、H2O2、K2Cr2O7、Na2SO3、5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)等均為分析純。
1.2 分析方法
利用X射線衍射(XRD,X’Pert PRO,波長選擇0.154 nm)分析得到樣品的晶體衍射圖譜;利用透射電鏡(TEM,JEM-2100)分析樣品的形貌;利用動態光散射(DLS,Zen-3600)測定納米復合物的Zeta電位;利用電子自旋共振波譜(ESR,ESRA-300)檢測·OH。水中的H2O2含量采用碘量法測定,COD采用重鉻酸鉀法測定。
1.3 納米Fe3O4非均相催化劑的制備
采用改進的MASSART方法[17]1247進行堿性共沉淀制備納米Fe3O4:在30 ℃水浴條件下利用氬氣鼓泡20 min,然后加入一定量的FeCl3和FeSO4,攪拌溶解,再緩慢滴加氨水,調節溶液pH為9~11,繼續反應2 h;反應結束后靜置過夜,磁力分離納米Fe3O4,清洗至近中性,真空60 ℃干燥,研磨備用。
1.4 溶解性有機物的氧化反應
分別取COD為600 mg/L的EDTA、乙酸和丁二酸溶液作為模擬水樣。在錐形瓶中分別加入100 mL水樣,用HCl和NaOH調節溶液的pH至設定值后,加入一定量納米Fe3O4;超聲10 min 后加入氧化劑H2O2,在30 ℃、250 r/min條件下振蕩反應6 h;對各樣品進行磁力分離,再將清液調至酸性,用0.5 mol/L Na2SO3還原殘留在溶液中的H2O2,然后取樣測定溶液COD。
2 結果與討論
2.1 Zeta電位
采用pH漂移法測定納米Fe3O4零點電位(pHpzc)。由圖1可知,納米Fe3O4的pHpzc約為7.4。納米Fe3O4的表面電勢會影響它與溶液中不同顆粒的相互作用:當溶液pH高于pHzpc時,納米Fe3O4表面帶負電,因而會與溶液中帶負電荷的組分發生排斥作用;當溶液pH低于pHzpc時,納米Fe3O4表面帶正電荷,溶液中帶負電荷的組分可在納米Fe3O4界面發生吸引作用。乙酸解離常數為4.76,丁二酸的一、二級解離常數為4.21、5.64,EDTA的一至六級解離常數分別為0.90、1.60、2.00、2.67、6.16、10.26,所以納米Fe3O4的pHpzc較大,可強化電離后的乙酸、丁二酸和EDTA各組分在納米Fe3O4表面的靜電吸附,有利于各溶液體系通過物理吸附對污染物進行礦化去除。

圖1 納米Fe3O4的Zeta電位Fig.1 Zeta potential of nano Fe3O4
2.2 XRD結果
圖2為納米Fe3O4的XRD圖譜。2θ=30.2°、35.5°、43.4°、53.7°、57.2°、62.8°處的特征衍射峰分別對應Fe3O4標準圖譜中(220)、(311)、(400)、(422)、(511)、(440)晶面,表明合成的是典型尖晶石結構Fe3O4。根據SCHERRER方程,選擇強峰(311)晶面計算納米Fe3O4的平均粒徑,結果為20.8 nm。因為是選用氨水做沉淀劑,所以制備出的納米Fe3O4與其他方法相比粒徑偏大。在經典的MASSART方法[17]1248中,使用氫氧化四甲銨作為沉淀劑得到的納米Fe3O4平均粒徑為12 nm。ZHANG等[18]使用NaOH作為沉淀劑,獲得的是10 nm準球形納米Fe3O4。不同粒徑的納米Fe3O4為催化劑在溶解性有機污染物的類Fenton反應中表現出多樣的催化效果提供了可能。

圖2 納米Fe3O4的XRD圖譜Fig.2 XRD pattern of nano Fe3O4
2.3 TEM結果
由圖3表明,制備出的納米Fe3O4呈片狀或近球形結構,粒徑大小約為20 nm,TEM表征結果與基于XRD的計算結果一致。同時也發現,由于在合成過程中沒有使用表面活性劑對納米顆粒進行包裹和分散,納米Fe3O4在一定范圍內有團聚現象發生。

圖3 納米Fe3O4的TEM圖譜Fig.3 TEM images of nano Fe3O4
2.4 ·OH的檢測
在pH=7條件下,以DMPO為捕捉劑,采用ESR技術分別對Fenton體系和納米Fe3O4/H2O2類Fenton體系的自由基信號進行分析,結果見圖4。在Fenton體系中出現了歸因于DMPO-OH加合物[19-20]的4個·OH特征峰,強度比為1∶2∶2∶1。而在納米Fe3O4/H2O2體系中,也出現了同Fenton體系中峰形和峰位置基本吻合的DMPO-OH加合物的特征峰,雖然4個特征峰的強度相對減弱,但依舊保持了1∶2∶2∶1的強度比,因此可以確定納米Fe3O4/H2O2體系中有·OH的產生,因而具備了進行強氧化反應的能力。

圖4 DMPO自旋捕獲·OH的ESR圖譜Fig.4 ESR spectra of ·OH by DMPO spin-trapping
2.5 pH的影響
圖5展示了納米Fe3O4投加量為10 mmol/L、H2O2投加量為40 mmol/L時,不同pH條件下納米Fe3O4/H2O2體系對乙酸、丁二酸和EDTA的高級氧化結果。當pH=3時,納米Fe3O4/H2O2體系對溶解性有機物乙酸、丁二酸和EDTA的去除效果相似,其COD去除率為11%~14%,表明在強酸條件下納米Fe3O4/H2O2體系對這些溶解性有機物有相似的弱礦化能力。然而隨著溶液pH增加,納米Fe3O4/H2O2體系對EDTA表現出強氧化作用,并在pH為5~9時取得良好的礦化效果,在pH為5~7時得到最大COD去除率(42%)。可以發現,丁二酸在pH=5時COD去除率為17%,繼續增大溶液pH則COD去除率下降;乙二酸的COD去除率均小于15%,且隨著溶液pH增加,COD去除率連續下降,當pH=9時只有3%的COD去除率。由此可知,納米Fe3O4/H2O2體系在近中性條件下對溶解性有機物進行高級氧化反應時,礦化結果與溶解性有機物的種類密切相關。
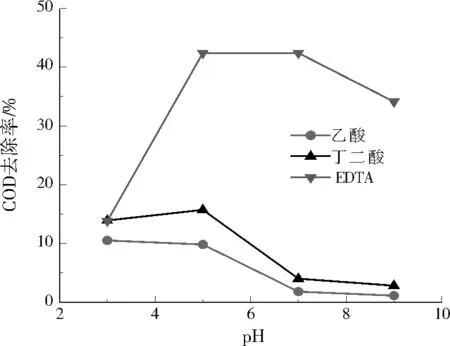
圖5 不同pH下納米Fe3O4/H2O2體系對乙酸、丁二酸和EDTA的COD去除效果Fig.5 COD removal of acetic acid,succinic acid and EDTA at different pH in nano Fe3O4/H2O2 systems
2.6 高級氧化與單獨吸附對比
圖6展示了在pH=5、H2O2投加量為40 mmol/L時,改變納米Fe3O4投加量,乙酸、丁二酸和EDTA分別經納米Fe3O4單獨吸附和納米Fe3O4/H2O2高級氧化后的礦化結果。可以看出,乙酸、丁二酸和EDTA僅通過納米Fe3O4的吸附作用被去除時,處理效果各不相同,其中納米Fe3O4吸附丁二酸的能力最強。隨著納米Fe3O4投加量由10 mmol/L增大到80 mmol/L,丁二酸的COD去除率由3%增大到29%;乙酸的COD去除率僅略有增加,由1%增大到9%;EDTA的COD去除率均小于7%。但在納米Fe3O4/H2O2體系中,3種溶解性有機物的礦化結果卻發生顯著改變。EDTA經納米Fe3O4/H2O2高級氧化后其COD去除率最高,可達45%。丁二酸和乙酸的COD去除率盡管也隨著納米Fe3O4投加量的增大而總體增大,但與納米Fe3O4/H2O2高級氧化EDTA的結果不同,它們經高級氧化后的COD去除率同納米Fe3O4單獨吸附時的COD去除率越來越接近,表明在納米Fe3O4/H2O2礦化去除丁二酸和乙酸過程中,與類Fenton體系的氧化去除效果相比,納米Fe3O4吸附作用的貢獻可能更大。

注:丁二酸(氧化)和丁二酸(吸附)分別表示丁二酸經納米Fe3O4/H2O2高級氧化和納米Fe3O4單獨吸附后的礦化結果,其余以此類推。
2.7 氧化劑與催化劑摩爾比的影響
挑選在納米Fe3O4/H2O2體系中高級氧化效果較好的丁二酸和EDTA,保持氧化劑的投加量40 mmol/L,在pH=7條件下研究納米Fe3O4/H2O2體系中氧化劑與催化劑摩爾比對礦化效果的影響,結果見圖7。可以看出,當氧化劑和催化劑摩爾比為1∶1~4∶1時,納米Fe3O4/H2O2體系對丁二酸和EDTA的礦化效果各不相同,即EDTA的COD去除率變化不明顯,在40%左右;丁二酸的COD去除率則由4%變為11%。同時,由于氧化劑和催化劑摩爾比間接體現了高級氧化反應中催化劑對氧化劑的催化活性,比值越大,單個催化劑分子可活化的氧化劑數量越多,為了使納米Fe3O4/H2O2體系能對EDTA保持穩定和高效的反應活性,研究中優選的氧化劑與催化劑摩爾比為4∶1。

圖7 氧化劑與催化劑摩爾比對丁二酸和EDTA的COD去除率的影響Fig.7 Effect of molar ratio of oxidant and catalyst on COD removal of succinic acid and EDTA
2.8 氧化劑投加量的影響
考慮到納米Fe3O4/H2O2去除EDTA效果最明顯,故只選用EDTA進行考察。圖8展示了pH=7、保持氧化劑與催化劑摩爾比為4∶1時,H2O2投加量對EDTA礦化效果的影響。可以看到,隨著H2O2投加量增大,COD去除率也變大。但當反應體系中H2O2投加量超過40 mmol/L后,由于過量的H2O2會消耗體系中已經生成的·OH,因此EDTA的礦化效果沒有隨著H2O2投加量的持續增加而明顯增大,而是趨于達到平衡,所以本研究中的H2O2最佳投加量取40 mmol/L。

圖8 H2O2投加量對EDTA的COD去除率的影響Fig.8 Effect of H2O2 dosage on the COD removal of EDTA
3 結 論
納米Fe3O4/H2O2對溶解性有機物EDTA進行高級氧化處理時,H2O2最佳投加量宜取40 mmol/L,且保持H2O2、納米Fe3O4摩爾比為4∶1;納米Fe3O4/H2O2體系在pH為5~9時能取得良好礦化效果,且在pH為5~7時可取得42%的COD去除率。對于COD為600 mg/L的丁二酸溶液,pH=5時COD去除率為17%,繼續增大溶液pH則COD去除率下降;H2O2投加量為40 mmol/L、pH=5時,隨著納米Fe3O4投加量由10 mmol/L增大到80 mmol/L,丁二酸的COD去除率明顯增加。對于COD為600 mg/L的乙酸溶液,無論納米Fe3O4/H2O2體系的高級氧化作用還是納米Fe3O4的單獨吸附作用,對COD的去除效果均較差。

