不同控制水平哮喘患兒血清25(OH)D3、CC16水平和FeNO的變化及臨床意義*
李遠哲,郭燕軍,胡文潔,施陽,侯杰,林新春,宋曉琴,丁顯飛
[1.鄭州大學附屬兒童醫院(河南省兒童醫院),河南 鄭州450018;2.鄭州大學第一附屬醫院,河南 鄭州450052]
哮喘是兒童時期常見的慢性氣道疾病之一,我國兒童的哮喘患病率近年來呈上升趨勢,嚴重影響兒童的身心健康。提高哮喘的完全控制率,可提高哮喘患兒生存質量、減輕其家庭及社會負擔[1-2]。研究表明維生素D具有抑制氣道重塑、減輕氣道炎癥反應、調節免疫細胞等獨特作用,其在哮喘的發生、發展中起重要作用[3];Clara細胞分泌蛋白16(Clara cell secretory protein 16,CC16)是由位于細支氣管及終末細支氣管的Clara細胞所產生的一類具有抑制炎癥反應、抗氧化、抗纖維化、免疫調節等生物活性的物質,與兒童哮喘的發生、發展密切相關[4]。哮喘控制不理想時,體內多種重要細胞因子如白細胞介素-4(Interleukin-4, IL-4)、血管內皮生長因子(vascular endothelial growth factor,VEGF)水平會發生變化,并對疾病的嚴重程度及轉歸有一定指示意義[5-6]。呼出氣一氧化氮(fraction exhaled nitric oxide,FeNO)因無創、安全有效,在哮喘的診治中越來越受到重視。本研究旨在探討不同控制水平的哮喘患兒血清25-羥維生素D3[25(OH)D3]、CC16、IL-4、VEGF水平和FeNO的變化及其之間的關聯,以期為提高及動態評估哮喘兒童的控制水平提供新的方法。
1 資料與方法
1.1 一般資料
選取2016年10月—2018年6月鄭州大學附屬兒童醫院診治的哮喘患兒106 例作為研究對象。哮喘的診斷及控制水平分級參考《兒童支氣管哮喘診斷與防治指南(2016年版)》[7]。選取同期該院健康體檢兒童為對照組。納入標準:①6~16 歲,可配合完成FeNO 檢測,檢測前未食用富含氮的食物(如動物內臟、菠菜等);②6 個月內無維生素D 攝入者;③4 周內無呼吸道感染病史;④2 周內無全身使用糖皮質激素者;⑤無自身免疫缺陷性疾病、先天性心臟病、無明確過敏性疾病等基礎疾病。本研究獲醫院醫學倫理委員會批準及家屬知情同意。106 例哮喘患兒分為良好控制組59 例,男性31 例,女性28 例,年齡(11.3±5.1)歲;部分控制組26 例,男性11例,女性15例,年齡(9.1±4.6)歲;未控制組21例,男性12例,女性9例,年齡(7.4±3.5)歲。對照組50例,男性27例,女性23例,年齡(7.7±4.1)歲。各組年齡、性別比較,差異無統計學意義(P>0.05),具有可比性。
1.2 血清25(OH)D3、CC16、IL-4及VEGF水平檢測
采用酶聯免疫吸附試驗(ELISA)檢測血清25(OH)D3、CC16、IL-4 及VEGF 水平。哮喘患兒及健康體檢兒童空腹抽取靜脈血2 ml,室溫靜置10~20 min 后,2 000 r/min 離心10 min,離心半徑為13.5 cm,存放于-80℃冰箱冷凍待測。25(OH)D3、IL-4、CC16、VEGF 的ELISA 檢測試劑盒均購自美國Ray Biotech 公司,具體步驟嚴格按照試劑盒說明書操作。
1.3 FeNO檢測
FeNO 檢測儀采用瑞典Aerocrine 公司的NIOX 分析儀,哮喘患兒和健康體檢兒童的FeNO 值參照美國胸科學會/歐洲呼吸學會推薦標準[8]。
1.4 統計學方法
數據分析采用SPSS 21.0 和GraphPad Prism 7 統計軟件,計量資料以均數±標準差(-±s)表示,比較采用方差分析或H檢驗,方差分析兩兩比較采用SNK-q檢驗,相關分析用Pearson 法,繪制ROC 曲線,P<0.05 為差異有統計學意義。
2 結果
2.1 各組血清25(OH)D3、CC16、IL-4、VEGF水平及FeNO 比較
各組血清25(OH)D3、CC16、IL-4、VEGF 水平及FeNO值的比較,經方差分析,差異有統計學意義(P<0.05);未控制組、部分控制組及良好控制組患兒血清中25(OH)D3、CC16 水平低于對照組(P<0.05),未控制組低于部分控制組及良好控制組(P<0.05),部分控制組低于良好控制組(P<0.05);未控制組、部分控制組及良好控制組患兒血清中IL-4、VEGF 水平高于對照組(P<0.05),未控制組高于部分控制組及良好控制組(P<0.05),部分控制組高于良好控制組(P<0.05);未控制組、部分控制組及良好控制組患兒FeNO值高于對照組(P<0.05),未控制組高于良好控制組及部分控制組(P<0.05),部分控制組高于良好控制組(P<0.05)。見表1。
表1 各組血清25(OH)D3、CC16、IL-4、VEGF水平及FeNO值比較 (±s)
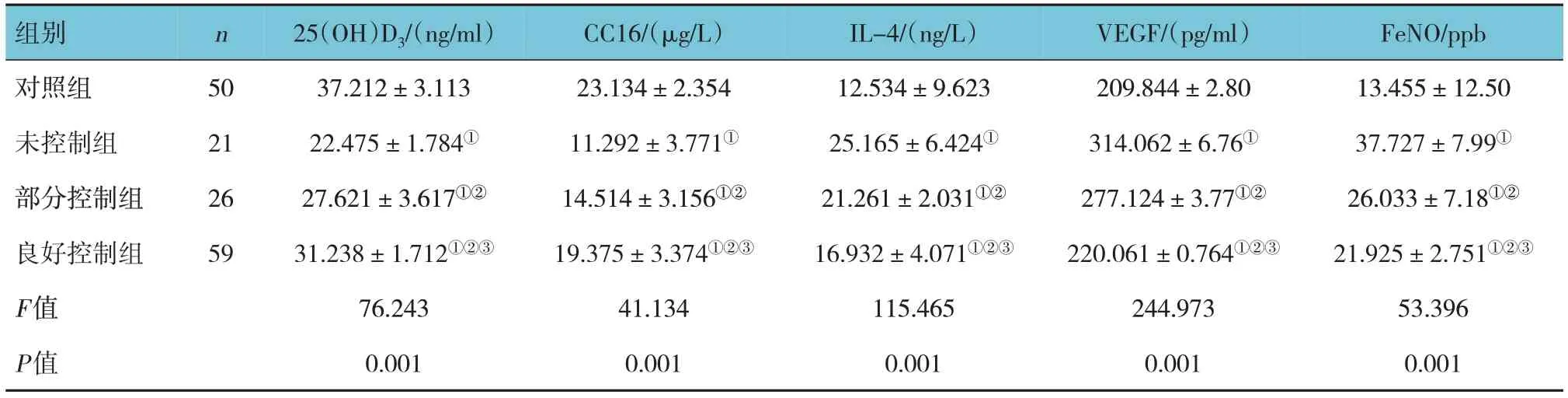
表1 各組血清25(OH)D3、CC16、IL-4、VEGF水平及FeNO值比較 (±s)
注:①與對照組比較,P <0.05;②與未控制組比較,P <0.05;③與部分控制組比較,P <0.05。1 ppb=10-9。
組別n FeNO/ppb 25(OH)D3/(ng/ml)CC16/(μg/L)IL-4/(ng/L)VEGF/(pg/ml)對照組未控制組部分控制組良好控制組F值P值50 21 26 59 13.455±12.50 37.727±7.99①26.033±7.18①②21.925±2.751①②③53.396 0.001 37.212±3.113 22.475±1.784①27.621±3.617①②31.238±1.712①②③76.243 0.001 23.134±2.354 11.292±3.771①14.514±3.156①②19.375±3.374①②③41.134 0.001 12.534±9.623 25.165±6.424①21.261±2.031①②16.932±4.071①②③115.465 0.001 209.844±2.80 314.062±6.76①277.124±3.77①②220.061±0.764①②③244.973 0.001
2.2 血清25(OH)D3與CC16、IL-4、VEGF及FeNO的相關性
哮喘患兒血清25(OH)D3與CC16 呈正相關(P<0.05);與CC16、IL-4、VEGF 及FeNO 呈負相關(P<0.05)。見表2和圖1、2。
2.3 血清25(OH)D3、CC16、IL-4、VEGF及FeNO對哮喘未控制的診斷價值
血清25(OH)D3、CC16、IL-4、VEGF 及FeNO5 種因子診斷哮喘未控制的ROC 曲線下面積分別為0.902、0.764、0.671、0.685 和0.859(P<0.05);最佳診斷截點分別為18.523 ng/ml、10.741 μg/L、27.392 ng/L、314.273 pg/ml 和38.273 ppb;診斷敏感性分別為89.2%、82.7%、91.3%、69.6%和78.6%;特異性分別為83.6%、76.4%、49.1%、64.9% 和58.2%。見表3和圖3。
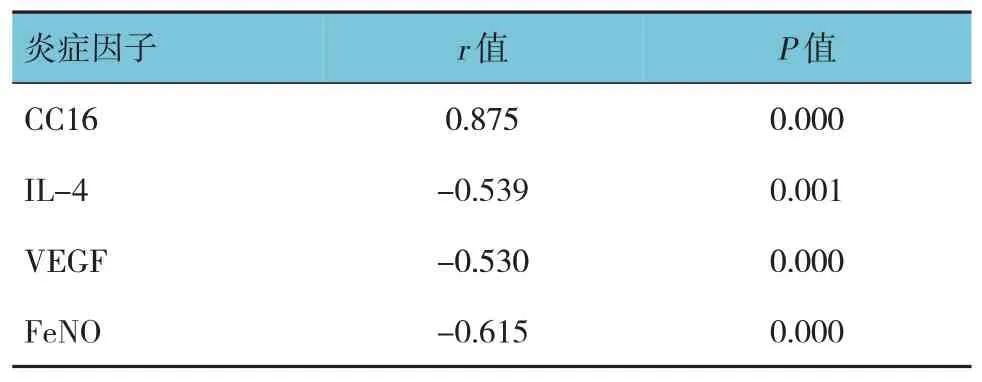
表2 血清25(OH)D3與CC16、IL-4、VEGF及FeNO的相關性
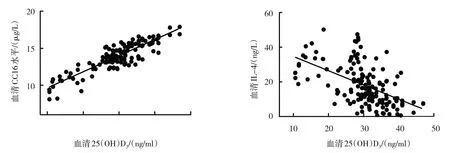
圖1 血清25(OH)D3與CC16和IL-4的相關性
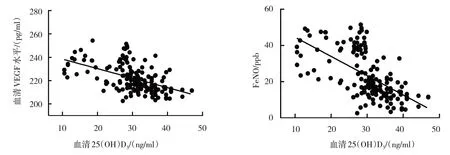
圖2 血清25(OH)D3與VEGF和FeNO的相關性
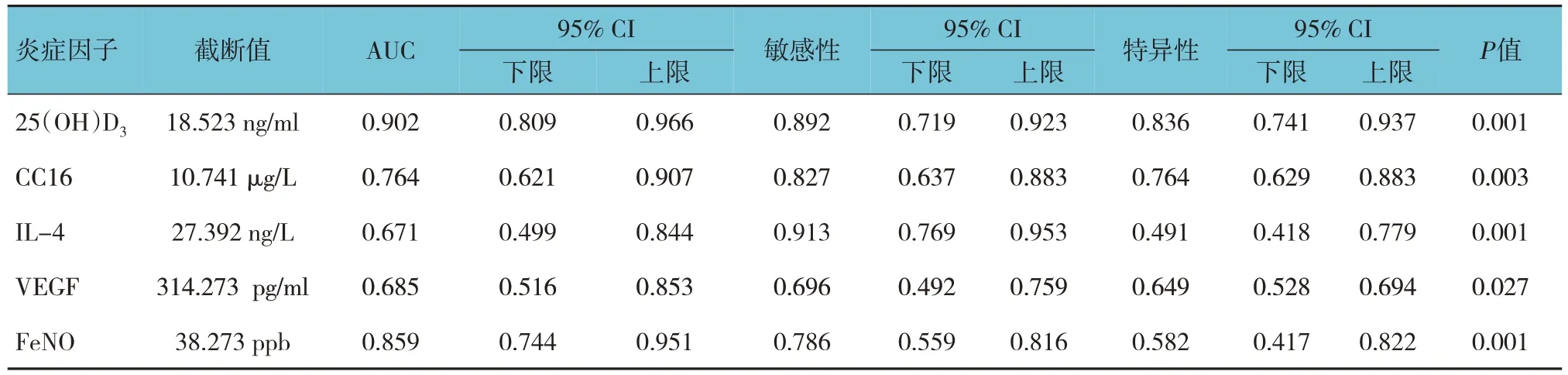
表3 血清25(OH)D3、CC16、IL-4、VEGF及FeNO對哮喘未控制的診斷價值
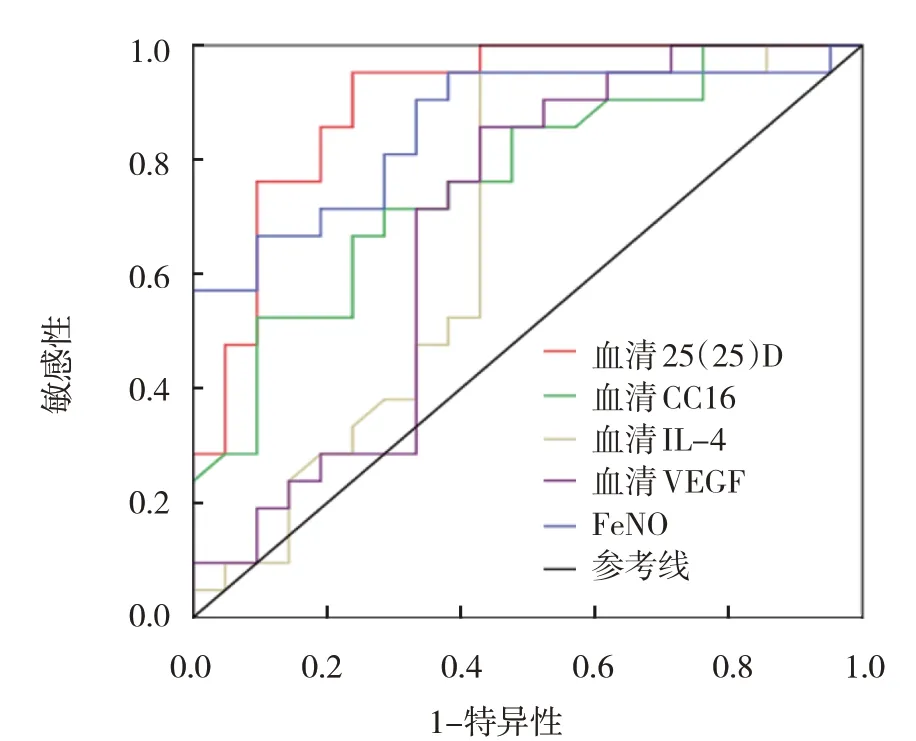
圖3 25(OH)D3、CC16、IL-4、VEGF及FeNO對哮喘未控制診斷效能的ROC曲線
3 討論
哮喘的管理模式及治療手段在不斷改進,但其控制率未見明顯提高,其規范化管理及治療目標之一是獲得良好的癥狀控制。哮喘長期治療方案的制訂及調整以其控制水平為依據,可使多數哮喘患兒得到更有效的治療,達到臨床控制的目的[7-9]。
維生素D 是哮喘發生、發展中有重要調控作用的脂溶性維生素,有抑制炎癥反應、調節免疫等生物活性作用。目前認為,25(OH)D3是人體血清維生素D的表達形式,檢測血清25(OH)D3可評估人體維生素D 水平[10]。在對哮喘患兒的研究中發現,相較于患兒的哮喘家族史及血清IgE水平,維生素D的缺乏對評估患兒哮喘控制水平更具臨床指導意義,是哮喘較強的預測指標之一,缺乏維生素D 的兒童其哮喘發生風險是維生素D水平正常兒童的6.3倍[11-12]。哮喘兒童維生素D 水平低的原因可能是哮喘患兒外出活動較少,接受日照的強度及時間低于正常兒童,此外,部分患兒存在對富含維生素D 的食物過敏如海產品、堅果類、牛奶、雞蛋等。本研究納入哮喘患兒106 例,未控制組為21 例,部分控制組為26例,未完全控制患兒共47 例,占44.34%,未完全控制率較高,對哮喘的控制情況不容樂觀,提高哮喘完全控制率的任務依舊艱巨。本研究發現,哮喘患兒血清25(OH)D3水平低于健康體檢兒童,哮喘患兒中,未控制組低于良好控制組及部分控制組,隨著血清25(OH)D3水平的升高,哮喘的控制率也隨之升高,這提示血清25(OH)D3水平與哮喘病情的控制有相關性。其機制可能是維生素D 能影響哮喘發病的相關重要信號通路,如Toll 樣受體(TLRs)通路、VDR 信號通路、酪氨酸蛋白激酶轉錄激活因子信號轉導通路(JAK-STAT),可調節患兒Th1/Th2 細胞平衡,并促進細胞分化及增強免疫調節反應,阻止呼吸道平滑肌細胞的遷移,進而減輕氣道炎癥反應,抑制呼吸道重塑及高反應性。動態檢測哮喘患兒血清維生素D 水平,對于維生素D 缺乏的哮喘患兒,及時補充維生素D 可作為哮喘輔助治療方法之一[13]。哮喘患兒血清25(OH)D3水平較對照組兒童降低,其與哮喘控制水平有關,與CC16 呈正相關,與IL-4、VEGF 及FeNO 呈負相關。有研究顯示維生素D可降低IL-4 的表達,減輕氣道炎癥反應,與本研究結果一致[14]。本研究結果顯示,血清25(OH)D3對哮喘未控制的診斷敏感性及特異性均較高,診斷哮喘未控制的臨界值為18.523 ng/ml,且ROC 曲線下面積最大,表明血清25(OH)D3對哮喘患兒尤其是未控制的患兒診斷效能優于CC16、IL-4、VEGF 及FeNO,提示監測血清25(OH)D3水平對于預測哮喘控制水平、評價診療效果、調整治療方案等具有一定的臨床指導意義。
Clara 細胞是分布于呼吸道終末細支氣管黏膜上的非纖毛細胞,其分泌蛋白CC16 具有減輕氣道炎癥反應、免疫調節等多種生物學活性。其可通過單核衍生樹突細胞抑制原始T細胞向Th2分化,減輕哮喘炎癥反應[15]。目前證實,在基因水平CC16 與兒童哮喘存在一定的關聯[16],有研究顯示[17],CC16 基因型為GA 和AA 的患兒更易發生中度及重度哮喘,且對常規治療方案反應更差。本研究發現,哮喘患兒血清CC16 水平低于對照組兒童,哮喘患兒中,未控制組低于良好控制組及部分控制組,提示血清CC16 水平與哮喘病情控制相關,CC16 ROC 曲線下面積為0.764,敏感性及特異性均較高,提示檢測CC16 對評估哮喘控制水平有一定的價值。有學者認為外源補充CC16 后,可減輕哮喘癥狀、減少哮喘發生次數,這或許為治療兒童哮喘的新藥物帶來啟示[4]。
IL-4 作為Th2 的一項功能指標,可間接反映Th1/Th2 的變化,其還是IgE 的特異性誘導劑,可促進嗜酸性粒細胞的聚集,導致氣道炎癥及氣道高反應性[18]。VEGF 是新生血管最重要的調控因子之一,參與氣道慢性炎癥反應及氣道重塑[19]。本研究中,哮喘患兒血清IL-4、VEGF 水平高于對照組兒童,哮喘患兒中,未控制組高于良好控制組及部分控制組,提示血清IL-4、VEGF 水平與哮喘病情控制相關,證明其在哮喘的發生、發展中具有重要指示作用,其濃度的高低也可反映哮喘的控制程度。
FeNO 檢測是一種簡單有效的評估氣道炎癥疾病的無創性檢查方法,FeNO 的升高與氣道高反應性及炎癥密切相關,可作為評估哮喘患兒氣道炎癥控制水平的可靠指標[20]。有研究顯示,將FeNO 作為哮喘管理的一部分能減少吸入激素量并減少急性發作次數,病情能得到更好的控制[21]。本研究顯示,哮喘患兒FeNO高于對照組兒童,哮喘患兒中,未控制組高于良好控制組及部分控制組,且FeNO對未控制哮喘患兒的敏感性較高,提示其對哮喘患兒尤其是哮喘控制不理想時具有較高的診斷意義。行動態FeNO監測,可對哮喘患兒進行更準確的病情評估,更及時地調整治療方案。
綜上所述,哮喘患兒血清25(OH)D3、CC16 水平低于健康體檢兒童,FeNO 高于健康體檢兒童,且都與哮喘控制水平相關。25(OH)D3及CC16 可作為評估哮喘患兒控制水平的較理想的生物學標志物,而外源補充維生素D 及CC16 或許能成為治療兒童哮喘的輔助方式之一。這還需要多中心、大樣本的研究進一步證實。

