糖碳源和氨基酸氮源對蒼白桿菌屬發酵產生物表面活性劑的影響
陳西朋,司偉民,孫玉梅*,李憲臻
(大連工業大學生物工程學院,遼寧 大連 116034)
生物表面活性劑具有促進非水溶性液體與水混合乳化和降低液體表面張力的能力,又把有乳化能力的稱為生物乳化劑,把降低表面張力的稱為生物表面活性劑。目前微生物發酵法生產生物表面活性劑的瓶頸是產量低和成本高,解決途徑有分離高產微生物、優化培養基成分和利用低成本原料等[1]。
產生物表面活性劑的微生物包括細菌、真菌和酵母。其中對假單胞菌(Pseudomonasspp.)、不動桿菌(Acinetobacterspp.)、芽孢桿菌(Bacillussp.)、假絲酵母(Candida lipolytica)、鏈霉菌(Streptomycesspp.)、紅球菌(Rhodococcusspp.)、無色桿菌(Achromobacterspp.)、短桿菌(Brevibacteriumspp.)、節桿菌(Arthobacterspp.)等微生物生產生物表面活性劑研究較多[2-10],但對蒼白桿菌(Ochrobactrum)產生物表面活性劑的研究相對較少。1990年最早分離出的人蒼白桿菌(O.anthropi)利用0.3%酵母浸粉和1%葡萄糖產出對熱穩定的生物乳化劑,產物含蛋白組分,對各種烴水混合物有強乳化活性[1]。有的菌株產降低表面張力的脂肽[7]。菌株O.intermediumCN3所產糖脂生物表面活性劑耐熱、高鹽度和pH值,對己烷和廢機油的乳化活性高達65%以上,可有效促進石油污泥中烴降解[11]。嗜鹽菌株Ochrobactrumsp.BS-206利用丙酮酸鈉和硝酸鈉發酵生成的生物表面活性劑Ochrosin不僅能降低表面張力和乳化多種烷烴,還具有抗菌、抗粘、拒食和殺蟲活性[12]。菌株O.intermedium將廢棄烴轉化為具有高乳化活性的聚羥基丁酸酯(poly hydroxybutyrate,PHB)[13]。菌株O.intermedium的游離細胞和海藻酸鈣固定化細胞利用2%十六烷(V/V)和1 g/L NH4NO3,發酵48 h能降低表面張力至33 mN/m,發酵72 h乳化活性達到68%~93%[14]。菌株O.intermediumMZV101能同時生產適于洗滌的耐高溫(70~90 ℃)和堿性(pH9~13)的脂肪酶和生物表面活性劑,產物對重金屬離子、去污劑和有機溶劑穩定,且抑制多種微生物[15]。水牛瘤胃源菌株O.pseudintermediumC1可以利用廢機油生產胞外多糖生物乳化劑[16]。菌株O.anthropiAD2以酵母浸粉和蛋白糖肽為氮源,利用葡萄糖補加辛烷、輕油、重油和原油能產胞外多糖乳化劑,乳化活性范圍寬,且化學組成和乳化活性依培養條件而異,但無表面活性劑活性[17]。菌株O.anthropiRIPI5-1[18]以原油為碳源生產生物表面活性劑。菌株O.anthropi2/3以棕櫚油廢渣和味精廢水為碳源和氮源時,最適碳氮比(C/N)為25,而C/N在30~50會抑制糖脂表面活性劑產生[19]。
本實驗室在之前的研究中篩選到生物乳化劑生產菌株,發現蔗糖比葡萄糖、硝酸鈉比硫酸銨均更能促進該菌產生物乳化劑[20-21]。本研究通過對細胞生長、發酵液表面張力和乳化活性的分析,進一步探討糖碳源、氨基酸氮源以及碳氮比對其生產生物表面活性劑發酵的影響。
1 材料與方法
1.1 材料與試劑
1.1.1 實驗菌株
蒼白桿菌(Ochrobactrumsp.)XY-1:本實驗室自行分離、篩選、鑒定、保藏。
1.1.2 培養基
種子培養基:牛肉膏5 g/L,蛋白胨10 g/L,氯化鈉5 g/L。115 ℃滅菌30 min。
斜面種子培養基:在種子培養基中加入20 g/L瓊脂。115 ℃滅菌30 min。
發酵基礎培養基:KH2PO43.4 g/L,KH2PO41.5 g/L,MgSO4·7H2O 0.2 g/L,酵母浸粉0.2 g/L。培養基均調pH至7.0,于115 ℃滅菌30 min。
1.1.3 化學試劑
木糖、果糖、蔗糖、乳糖和甘油:天津市科密歐化學試劑有限公司;谷氨酸、天冬氨酸、賴氨酸、精氨酸、纈氨酸:國藥集團化學試劑有限公司;實驗所用試劑均為分析純試劑或生化試劑。
1.2 儀器與設備
PHS-3C型精密pH計、722S型分光光度計:上海精密科學儀器有限公司;JZY-180界面張力儀:河北省承德市材料試驗機廠;Avanti J-E離心機:美國貝克曼庫爾特有限公司;SHP-150生化培養箱:上海森信實驗儀器有限公司。
1.3 方法
1.3.1 種子液制備
取斜面保存的Ochrobactrumsp. 菌種一環接種于斜面種子培養基上,在30 ℃活化培養48 h后,將2環活化菌體接種于100 mL種子培養基中,30 ℃、160 r/min搖床培養48 h,得種子液。
1.3.2 發酵
以8%(V/V)接種量將種子液接于發酵培養基中,30℃、160r/min搖床培養7d,按時取樣測量。發酵液在4℃、13300×g離心20 min獲得上清液,用于相關測定。
1.3.3 糖碳源、氨基酸氮源及碳氮比對菌株產生物表面活性劑發酵的影響
在發酵基礎培養基中,添加4 g/L硝酸鈉為氮源,分別以10 g/L的木糖、果糖、蔗糖、乳糖和甘油為碳源,研究糖碳源對菌株發酵產生物表面活性劑的影響。以10 g/L蔗糖為碳源,分別以7.35 g/L谷氨酸、6.65 g/L天冬氨酸、3.65 g/L賴氨酸、2.18 g/L精氨酸、5.85 g/L纈氨酸為氮源,研究氨基酸氮源對菌株發酵產生物表面活性劑的影響。以4 g/L硝酸鈉為氮源,分別以質量濃度1.57 g/L、15.66 g/L、31.32 g/L、46.98 g/L和62.64 g/L的蔗糖為碳源,使碳氮比(C/N)分別為1、10、20、30和40,研究碳氮比對菌株發酵產生物表面活性劑的影響。
1.3.4 測定方法
菌體密度:采用比濁法測定[22],以發酵上清液為空白,以波長600 nm測定的發酵液光密度值OD600nm表示。
發酵液pH:使用pH計于室溫條件下(25 ℃)測定。
發酵液表面張力:采用吊環法于室溫條件下(25 ℃)測定[23]。
發酵液乳化活性:取1.5 mL發酵上清液,與0.9 g液體石蠟于10 mL具塞刻度管中手動搖勻150次,靜置24 h,乳化層高度占液體總高度百分比即為發酵液乳化活性。
發酵液總糖含量:采用苯酚-硫酸法測定[24]。
發酵液還原糖含量:采用3,5-二硝基水楊酸法測定[25]。
1.3.5 數據處理
所有發酵和測定分別重復3次,結果為平均值±標準差。由軟件Microsoft Excel 2019進行方差分析和獨立樣本T檢驗。當P值≤0.05時,有顯著性差異;P值>0.05時,無顯著差異。采用Origin 9.0軟件繪圖。
2 結果與分析
2.1 不同糖碳源對菌株發酵產生物表面活性劑的影響
由圖1A可知,以不同糖碳源發酵時,發酵過程中發酵液的總糖或甘油濃度均呈下降的趨勢,下降速度依甘油、蔗糖、乳糖、果糖、木糖的順序減小,而總糖殘留量依蔗糖、乳糖、木糖、果糖、甘油的順序減小。由圖1B可知,細胞生長速度依甘油、蔗糖、乳糖、果糖、木糖的順序減小,最大細胞生長量依蔗糖、甘油、木糖、果糖、乳糖的順序減小,而最大生長耗時依蔗糖、甘油、木糖、果糖、乳糖的順序增大。菌體生長速度與碳源消耗速度相一致,但碳源消耗量與菌體最大生長量卻不一致。由圖1C可知,在發酵過程中,不同糖碳源的發酵液乳化活性升高程度依蔗糖、乳糖、木糖、果糖、甘油的順序減少(依次為56.3%、50%、48%、48%、40%),蔗糖為碳源發酵的乳化活性(56.3%)顯著高于其他碳源(P<0.05);乳化活性升至最高所需發酵時間依蔗糖、乳糖、木糖、甘油、果糖的順序延長。由圖1D可知,不同糖碳源發酵液的表面張力下降后均有回升,表面張力下降程度依木糖、乳糖、甘油、蔗糖、果糖的順序減少(依次為51.13 mN/m、54.20 mN/m、55.18 mN/m、57.93 mN/m、58.18 mN/m),差異顯著,表面張力下降至最低所需發酵時間依蔗糖、乳糖、甘油、木糖、果糖的順序延長。

圖1 不同糖碳源發酵產生物表面活性劑時總糖或甘油(A)、細胞生長量(B)、乳化活性(C)、表面張力(D)變化Fig. 1 Changes of total sugar or glycerol (A), cell growth amount (B), emusifying activity (C), surface tension (D) when biosurfactant was produced by fermentation with different saccharides carbon sources
結果表明,實驗菌株可以利用上述碳源生長和代謝,不同碳源發酵液表面張力下降幅度均較小(小于20 mN/m),所以,實驗菌株發酵所產表面活性劑降低液體表面張力的活性較低或生成量較少,但能生成較大量或者活性較高的生物乳化劑。蔗糖碳源被直接用于菌體生長和代謝,有利于菌體較快較大量生長且高產生物乳化劑;雖然乳糖碳源的同化作用最差,但有利于合成生物乳化劑和生物表面活性劑。甘油主要被較高效地用于菌體生長和生物表面活性劑合成。利用木糖和果糖生長和生產的水平都較低。木糖和果糖碳源發酵3 d后發酵液乳化活性才升高,可能與期間菌體生長較少有關。甘油碳源發酵的前2天菌體生長較快,但發酵液乳化活性卻低于蔗糖和乳糖碳源的發酵液。說明菌體生長過快和太少均不利于實驗菌株發酵生產生物表面活性劑。綜上分析,糖碳源以蔗糖為碳源發酵較為適宜。
2.2 不同氨基酸氮源對菌株發酵產生物表面活性劑的影響
由圖2A、圖2B可知,以不同氨基酸氮源發酵時,發酵過程中細胞生長速度和耗糖速度依天冬氨酸、谷氨酸、精氨酸、賴氨酸、纈氨酸的順序減小,細胞最大生長量依谷氨酸、天冬氨酸、精氨酸、賴氨酸、纈氨酸的順序減小,細胞最大生長量所需時間依谷氨酸、天冬氨酸、精氨酸、賴氨酸、纈氨酸的順序延長,而耗糖量依天冬氨酸、精氨酸、谷氨酸、賴氨酸、纈氨酸的順序減少。不同氨基酸氮源均在發酵的前2天菌體快速生長,隨后減慢,只有谷氨酸氮源發酵仍快速生長,并于發酵3 d達最大生長量。由圖2C可知,不同氨基酸氮源的發酵液乳化活性升高速度依天冬氨酸、精氨酸、谷氨酸、賴氨酸、纈氨酸的順序減少;乳化活性升高幅度依天冬氨酸、谷氨酸、精氨酸、賴氨酸、纈氨酸的順序減少(依次為54%、49%、24.5%、12%、12%),差異顯著;乳化活性升高至最大所需時間依天冬氨酸、精氨酸、賴氨酸、谷氨酸、纈氨酸的順序減少。以天冬氨酸為氮源發酵4 d的發酵液乳化活性最大(54%),隨后下降,可能是由于發酵液中糖含量過低,致使所產生物表面活性劑被菌體利用。由圖2D可知,不同氨基酸氮源的發酵液初始表面張力就有差異,依谷氨酸、天冬氨酸、纈氨酸、賴氨酸、精氨酸的順序減少,在不同發酵時間的順序有別,下降幅度較小,且彼此差異不顯著。相比硝酸鈉氮源(見2.1),使用天冬氨酸氮源時,菌體生長更快更多,提前1天達到略低的最大乳化活性,而其他氨基酸氮源的發酵液乳化活性明顯低。
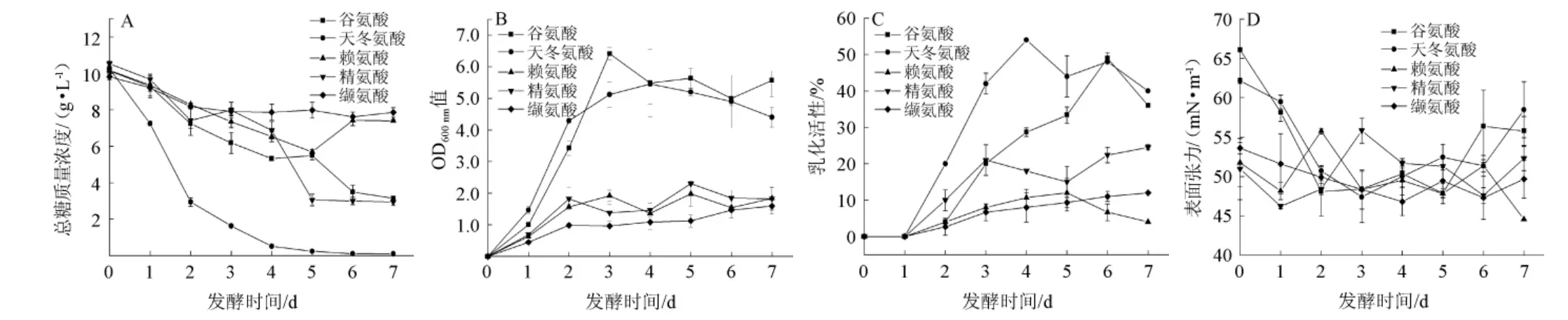
圖2 不同氨基酸氮源發酵產生物表面活性劑時總糖或甘油(A)、細胞生長量(B)、乳化活性(C)、表面張力(D)變化Fig. 2 Changes of total sugar or glycerol (A), cell growth amount (B), emusifying activity (C), surface tension (D)when biosurfactant was produced by fermentation with different amino acids nitrogen sources
結果表明,天冬氨酸氮源發酵的菌體生長和生物乳化劑生成較快較多,使發酵耗糖最快最多,與谷氨酸氮源發酵相比較,其最大細胞生長量較小,發酵液乳化活性卻較早升至最高,可見,適當限制菌體生長有助于代謝合成生物乳化劑。天冬氨酸氮源發酵2 d后的菌體生長減慢,可能是大量合成生物乳化劑以及糖含量降低之故。谷氨酸氮源不僅促進細胞生長,還因有助于前體物質合成而促進生物乳化劑合成,提高細胞對氮源的利用率[26],又因較大程度促進生長而使發酵液乳化活性低于天冬氨酸氮源發酵液。賴氨酸、精氨酸和纈氨酸氮源的菌體生長量較低,不利于產生物乳化劑。可能與相同氮素含量下天冬氨酸和谷氨酸分子含有較多的碳素有關,還需進一步考察。綜上分析,天冬氨酸比其他氨基酸更適于作為生物乳化劑發酵的氮源,而接近硝酸鈉氮源的發酵效果。
2.3 不同碳氮比對菌株發酵產生物表面活性劑的影響
由圖3A可知,以不同碳氮比發酵時,發酵過程中發酵液的總糖濃度隨發酵時間延長而下降,耗糖量隨C/N增大而增大。在本研究的C/N 水平,C/N為1的菌體生長量最小,C/N為30的菌體生長最快最多,明顯比C/N為40的生長快且多(圖3B)。可見,碳源濃度較低會限制生長,較高會抑制生長。如圖3C所示,C/N在10、20和30發酵4天的發酵液表現出最大乳化活性(依次為55.75%、54.95%、54.78%),彼此差異不顯著;C/N在1和40的發酵液乳化活性升高較晚,且顯著低于其他C/N發酵液的乳化活性(分別為19.73%、46.00%),說明過高和過低的C/N均不利于合成及積累生物乳化劑。不同C/N的發酵液表面張力均在發酵2 d降至最低(圖3D,56~59 mN/m),降低幅度很小且無顯著差異,說明生物表面活性劑生產幾乎不受C/N影響,主要由實驗菌株代謝特性決定。C/N為1的菌體生長量以及耗糖均較少;C/N為40耗糖和殘留糖均較多,糖碳源不能有效地用于菌體生長和生成生物乳化劑。C/N在10、20、30的發酵液乳化活性升高較快較多,且乳化活性較穩定,殘糖較低,其中C/N為10的發酵液殘糖及菌體生長量均較低,乳化活性最大,達到55.75%,說明產生的還原糖被較快較多地用于合成生物乳化劑。

圖3 不同碳氮比發酵產生物表面活性劑時總糖或甘油(A)、細胞生長量(B)、乳化活性(C)、表面張力(D)變化Fig. 3 Changes of total sugar or glycerol (A), cell growth amount (B), emusifying activity (C), surface tension (D) when biosurfactant was produced by fermentation with different carbon and nitrogen ratio
綜上所述,碳氮比過高和過低均不利于菌體生長和生物表面活性劑合成,選擇C/N為10發酵產生物乳化劑,既利于菌體生長和生物表面活性劑合成,也利于有效利用碳源,降低生產成本。
3 結論
實驗菌株Ochrobactrumsp. XY-1以4 g/L硝酸鈉為氮源,可以利用10 g/L的蔗糖、乳糖、甘油、木糖、果糖生長并合成生物乳化劑,蔗糖碳源的菌體生長較快較多且高產生物乳化劑,發酵5 d達最大乳化活性56.3%;雖然乳糖碳源的菌體生長較差,但有利于合成生物乳化劑和生物表面活性劑。以10 g/L蔗糖碳源并分別以相同氮含量(0.05 mol/L)的谷氨酸、天冬氨酸、賴氨酸、精氨酸和纈氨酸為氮源,也表現出生長和合成生物乳化劑,以天冬氨酸和谷氨酸為氮源較突出,且天冬氨酸比谷氨酸氮源發酵的細胞生長量小,發酵液乳化活性較快(發酵4 d)升至最高(54%)。使用天冬氨酸氮源比硝酸鈉氮源的菌體生長更快更多,提前1天達到略低的最大乳化活性。以蔗糖為碳源,在C/N為10的菌體生長較少,但乳化活性達到最大55.75%。跟同類研究比,本實驗菌株發酵液的乳化活性不高,發酵較慢,可以通過優化培養條件得以改善。今后應進一步研究更多水溶性和水不溶性碳源的發酵特性以及不同碳源和氮源的組合發酵效果,并對所產生物乳化劑進行提取和化學組成分析,建立構效關系。

