光動力療法在治療消化道腫瘤中的應用與研究進展
石霞飛,陳茜茜,2,車伯琛,陰慧娟*,李迎新*
(1. 中國醫學科學院北京協和醫學院生物醫學工程研究所,天津 300192;2. 國家康復輔具研究中心,北京 100176)
光動力療法(photodynamic therapy,PDT)作為一種新型的腫瘤治療方法,于20世紀80年代早期首次用于食管癌的治療[1]。由卟吩姆鈉(porfimer sodium)和630 nm準分子染料激光器介導的PDT治療淺表食管癌取得了令人矚目的效果后[2],PDT于1994年和2005年先后被日本和韓國批準作為淺表食管癌的姑息性治療方法;并于1995年,被美國食品藥品監督管理局(Food and Drug Administration,FDA)批準用于晚期食管癌的姑息性治療。
但與許多治療方法類似,PDT不能對靶病變部位進行組織學檢查(可用于評估腫瘤的侵襲)。此外,如果使用劑量不當,可能會導致胃腸道狹窄。當使用卟啉(photofrin),即首個被批準上市的的光敏劑(photosensitizer,PS)進行PDT時,可能會出現嚴重的皮膚和眼部光毒性反應[3]。上述弊端導致PDT在胃腸道疾病中的應用減少。但由于其微創性、對腫瘤的高選擇性以及操作簡單而具有良好的患者依從性,它仍被廣泛用于姑息性治療和挽救性治療。近年來,隨著科學研究的發展,先進的PDT技術,如納米顆粒、新的光敏劑和光源更容易到達局部病變部位。目前PDT使用的大多數光敏劑都是帶熒光的,這使得其在治療過程中可以成像。最近,這個特性得到了極大的利用。隨著這些新技術的發展,結合內窺鏡設備的改進,PDT可能被用于治療各種胃腸道疾病。內窺鏡下切除(endosccopic resection,ER)包括黏膜下剝離術(endosccopic submucosal dissection,ESD)和黏膜下切除術(endosccopic mucosal resection,EMR),已成為早期淺表消化道腫瘤盛行的標準治療方法[3]。
本文中,我們將對目前PDT在消化道腫瘤中的應用和研究進行總結,并在此基礎上介紹PDT最新的臨床應用。
1 原理和機制
PDT是一種利用光能破壞異常和惡性病變組織的臨床治療方法,包括特定波長的光、氧分子和光敏劑三大要素。在特定波長光的照射下,光敏劑從基態(S0)到激發單重態(S1),經過系統間交叉到壽命較長的激發三重態(T1)[4-5]。光敏劑在T1狀態下有兩種可能的反應類型[6]:1)Ⅰ型反應,即激發分子與底物反應生成活性基團,活性基團又與生物成分如質膜、肽、蛋白質和核酸反應[7-8];2)Ⅱ型反應,其涉及激發單重態的活化光敏劑向氧分子的能量轉移。能量從T1態轉移到生物底物(R)和分子氧,通過Ⅰ型和Ⅱ型反應產生活性氧物質(reactive oxygen species,ROS),包括1O2、H2O2、O2*、HO*等,最終引起細胞損傷,從而導致腫瘤細胞壞死或凋亡,具體作用原理如圖1所示[9]。這兩種反應都是瞬時發生的,其發生的可能性取決于所用光敏劑的類型、底物和氧的豐度以及光敏劑對底物的結合親和力[10]。此外,由于活性氧物質的半衰期較短,PDT效應僅限于局部和鄰近細胞[10]。
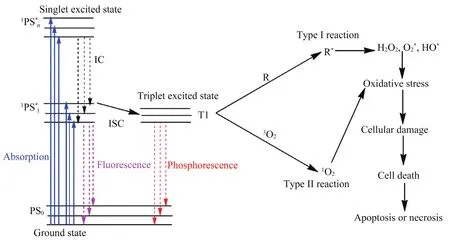
圖1 PDT的作用原理圖[11]Fig. 1 Schematic diagram of PDT[11]
隨著光纖技術的發展,PDT被廣泛地應用于各種腔系腫瘤的治療。其在腫瘤治療方面具有很多優勢,如創傷小、毒性低、特異性強、重復性好等。此外,它可以消除復發性病變,激活繼發性免疫反應[12]。美國FDA已批準將內窺鏡光動力療法(endoscopic photodynamic therapy,EPDT)用于一系列腫瘤的治療,包括肺癌、宮頸癌及各種消化道惡性腫瘤(如食管癌、膽管癌、胃癌、結直腸癌等)[13-14]。
消化道由口開始,以肛門結束,并被腔體包圍。大多數消化道腫瘤發生在黏膜層,即最暴露的部分。隨著柔性內窺鏡技術的發展,光能可以直接傳輸到消化道的惡性病變部位,這使得PDT成為一種受歡迎的微創局部治療方式[15]。結合成像劑量學和標定,其應用潛力甚至更大[16]。
2 PDT治療消化道腫瘤的研究
2.1 食管癌PDT
PDT在美國和日本被批準作為一種內窺鏡手術后,食管癌成為其第一個臨床適應癥。目前PDT已被用于內窺鏡下切除巴雷特食管(Barrett’s esophagus,BE),并在一定程度上消除高度異常病變[17-20]。表1是對目前PDT治療食管癌的代表性研究詳細整理的結果,包括腫瘤類型、納入的病例數、病理分期、所用光敏劑及其給藥方式和治療效果等。通過這些研究可以發現,使用PDT可以在淺表病變治療中達到完全緩解(complete remission,CR)的效果。關于將PDT用于局限在黏膜層的食管鱗狀細胞癌(squamous cell carcinoma,SCC)的研究表明,雖然這些患者大部分有嚴重的共病,無法手術切除,但這些患者淋巴結轉移風險較低,因此PDT可以代替食管切除術對其進行治療[19]。既往研究表明PDT治療食管黏膜鱗狀細胞癌患者的總生存(overall survival,OS)與食管癌切除術患者相似,無重大并發癥及治療相關死亡[21-22]。與內窺鏡切除相比,PDT并發癥發生率低,操作簡單,不受病變大小和周長的限制。鑒于這些結果,對于有嚴重的共病及無法在內窺鏡下完全切除的大面積或多病灶性淺表鱗狀細胞癌患者,PDT似乎是替代內窺鏡切除術的理想治療方法。
2.1.1 放化療局部失敗的食管癌的挽救性治療
最近的研究表明,PDT在食管癌最終放化療(chemoradiotherapy,CRT)局部失敗的挽救性治療中發揮了有益作用。CRT后發現局部殘留病變時,應優先考慮將挽救性食管切除術作為治療方案。然而,與計劃性食管切除術相比,該方法具有更高的術后死亡率和復發率[33]。雖然EMR可能是這些病例的另一種治療方法,但其僅限于表面病變,而且手術需要經驗豐富的內窺鏡醫師。另一方面,PDT可用于淺表腫瘤和晚期食道鱗狀細胞癌的姑息性治療。最初,卟吩姆鈉介導的PDT被引入作為CRT后局部失敗的挽救性治療。為了達到更好的治療效果,PDT作為挽救性治療的適應癥如下:1)PDT前電子計算機斷層掃描(computed tomography,CT)未見淋巴結或遠處轉移;2)原發部位殘留或復發腫瘤,分期不超過T2;3)未侵犯頸段食管;4)ER包括ESD未見因放射治療伴深部潰瘍或嚴重纖維化或病變侵入深部黏膜下層;5)患者拒絕手術或身體并發癥導致無法忍受手術。在目前的研究中PDT顯示了良好的療效,同時對CRT局部失敗患者有長期療效[28,34]。Yano等[35]的前瞻性研究證實了挽救性PDT治療CRT局部失敗后的有效性和安全性。試驗中25例局限于黏膜下層的局部失敗患者被納入,治療時光敏劑卟吩姆鈉以2 mg/kg靜脈注射,48 h后用630 nm準分子燃料激光器(EDL-1,日本濱松)照光,以光功率密度160 mW/cm2照射7 min 48 s,達到的能量密度為75 J/cm2。治療后19例PDT患者獲得了CR(CR率為76%)。其中1例與治療相關的死亡是由胃腸出血導致的,懷疑是治療部位的食管主動脈瘺在腹膜透析后約1個月發生的[29,35]。另一項對113例CRT后T2內局部衰竭的患者進行的大規模研究顯示:中位隨訪時間為5年或更長時,PDT后5年無進展生存率(progression-free survival,PFS)和OS分別為22.1%和35.9%,但治療后再復發的死亡率僅為1.8%[28]。在一項37例連續局部衰竭患者(CRT前的病例對應分期為T1/T2/T3/T4 的患者數分別為3/4/24/6,對應N0/N1的患者數為13/24)的回顧性研究中,使用卟吩姆鈉介導的PDT進行挽救性治療,卟吩姆鈉以2 mg/kg靜脈注射,于注射后48 h和72 h分別照光,總的光劑量為75 J/cm2。在為期55個月的后期隨訪中有22例(59.5%)出現CR,5年PFS為20.7%,中位OS為36.1%。因此,對于無轉移患者,PDT可以作為一種很好的治療選擇[27]。
2.1.2 完全或部分梗阻性食管癌的姑息性治療
由局部晚期食管癌引起的吞咽困難是一個嚴重的問題,而在實踐中放置自膨脹金屬支架(selfexpandable metallic stent,SEMS)可以快速緩解癥狀。卟吩姆鈉介導的PDT在日本只被批準用于治療淺表食管癌,但PDT最初被FDA批準用于癥狀梗阻性食管癌的姑息性治療。既往研究表明,SEMS是姑息性治療的首選,其療效優于PDT等其他激光治療[36]。然而,由于嚴重的疼痛或放療,有些病例在放置SEMS時存在困難(圖2)。Lindermann等[31,37]對250例接受包括PDT在內的多模式姑息性治療的食管癌不可手術患者進行了回顧性研究,比較了包括支架放置和近距離治療在內的多模式姑息性治療的療效。其中PDT治療時光敏劑以2 mg/kg靜脈注射給藥,48 h后進行照光,所用光源為630 nm KTPNd : YAG激光器(Laserscope;Surgical Systems,Gwent,UK),照射能量為100 J/cm2,治療后與其他治療方法相比,PDT顯示了最有利的生存結果:中位生存期為50.9個月。而如果最初使用其他療法(內窺鏡擴張、腔內近距離放射治療、外照射、化療、支架植入、飼管或姑息性切除),中位生存期為17.3個月[31]。Heier等[38-39]進行了兩項隨機對照試驗,比較了PDT和Nd:YAG熱消融治療對晚期食管癌吞咽困難的緩解效果。總的來說,兩種療法在改善吞咽困難方面的效果是一樣的,但是PDT的反應時間更長。
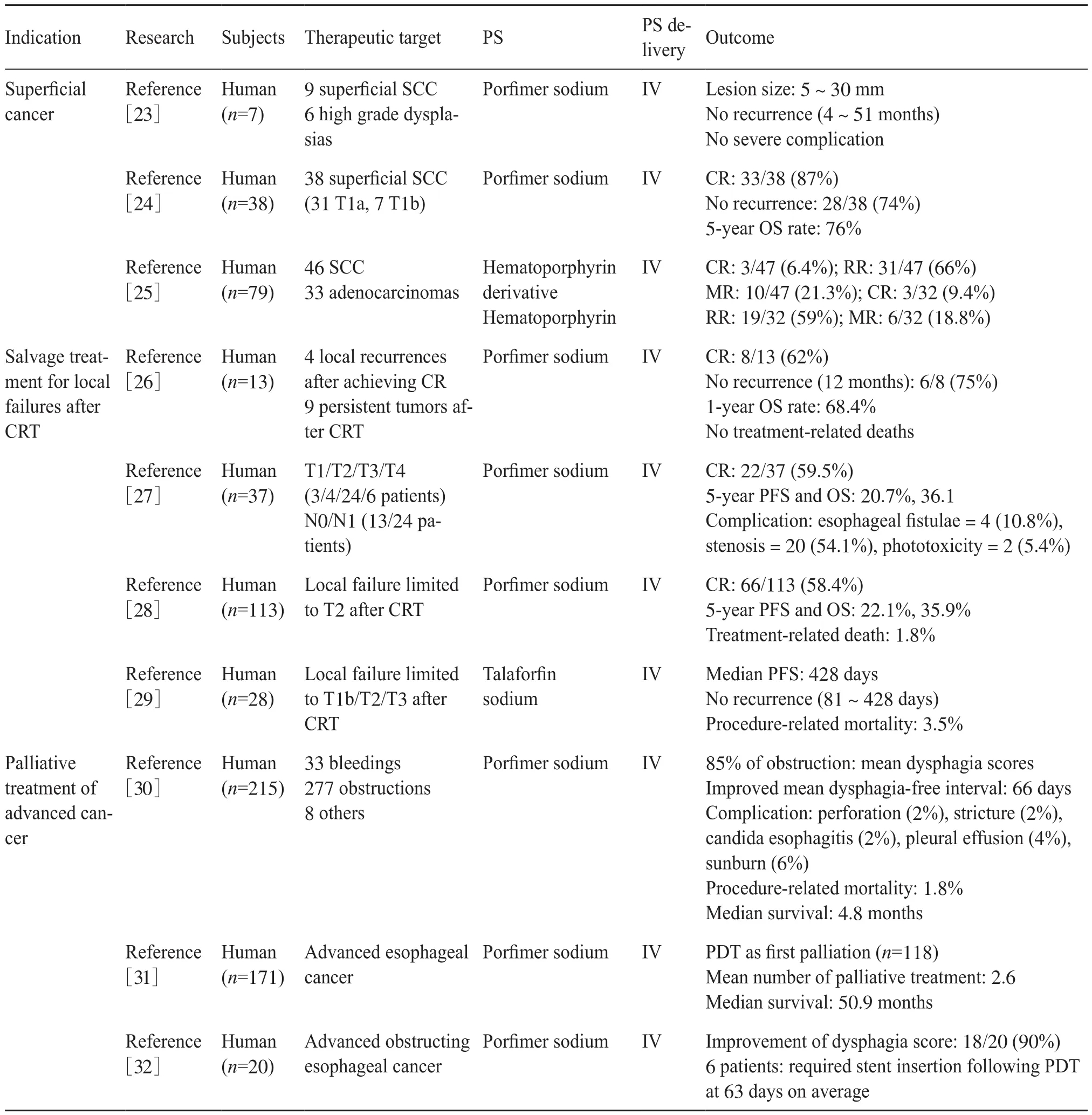
表1 食管癌的光動力治療Tab. 1 Photodynamic therapy for esophageal carcinoma
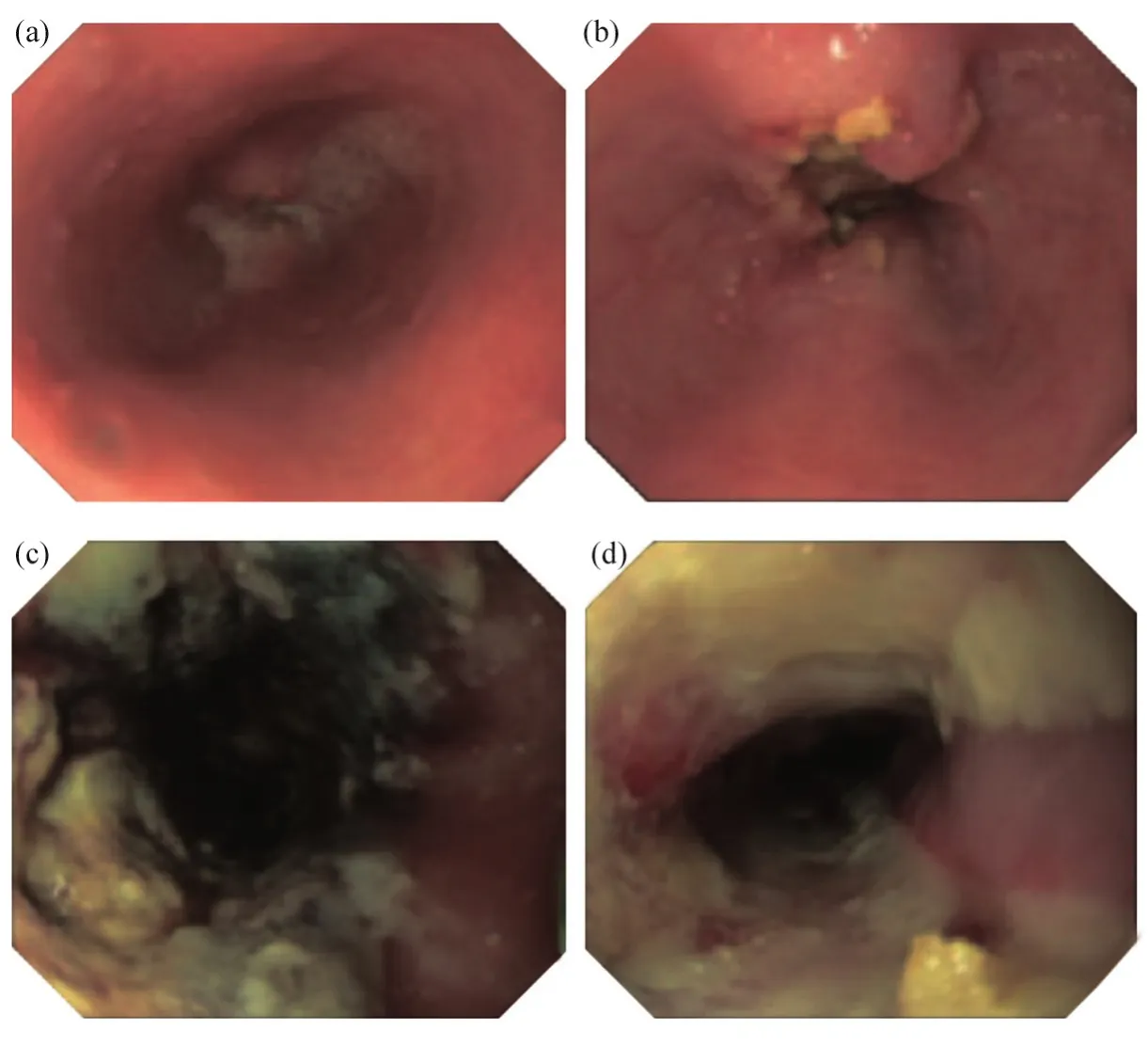
圖2 1例阻塞性食管癌CRT術后復發患者使用卟吩姆鈉介導的PDT進行姑息性治療[40]Fig. 2 Palliative treatment of PDT using porfimer sodium for a patient with obstructive recurrent esophageal cancer after CRT[40]
2.1.3 食管癌PDT的主要并發癥和副作用
在PDT治療食管癌的研究和臨床應用中,使用更多的是第一代光敏劑卟吩姆鈉,但是由于避光期較長,吞咽困難緩解的時間較長,卟吩姆鈉的適應癥可能比較有限。目前世界范圍內市場上有幾種可供臨床應用的光敏劑,包括卟吩姆鈉、替莫泊芬、塔拉泊芬鈉和5-氨基酮戊酸。表2為上述光敏劑的最佳激發波長和獲批國家。其中日本治療食管癌的兩種主要的光敏劑是第一代的卟吩姆鈉和第二代的塔拉泊芬鈉。PDT的臨床試驗使用卟吩姆鈉治療食管癌的主要并發癥包括食管狹窄需要球囊擴張6例(25%)和食管主動脈瘺1例(4%)[41]。因此,在使用塔拉泊芬鈉的PDT試驗中,放療前出現基線T4主動脈侵犯或病變大于3 cm或管腔半周的患者被排除。根據修訂后的標準,使用塔拉泊芬鈉進行PDT試驗時未見食管穿孔或狹窄的報道[29]。在治療前評估病變的深度和確定其與大動脈的距離是很重要的,尤其是在使用塔拉泊芬鈉時,因為與第一代光敏劑相比,塔拉泊芬鈉使用了更長波長的激光。這兩種藥物最顯著不同的并發癥是皮膚光毒性。在基于塔拉泊芬鈉的PDT中沒有患者出現皮膚光毒性,而32%的患者在使用卟吩姆鈉后至少一個月的避光期內出現皮膚光毒性[29,42]。
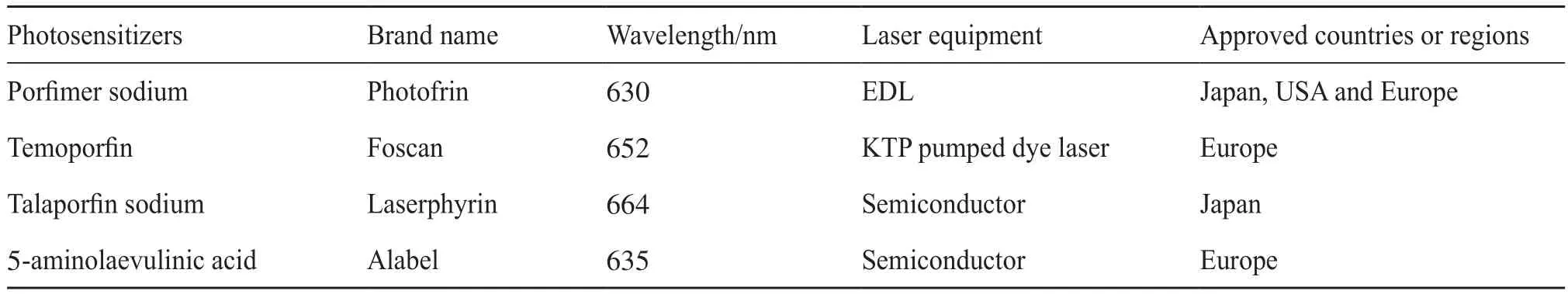
表2 光敏劑在世界食管癌治療中的臨床應用Tab. 2 Clinical application of photosensitizers for esophageal cancer worldwide
2.1.4 PDT治療食管癌的展望
隨著第二代光敏劑的出現,PDT在世界范圍內的食管癌治療中將會越來越普及。新的光敏劑制劑應開發具有更高選擇性的分子靶向制劑,代謝更快,滲入聚集更深。成本效益也是廣泛使用PDT的一個關鍵問題。這種手術需要昂貴的光敏劑和激光設備,然而,在日本這種手術是由全民保險覆蓋的,比外科手術更便宜。對于使用第一代光敏劑的PDT,卟吩姆鈉提供了最長的質量調整后的預期壽命,使其比手術干預更具成本效益。然而,最近的一項研究表明,與其他內窺鏡技術或食管切除術相比,其有效性的證據還不夠充分和確定[43]。此外,第二代光敏劑在食道的PDT治療的成本-效果分析還比較缺乏,需要進一步研究。隨著社會老齡化,PDT作為一種比手術更方便、更簡單的方法,有可能應用于更多的患者。
2.2 膽管癌PDT
膽管癌(cholangiocarcinoma,CCC)早期診斷困難,發現時常已處于晚期,難以切除。膽管支架植入術主要通過使用自擴張金屬支架,已成為惡性狹窄無法切除的CCC的姑息性治療的主要手段[44]。然而,預防腫瘤的生長和維持支架的通暢仍是亟待解決的問題[45]。肺門癌患者可用的姑息性治療法包括PDT,這是一種單一的微創療法,并發癥少,耐受性好。PDT聯合膽管支架是一種很有吸引力的治療方法,因為它通過產生單線態氧減少腫瘤組織的局部阻塞,并可能維持長期通暢。幾項無對照和對照研究比較了單獨支架植入術與PDT支架植入術對不可切除的CCC的影響[46-54]。如表3所示,在膽管癌的PDT治療中,所用光敏劑主要是卟吩姆鈉,相比于對照組,PDT聯合膽管支架治療后,患者的中位生存期顯著延長,最長達630 d。這些試驗表明,PDT通過減少支架翻修和經皮膽管引流等進一步手術的需要,改善了患者膽汁淤積狀況,并提高了其生活質量。PDT可能導致腫瘤“重塑”,以延長或增強減壓效果,從而延長了支架的開放時間。PDT也與不能切除的CCC患者的OS增加有關。PDT的不良反應是可預測的,而且相對容易治療。兩項研究都沒有報道嚴重的光毒性或與手術相關的死亡[53-54]。因此,作為不可切除的CCC的姑息性療法,PDT可能有很好的應用前景。
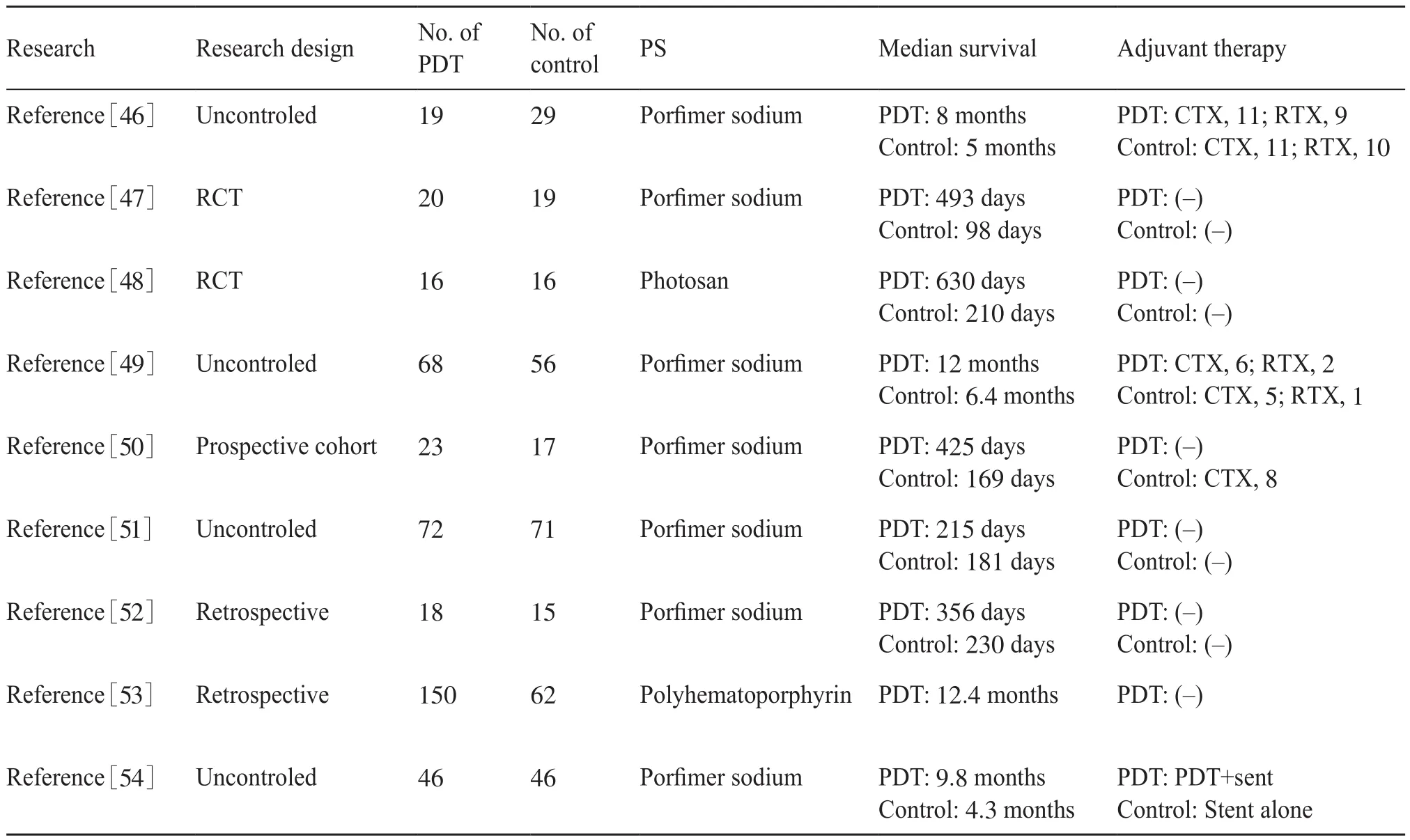
表3 光動力療法聯合膽管支架對膽管癌患者的姑息性治療Tab. 3 Palliative treatment of patients with cholangiocarcinoma by photodynamic therapy combined with biliary stent
2.3 胰腺癌PDT
目前,胰腺癌(pancreatic cancer,PanCa)的生存統計數據并不理想,手術仍是其主要的治療手段。對于那些無法手術切除的患者來說,迫切需要尋求新的治療方法。PDT在不可切除性疾病的治療中具有重要作用。已有兩篇關于使用PDT緩解不可切除性PanCa的報道[55-56],雖然這兩項研究使用了不同的光敏劑,但結果都很理想,均符合腫瘤壞死的標準。在一項關于維替泊芬的研究中,15例不能手術的癌癥晚期患者靜脈注射維替泊芬(0.4 mg/kg)60~90 min后,在CT引導下用690 nm的激光進行照射(光能量分別為5、10、20、40 J),重復治療直至出現直徑為12 mm大小的壞死區域。其中1名患者恢復到了可切除狀態,并接受了胰十二指腸切除術(whipple procedure),實現R0切除[55]。與其他治療學和納米醫學相結合,PDT在PanCa治療中具有巨大潛力。
2.4 胃癌PDT
2.4.1 光動力診斷(photodynamic diagnosis,PDD)
隨著內窺鏡診斷準確性的提高以及內窺鏡治療如EMR和ESD的侵襲性的降低,胃癌患者的預后有了顯著的改善。但是對于腸上皮化生的患者,惡性病變的檢測和切除范圍的評估仍然是困難的。近年來,PDD和PDT已經成為一種備受青睞的胃癌的診斷和治療方法。作為一種診斷方式,PDD利用了吸收光能量后,光敏劑從激發態回到基態時發射的熒光。PDD的原理與傳統的熒光引導手術方法有重疊,但通過使用光敏劑來區別自身。事實上,大多數PDD都是用5-氨基乙酰丙酸(5-aminolevulinic acid,ALA)及其衍生物作為光敏劑的。ALA是血紅素生物合成途徑中的一種天然氨基酸和早期中間體。口服ALA主要與惡性細胞結合,代謝為具有光動力活性的原卟啉IX(protoporphyrin IX,PpIX)。PpIX是一種強光敏劑,在409 nm左右(Soret波段)有很強的吸收,在505、540、575 nm和630 nm(Q波段)效率較低。在激發時,熒光發射在635 nm和705 nm[57],即在藍光激發下發出紅色熒光。這些熒光特征對于手術過程中識別腫瘤組織非常有用,可以提高對腫瘤的準確定位和更全面的熒光介導的組織切除。此外ALA的主要優點是代謝迅速,大大縮短了皮膚的光敏期,其介導的光動力診斷熒光定位可以提供良好的胃惡性病變的可視化,以確定病變程度。除ALA外,卟吩姆鈉、吲哚菁綠、間-四羥基氯苯酚、焦脫葉綠酸-a、苯并卟啉衍生物等光敏劑也用于PDD的研究。其中,間-四羥基氯苯酚、焦脫葉綠酸-a和苯并卟啉衍生物的應用還處在臨床前研究階段;而ALA、卟吩姆鈉、吲哚菁綠等已被分別批準用于臨床PDD,具體信息如表4所示[58-61]。
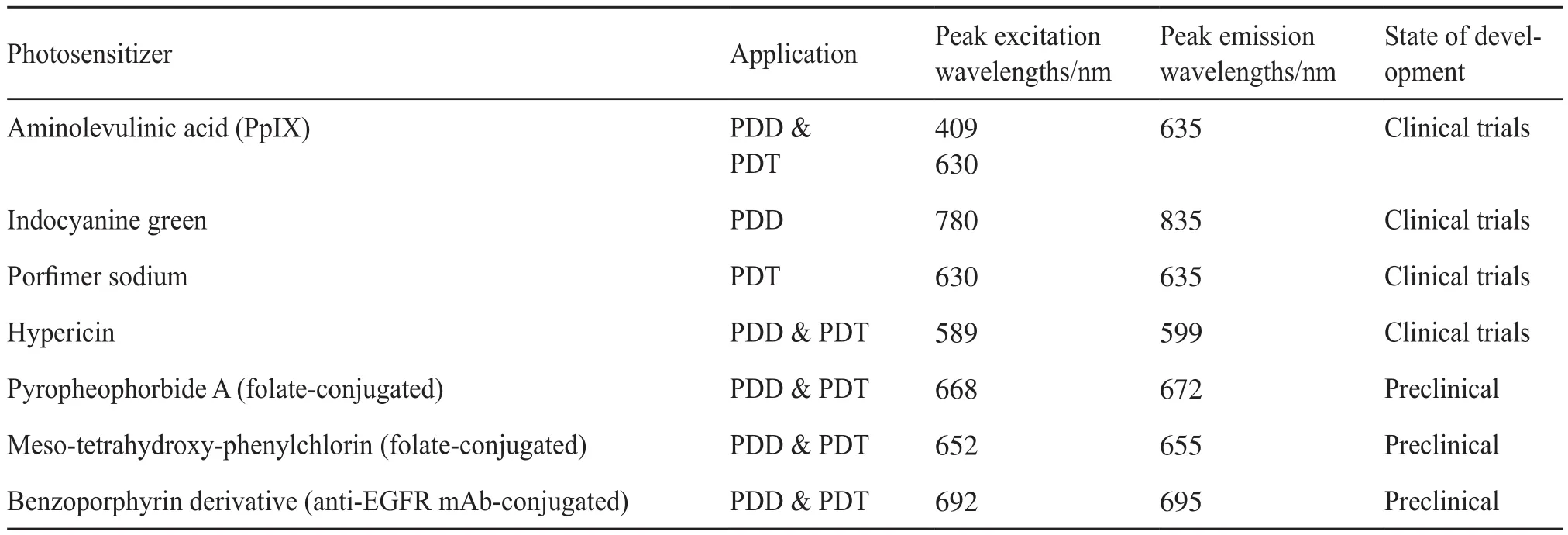
表4 PDD和PDT的臨床和試驗用光敏劑綜述Tab. 4 An overview of clinically used and experimental photosensitizers for PDD and PDT
2.4.2 PDD和PDT在胃癌中的應用
多項研究表明,ALA-PDD是一種理想的診斷胃癌微小病變和腹膜轉移的手段。Namikawa等[62-64]比較了用15~25 mg/kg ALA預處理或未處理情況下進展期胃癌的分期腹腔鏡檢查結果,顯示該方法可接受的敏感度為80%~90%,特異性為45%~100%。盡管特異性存在異質性,但與傳統白光下觀察相比,其檢出率仍有提高,至少10%的患者有新發現的腹膜轉移[61,63-64]。Kishi等[63]還特別報道了術前化療會導致假陽性率升高,特異性降低。然而,在一項較小的研究中,使用更低的ALA劑量(10~15 mg/kg)時,胃癌患者白光手術的敏感性和特異性為100%[65]。日本的一項研究表明,利用激光內窺鏡在27個病變中發現了23個上消化道腫瘤為紅色熒光定位(PDD陽性)[66]。有趣的是,除了1例腸道型癌外,其余均為PDD陽性,而印戒細胞癌為PDD陰性。為了評價對胃癌腹膜轉移的檢測價值,有研究將ALA-PDD加入到52例晚期胃癌的常規腹腔鏡診斷中。使用ALA-PDD的24例患者中有5例在白光下發現腹膜播散,肉眼未見腹膜轉移[65]。在另一項研究中,Kishi等[67]對13例血清侵襲性胃癌患者進行了ALA-PDD分期腹腔鏡檢查,發現PDD組腹膜轉移檢出率明顯高于白光組。這些結果表明,ALA-PDD可能對進展期胃癌的術前分期有幫助。
晚期胃癌的治療,尤其是血清陽性胃癌的治療,主要集中在預防腹膜復發,因為腹膜是治療性胃切除術后最常見的復發部位之一。雖然已經嘗試了幾種治療方案,包括全身輔助化療和腹腔內化療(無論是否伴有熱療和CRT)[68-70],但還沒有標準有效的治療方法來預防腹膜復發并顯著提高生存率。PDT可能是一個很好的替代治療方案,因為腹膜表面的微轉移結節和腹腔內浮動的癌細胞可能是合適的PDT治療靶點。在一項使用腹膜轉移小鼠模型的研究中發現了另一個第二代光敏劑塔拉泊芬(talaporfin),腹腔注射時在轉移結節中相比正常組織富集更多。塔拉泊芬介導的PDT在體內也發揮了相當大的抗腫瘤作用。用納米顆粒裝載吲哚菁綠給藥后48 h,所用光源為808 nm光纖耦合激光器(FC-W-808,最大輸出功率為10 W),以功率密度500 mW/cm2進行照光,照射時間為1 000 s(總的光能量密度為500 J/cm2),PDT 2周后統計小鼠擴散性結節的數量和大小。結果發現腹腔轉移結節的總重量較低,這些小鼠也有顯著的體重減輕和更高的存活率[71]。這表明PDT可能是一種有前途的診斷和治療胃癌腹膜轉移的方式。
2.5 結直腸癌PDT
結直腸癌是一種常見的消化道腫瘤,對不宜手術或經過手術、放療、化療后復發的中晚期患者,采用PDT或PDT聯合其他療法能改善腸道癥狀,延長生存期。Huang等[14]報道,腸鏡下卟啉介導的PDT治療中晚期結直腸癌患者12例,總有效率為75%,患者腸道刺激癥狀及排便習慣改變,便血和不完全性腸梗阻等主要癥狀均得到顯著改善,癥狀改善率分別為80%、100%和50%。Dohmoto等[72]對71例晚期直腸癌患者行PDT治療,結果表明79%患者癥狀有所緩解。Hodgkinson等[73]用PDT治療早期結腸癌患者2例,后經腸鏡檢查,發現病變消失,病檢未見癌細胞,無瘤生存期分別達到20和28個月。由此可見,PDT對早期結直腸癌可達到根治效果,對早期、晚期結直腸癌都具有確定療效。
3 PDD和PDT在消化道腫瘤應用中的挑戰和新進展
盡管PDD和PDT在消化道腫瘤的診斷和治療中取得了很好的效果,但也呈現出許多問題。大多數臨床研究在樣本量和指標方面受到限制,迫切需要更大規模的隨機/對照臨床試驗。關于臨床試驗的設計,必須盡可能做到標準化,這樣個體試驗更容易進行比較。每種具有不同光學特性的新光敏劑都需要確定最大耐受光敏劑劑量、光劑量和最佳給藥后照光時間。后續研究需要對原發腫瘤的類型、先前的治療方法和報道的結果參數進行均質化。
為了使PDT的效果最大化,需要進一步研究增強其3個核心元素:光敏劑、光和氧。圖3顯示了克服PDT局限性的最新進展[74-99]。
3.1 光敏劑
3.1.1 光敏劑給藥方式改進
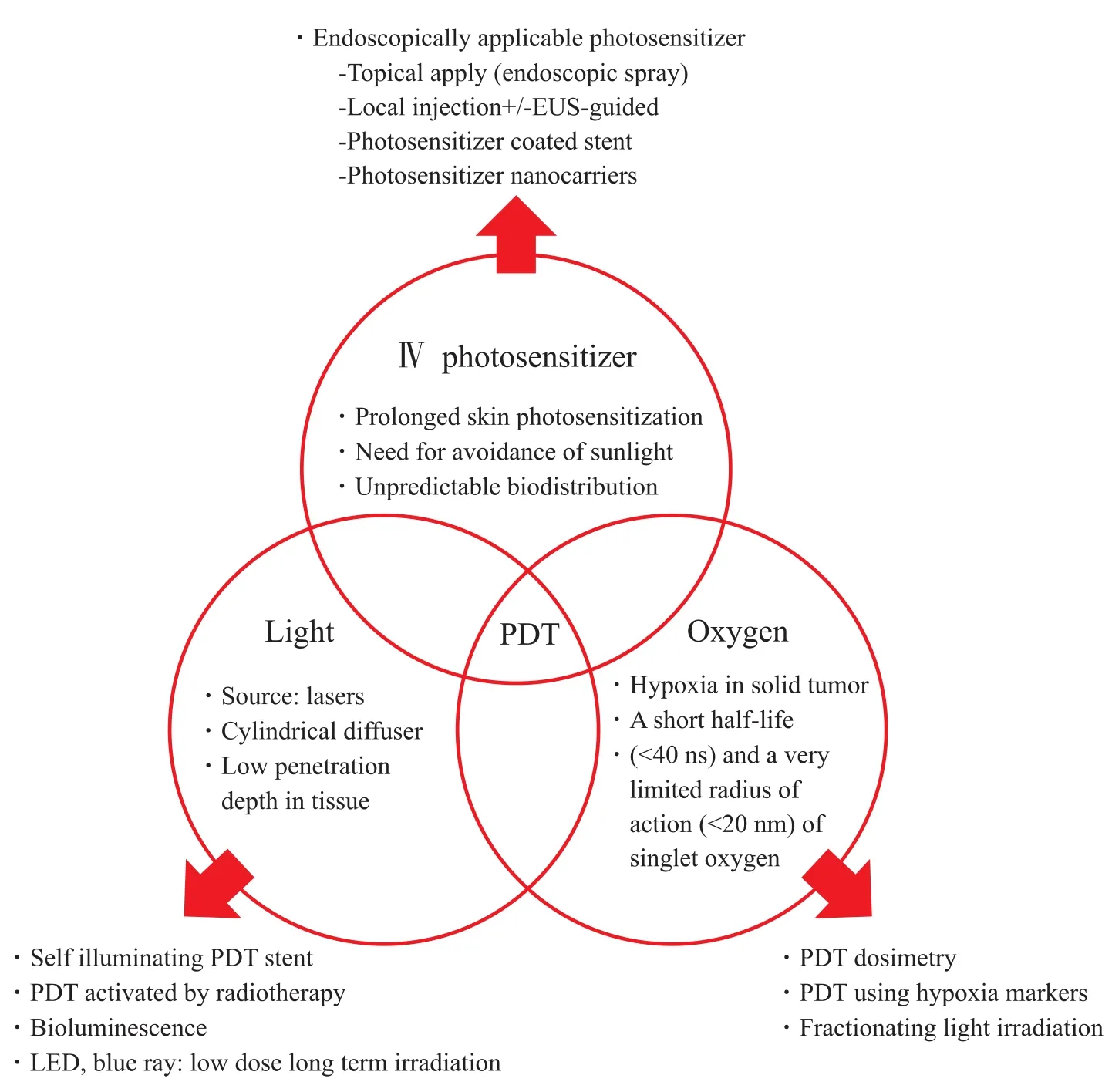
圖3 關于提高PDT治療消化道腫瘤療效的最新進展和未來展望Fig. 3 Recent developments and future perspectives with regard to improving the efficacy of PDT to treat gastrointestinal tract cancers
通過靜脈給藥,特別是多次給藥,光敏劑會引起過敏、毒副作用和未知的生物分布。未知的生物分布會導致光敏劑在眼睛和皮膚等易受光照射的非受累組織中積累,這可能導致患者在環境光照射下產生光毒性和延長光敏性。光敏劑局部給藥可以解決這些問題。局部給藥可縮短治療時間,提高療效,徹底消除皮膚光敏。針對胃腸道腫瘤局部實施PDT有幾種方法,包括通過內窺鏡腔進行噴涂,瘤內注射以及使用光篩涂層支架。近年來的研究也關注于增強光敏劑在皮膚及腫瘤組織中的滲透性,以達到更好的PDT效果。滲透性的增強可用物理方法實現,如離子導入、激光滲透、微針、超聲導入,也可加入化學促滲劑,如二甲基亞砜、油酸等[74-77]。最近還有通過納米顆粒載體和量子點來修飾光敏劑以提高吸收效果的研究報道。
3.1.2 光敏劑新藥開發
光動力技術在消化道惡性腫瘤的早期診斷和治療中的應用已得到廣泛研究。分子成像可用于早期發現病變,是消化道內窺鏡檢查領域的研究熱點。分子成像不僅能反應目標細胞的大致形態,更能使其紋路可視化。隨著新成像技術的發展(如虛擬彩色內窺鏡和放大內窺鏡等),分子成像技術也在不斷發展。在分子成像中,疾病特異性的生物標志物是使用熒光標記的外源性分子探針,包括抗體、抗體片段、多肽、納米顆粒和可激活的探針[78]。將分子探針與光敏劑結合可以增強腫瘤的靶向性和內窺鏡對微小病變的檢測。Han等[79]利用噬菌體展示技術分離出一種特異性的結腸癌肽,并將其與有望成為第二代光敏劑的血卟啉(hematoporphyrin,HPP)結合。使用熒光素異硫氰酸酯或HPP結合肽進行免疫組化染色顯示,它們對結腸癌細胞系具有很高的親和力。與單獨的HPP相比,HPP結合腫瘤特異性肽具有增強的PDT效應。這些結果表明,肽探針靶向PDT有望成為結腸癌診斷和治療的新方法。
光敏劑嵌入支架允許可重復的腔內PDT,這將抑制周圍的消化道惡性腫瘤并增加支架的通暢性。最近一項關于聚合物光敏劑(丙酮酸普魯蘭偶聯脫鎂葉綠酸 A)-內嵌自擴張無血管金屬支架的研究,在局部注射光敏劑的情況下對CCC進行可重復PDT,結果表明該支架在體外能維持至少2個月的PDT效應;此外,使用HCT-116腫瘤-異種移植小鼠模型的體內試驗顯示,激光照射后腫瘤細胞和移植瘤消退[80]。PDT可以通過單態氧破壞上皮層,從而提高非血管藥物洗脫支架(drug-eluting stents,DESs)釋放藥物的組織穿透效率(penetration efficiency,PE%),這一過程被稱為光化學組織穿透(photochemical tissue penetration,PTP)。Han等[80]將光敏劑二氫卟吩e6(chlorin e6)加入到吉西他濱(gemcitabine)洗脫的聚氨酯膜中,開發了一種PTP-DES。該支架的穿透效率是聚氨酯膜的2倍,并且在小鼠體內模型中有效地抑制了腫瘤的生長。該研究結果表明,PTP-DES系統在改善傳統DES治療效果方面有很大的潛力。
將PDT與分子靶向治療相結合的納米醫學可增強抗癌治療的效果,改善消化道惡性腫瘤患者的預后,同時降低毒性。最近,出現了一種新型的光活化抑制劑納米脂質體(multi-inhibitor nanoliposome,PMIL),它由在脂質雙分子層中摻雜了光敏劑苯卟啉衍生物(benzoporphyrin derivative)的納米脂質體和封裝了多激酶抑制劑的納米顆粒組成[81]。這種新型納米級藥物不僅能引起腫瘤細胞和微血管的光動力損傷,還能啟動卡博替尼膠囊(cabozantinib)在腫瘤內的釋放。在PanCa小鼠模型中,PMIL可導致腫瘤的長期減少和轉移抑制。這些結果為PDT在腫瘤選擇性化療中的應用奠定了基礎。
3.2 PDT光源改進
為了提高PDT的臨床應用,第二個關鍵點是提高激發光的組織靶向性。在PDT中,利用現有的光源可以很容易地照射表面組織,但是很難到達深部腫瘤組織。例如,藍光(400~450 nm)僅可穿透約1.0 mm的組織,橙光(590~620 nm)可穿透約1.5 mm的組織,而紅光(620~750 nm)穿透較遠,可達3.0 mm[82]。較新的光源(如LED)正在被開發,以更有效地傳遞光。LED可以產生所需波長的高能量光,并能按照一定的幾何形狀和尺寸進行組裝[83-84]。為了提高激發光到達腫瘤組織的效率,我們團隊針對直腸的特殊結構,專門設計和研發了直腸栓劑試劑盒,包括ALA栓劑和LED栓劑試劑盒。ALA栓劑可于37℃在30 min內軟化無硬心,直腸給藥后靶向聚集在腫瘤部位。LED直腸栓光源的電功率為0.2 W,輸出的光功率密度為20 mW/cm2,能實現長時間穩定輸出。與常用的光纖耦合激光相比,LED直腸栓光源明顯提高了PDT治療直腸癌的效果[85]。Guyon等[86]研究了一種可以植入在腹腔內的光照射板,這種光照射板實現了對腹膜腔的均勻照射。使用腔鏡光照射的腹腔內光彌散也是一種很有前途的照光新方法[87]。Sedat等[88]開發了由生物衍生或生物相容性和生物可降解聚合物制成的可植入式光傳輸裝置,使用梳狀平面波導,實現了豬皮膚全厚度(>10 mm)的傷口愈合。這一結果為光在深層組織中的應用指明了新的方向。但光在組織中的穿透深度總是有限的,仍需要考慮激發光敏劑的替代方法[89]。
最近出現了一種利用X射線輻射誘發PDT的新方法。由于組織對于X射線幾乎是全透過的,這種方法可以非侵入地遠距離激發光敏劑,并有可能在整個放射過程中持續(圖4)。這種技術依賴于納米粒子,其能實現電離輻射的下轉換,如將X射線轉換為可見光[90]。當與光敏劑結合時,納米助搖器可以將用于放射治療的X射線轉換成可見光,繼而激發光敏劑。這種X-PDT療法在體外和體內都獲得了令人鼓舞的結果,Hu等和Fan等分別對這些結果進行了綜述[91-96]。
3.3 組織氧濃度
在PDT過程中,通過測量氧分壓和缺氧標記物的水平來監測腫瘤組織的氧合情況,以便在光照過程中改善靶組織中單線態氧的分布。此外,通過控制光/暗周期來分割光照射可以促進組織氧再灌注,以補償光化學反應引起的氧消耗[97-99]。
4 總結與展望
本文回顧了一些使用PDT治療消化道惡性腫瘤的關鍵研究。PDT的缺點包括不理想的療效、光毒性和高成本,這些都降低了人們對用該方法治療消化道惡性腫瘤的最初熱情。因為PDT是一種微創手術,所以它仍然可以起到緩解和挽救的作用。近年來,PDT的應用范圍不斷擴大,在早期診斷、局部失敗的挽救性治療、消化道癌變的緩解等方面取得的良好效果,為PDD和PDT的應用提供了新思路。隨著各種關于光傳遞和高特異性光敏藥物創新方法的發展,最具限制性的挑戰可能得到解決。將PDT與分子成像、DES和納米技術等現有技術相結合,有望使PDT成為治療消化道腫瘤的理想選擇。
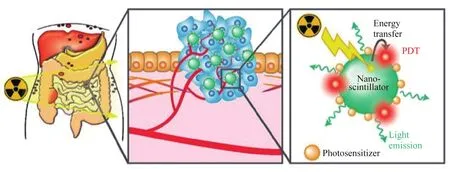
圖4 光致發光納米材料介導的放射治療激活PDT治療腹膜癌的原理圖[90]Fig. 4 Schematic overview of the use of radiotherapy-activated PDT for peritoneal carcinoma (PCAR) using radioluminescent nanomaterials[90]
此外,目前在PDT治療消化道腫瘤的研究和臨床治療中所用的光源還是以激光為主,其過于依賴內窺鏡導致價格昂貴、操作復雜,中小型醫院很難開展。因此體積更小、重量更輕、更穩定、耐受性更高的光源將成為PDT光源研究的主要方向,如近年來備受青睞的LED光源。因此,在PDT治療消化道腫瘤的發展中,從短期到中期,結合PDT和PDD引導下的腫瘤消融手術可能是很有前途的。長期來看,X光激活的PDT可能會突破治療中肉眼難以發現的轉移瘤的最終限制,這將進一步推動PDT治療消化道腫瘤的臨床應用。

