白背飛虱VAMP7和Vti1a蛋白的原核表達、抗體制備及應用
張瀟婉 張璐 劉文文 李莉 王錫鋒

摘要 :白背飛虱Sogatella furcifera的囊泡相關膜蛋白7(VAMP7)和囊泡轉運蛋白(Vti1a)隸屬于SNARE(soluble Nethylmaleimidesensitive factor attachment protein receptor)家族,該家族蛋白主要參與生物體中關鍵的膜轉運過程。前期研究發現這兩種蛋白分別與南方水稻黑條矮縮病毒Southern rice blackstreaked dwarf virus (SRBSDV)的主要外層衣殼蛋白P10存在顯著互作,推測可能協助病毒粒體在介體白背飛虱內的轉運和擴散。為了進一步利用血清學技術研究VAMP7和Vti1a在傳毒過程中的功能,本研究克隆了白背飛虱編碼這兩種蛋白的基因,成功構建了VAMP7和Vti1a基因的原核表達載體,并將載體分別轉入大腸桿菌中進行誘導表達,得到了相應的原核表達蛋白。在蛋白純化后,將純化蛋白注射于新西蘭大白兔體內進行免疫,分別制備得到VAMP7和Vti1a的抗體。兩種抗體經Western blot檢測發現,均可分別與白背飛虱體內的VAMP7和Vti1a特異性結合。利用制備的抗體對白背飛虱的腸道進行免疫標記,激光共聚焦顯微鏡觀察發現所制備抗體能夠在白背飛虱中腸上皮細胞的胞質中特異性標記到VAMP7和Vti1a,表明制備的抗體能夠成功用于這兩種蛋白的體內外檢測,為闡明這兩種蛋白參與傳播SRBSDV的機制研究奠定了基礎。
關鍵詞 :白背飛虱; 囊泡相關膜蛋白7; 囊泡轉運蛋白; 原核表達; Western blot; 免疫熒光標記
中圖分類號: S 435.112.3
文獻標識碼: A
DOI: 10.16688/j.zwbh.2019622
Preparation and application of the antibodies of Sogatella furcifera VAMP7 and Vti1a proteins expressed in Escherichia coli
ZHANG Xiaowan, ZHANG Lu, LIU Wenwen, LI Li*, WANG Xifeng
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant
Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract :Vesicleassociated membrane protein 7 (VAMP7) and vesicle transport through interaction with tSNAREs homolog 1a (Vti1a) of Sogatella furcifera belong to the SNARE family, participating in the vesicular transport. In our previous study, they interacted with the P10 of Southern rice blackstreaked dwarf virus (SRBSDV) respectively, and might facilitate virion transport in insects. In order to use the serological techniques to further validate their functions, the prokaryotic expression vectors of VAMP7 and Vti1a genes were constructed and then transformed into strain BL21 (DE3) of Escherichia coli and expressed by IPTG induction. Purified proteins were used to immunize rabbits for preparation of polyclonal antibodies. Western blot showed that the prepared antibodies could specifically bind to the recombinant proteins and VAMP7 and Vti1a in S.furcifera, respectively. Immunofluorescent labeling assay revealed that VAMP7 and Vti1a were located in the cytoplasm of the midgut epithelia in S.furcifera, which laid the foundation for the functional study of VAMP7 and Vti1a in SRBSDV transmission.
Key words :Sogatella furcifera; VAMP7; Vti1a; prokaryotic expression; Western blot; immunofluorescence
白背飛虱Sogatella furcifera (Horváth)屬半翅目Hemiptera飛虱科Delphacidae,是重要的遷飛性害蟲。以成蟲和若蟲群棲稻株基部刺吸汁液,使水稻生長緩慢、分蘗延遲、癟粒增加,為害嚴重時,造成稻株枯死,呈“虱燒”狀[1]。除了直接為害外,作為南方水稻黑條矮縮病毒Southern rice blackstreaked dwarf virus (SRBSDV)唯一的傳播介體,對于該病毒病害近年在我國的暴發流行發揮了關鍵作用[2]。白背飛虱以持久循回增殖方式傳播SRBSDV,病毒進入白背飛虱體內后,會與蟲體內多種蛋白發生互作,從而克服相應的傳播屏障[34]。本實驗室前期以SRBSDV的主要外層衣殼蛋白P10為誘餌,篩選白背飛虱cDNA文庫,得到了囊泡相關膜蛋白7(vesicleassociated membrane protein 7, VAMP7)和囊泡轉運蛋白(vesicle transport through interaction with tSNAREs homolog 1a, Vti1a),進一步利用pulldown技術驗證這兩種蛋白分別與SRBSDVP10存在顯著互作,而且在白背飛虱腸道內表達量最高,推測他們在白背飛虱高效傳播SRBSDV的過程中發揮了重要作用[5]。
1.2.5 免疫熒光法檢測白背飛虱腸道內的VAMP7和Vti1a的定位
在解剖鏡下剖出白背飛虱的腸道,用4%的多聚甲醛固定1 h后用0.01 mol/L磷酸緩沖液(PBS)清洗3次,每次5 min;用0.2%的TritonX100滲透2 h后,
PBS清洗3次,每次10 min;用PBS
稀釋牛血清白蛋白為3%的抗體稀釋液,然后將其按照1∶100的比例稀釋VAMP7和Vti1a的一抗,利用稀釋后的一抗孵育2 h,PBS洗3次,每次10 min;然后再用稀釋后的二抗 antirabbit IgGCy3(1∶200)孵育1.5 h,PBS洗3 次;在避光環境中,將清洗后的白背飛虱腸道固定于載玻片上,利用激光共聚焦顯微鏡(LSM TPMT, Germany)觀察VAMP7和Vti1a的定位情況。
2 結果與分析
2.1 白背飛虱VAMP7和Vti1a基因的克隆
利用PCR獲得VAMP7和Vti1a的目的片段(圖1),其中VAMP7基因為651 bp,Vti1a基因為669 bp。PCR產物切膠回收后與載體PEASYT5進行重組,獲得中間載體PEASYT5VAMP7和PEASYT5Vti1a。轉化大腸桿菌,陽性克隆測序后分別通過BLAST比對分析,基因同源性均可達99%以上。
2.2 載體構建與重組蛋白表達
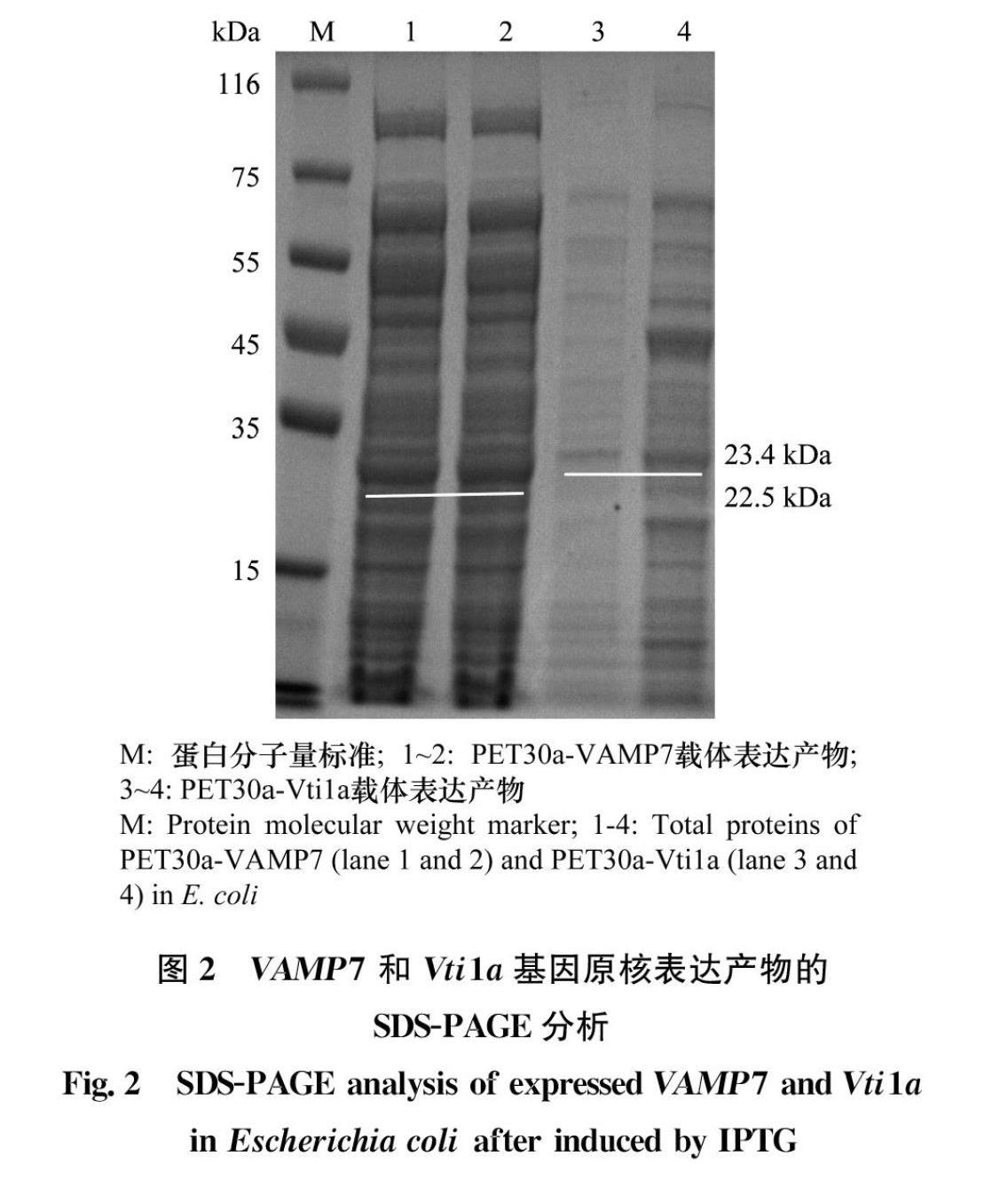
將目的載體PET30a與測序正確的中間載體進行LR重組,獲得重組原核表達載體PET30aVAMP7和PET30aVti1a,然后將這兩種原核表達載體分別轉入大腸桿菌BL21(DE3)感受態細胞中,挑取單菌落于LB液體培養基中培養。在37℃、200 r/min條件下,IPTG誘導4 h后,利用SDSPAGE凝膠電泳檢測蛋白表達情況。結果發現,目的蛋白已特異性表達,VAMP7和Vti1a蛋白大小分別為22.5 kDa和23.4 kDa,與預期的大小一致,而未誘導的菌液樣品中未見目的條帶(圖2)。因為前期設計的VAMP7和Vti1a融合蛋白含有6×His標簽序列,因此在Western blot檢測中,選用6×His單克隆抗體特異性檢測目的蛋白的表達情況。結果表明,抗體可分別與VAMP7和Vti1a的融合蛋白發生特異性反應(圖3)。蛋白純化中需利用可溶性的蛋白,因為外源基因在大腸桿菌中表達容易產生包涵體蛋白,因此本實驗對獲得的融合蛋白進行了檢測,結果發現,誘導得到的融合蛋白為包涵體蛋白,需要進一步優化誘導條件,以獲得可溶性蛋白。
2.3 可溶性蛋白的誘導及純化
為獲得可溶性蛋白,本試驗進一步優化誘導條件:當菌液OD600為0.1時,向其中加入 IPTG 至終濃度為 0.1 mmol/L,將其置于16℃,100 r/min的條件下誘導過夜。超聲波破碎誘導后的菌體,離心得上清和沉淀。利用SDSPAGE電泳分別對收集獲得的上清和沉淀進行檢測,結果表明,沉淀和上清中均含有目的蛋白。因沉淀中常存在包涵體蛋白,因此本研究選擇回收純化上清中的可溶性蛋白(圖4),用于下一步的抗體制備。
2.4 抗體的制備及Western blot檢測
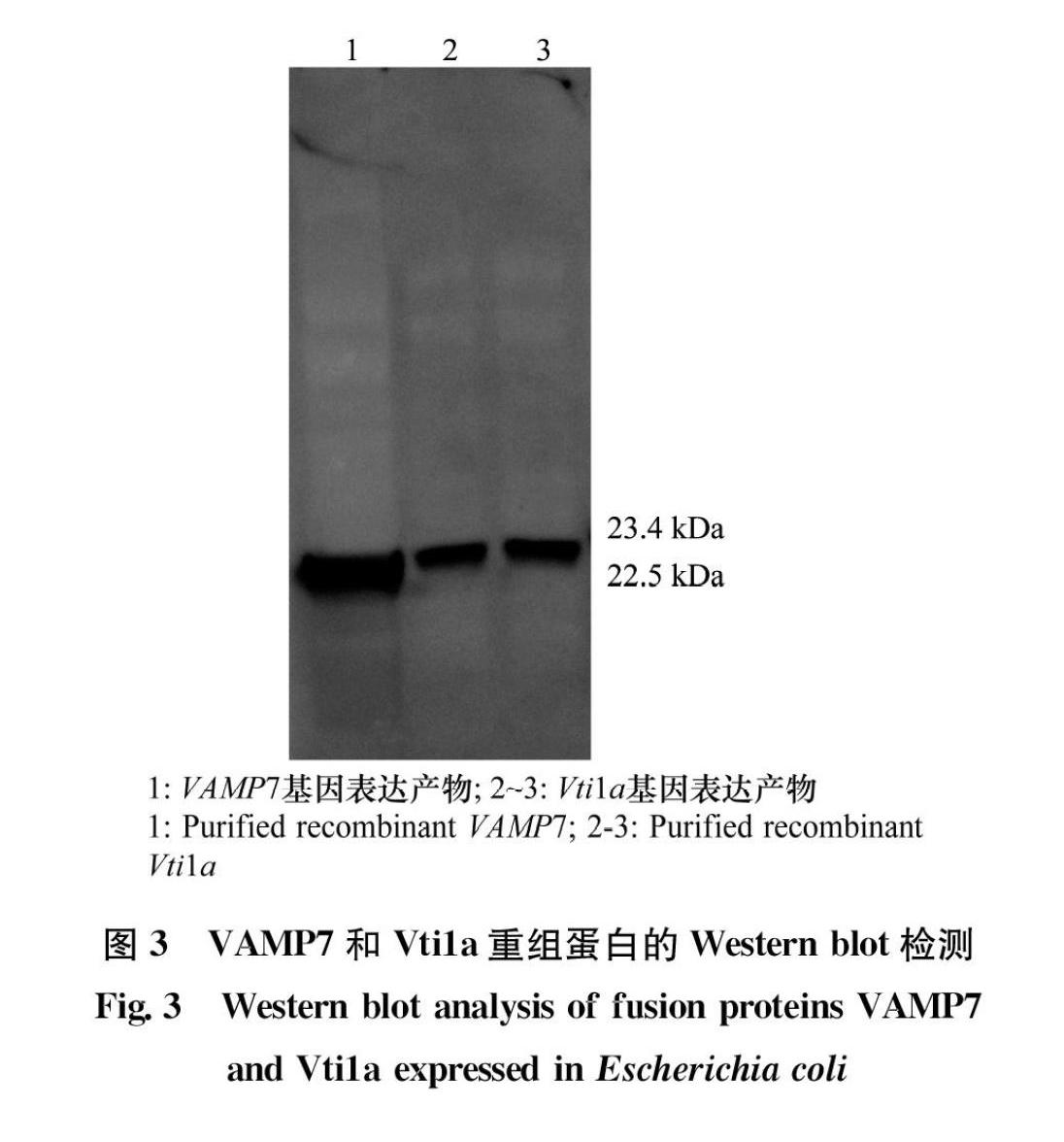
分別將純化后的VAMP7和Vti1a多點免疫注射于新西蘭公兔皮下,制備相應的抗血清。另外,提取白背飛虱的總蛋白,后將總蛋白通過SDSPAGE凝膠電泳轉移至硝酸纖維素膜上,后將其置于含VAMP7和Vti1a一抗抗體(1∶4 000稀釋)的抗體稀釋液中孵育,以檢測抗體特異性。Western blot分析結果顯示,VAMP7和Vti1a的抗體分別與VAMP7和Vti1a的重組蛋白、白背飛虱總蛋白有特異性反應,產生1條22.5 kDa或23.4 kDa的條帶,而與誘導的空載體未產生任何條帶,說明制備的抗體具有特異性(圖5)。
2.5 VAMP7與Vti1a在白背飛虱體內的分布
參照本實驗室已有方法進行免疫熒光檢測[12],對白背飛虱成蟲腸道進行免疫熒光標記。經激光共聚焦顯微鏡觀察發現,制備的抗體均可特異性地標記VAMP7(圖6a,紅色熒光標記)和Vti1a蛋白(圖6b,紅色熒光標記),說明制備的VAMP7和Vti1a抗體能夠用于免疫熒光學分析,VAMP7和Vti1a均定位于白背飛虱的腸道上皮細胞內。
3 討論
本研究利用重組技術將白背飛虱編碼的VAMP7和Vti1a基因重組插入到原核表達載體PET30a,在大腸桿菌中成功表達了這兩種蛋白。可溶性的重組蛋白經Ni2+NTA 親和層析柱純化后,作為抗原成功制備了具有較高特異性的多克隆抗體,為研究白背飛虱中這兩種蛋白的功能奠定了基礎。外源基因在大腸桿菌體內表達容易產生包涵體蛋白,這種狀態的蛋白質不具有生物學活性且不易純化回收。有研究表明,胞質內蛋白質生成速率會影響包涵體的形成,新多肽生成越快,濃度則越高,因高濃度的多肽沒有充足時間進行折疊,導致形成了非結晶、無定形的蛋白質聚集體[13]。為降低蛋白質的合成速度,獲得可溶性蛋白,本研究選擇利用低濃度菌體,在低溫和低轉速條件下誘導。當菌液OD600達0.1時,加入IPTG至終濃度為0.1 mmol/L,在16℃、100 r/min的條件下繼續誘導過夜,進而大大增強了大腸桿菌中VAMP7和Vti1a蛋白的可溶性表達,為最終蛋白質純化和特異性抗體制備奠定基礎。將純化蛋白免疫于新西蘭公兔,制備得到VAMP7和Vti1a抗體。經檢測兩種抗體特異性良好、性價比較高,為下一步研究白背飛虱VAMP7和Vti1a與SRBSDV或其他相關病毒的互作機制打下了基礎。
白背飛虱是目前已知的唯一一種能夠以持久增殖循回的方式傳播SRBSDV的介體昆蟲[23]。在白背飛虱取食過程中,病毒隨汁液進入消化道,侵入腸道上皮細胞并在此復制,然后穿透基底膜后擴散入血液淋巴,繼而到達唾液腺,再隨唾液的分泌完成其傳播過程,在整個循回過程中病毒與其昆蟲介體內的多種蛋白會形成復雜多樣的互作關系[14]。實驗室前期發現白背飛虱的VAMP7和Vti1a分別可與SRBSDV的主要外層衣殼蛋白P10發生互作[5]。在樹突結構細胞中,VAMP7定義了一種新的膜結構,并參與大多數細胞類型常見的運輸途徑[7],由此推測VAMP7和Vti1a可能參與到病毒在介體白背飛虱組織內的移動過程。利用VAMP7和Vti1a重組蛋白的抗體,我們發現VAMP7和Vti1a定位在介體白背飛虱腸道上皮細胞的胞質內,這也是SRBSDV復制和開始擴散的場所。有研究表明,在人體宮頸癌細胞中VAMP7和Vti1a蛋白能夠組合形成一種SNARE復合體[15],VAMP7、Vti1a、syntaxin 5蛋白和 rBet1蛋白共同形成SNARE復合體,能夠幫助囊泡由內質網向高爾基體轉運,在這個過程中VAMP7和Vti1a蛋白能夠自動恢復以備循環使用[16],我們推測,白背飛虱體內的VAMP7和Vti1a蛋白可能組成了一種SNARE復合體共同完成SRBSDV病毒粒體在介體腸道中的轉運,而在此過程中SRBSDV粒體先與轉運囊泡膜上的VAMP7結合,通過VAMP與靶標膜上的Vti1a蛋白特異性識別,將SRBSDV病毒粒體運輸到特定的囊泡。因此,白背飛虱的這兩種蛋白在其高效傳播SRBSDV的過程中可能發揮重要的作用。
參考文獻
[1] 沈君輝,尚金梅,劉光杰. 中國的白背飛虱研究概況[J].中國水稻科學,2003,17(增刊):722.
[2] 周國輝,溫錦君,蔡德江,等. 呼腸孤病毒科斐濟病毒屬一新種:南方水稻黑條矮縮病毒[J]. 科學通報,2008,53(20):25002508.
[3] PU Lingling, XIE Guohua, JI Chuanyan, et al. Transmission characteristics of Southern rice blackstreaked dwarf virus by rice planthoppers [J]. Crop Protection, 2012, 41(6): 7176.
[4] LIU Wenwen, GRAY S M, HUO Yan, et al. Proteomic analysis of interaction between a plant virus and its vector insect reveals new functions of hemipteran cuticular protein [J]. Molecular & Cellular Proteomics, 2015, 14(8): 22292242.
[5] THAN W, QIN Faliang, LIU Wenwen, et al. Analysis of Sogatella furcifera proteome that interact with P10 protein of Southern rice blackstreaked dwarf virus [J/OL]. Scientific Reports, 2016, 6:32445.DOI:10.1038/srep32445.
[6] JAHN R, SCHELLER R H. SNAREsengines for membrane fusion [J]. Nature Reviews Molecular Cell Biology, 2006, 7(9): 631643.
[7] ADVANI R J, YANG Bin, PREKERIS R, et al. VAMP7 mediates vesicular transport from endosomes to lysosomes [J]. Journal of Cell Biology, 1999, 146(4): 765775.
[8] GALLI T, ZAHRAOUI A, VAIDYANATHAN V V, et al. A novel tetanus neurotoxininsensitive vesicleassociated membrane protein in SNARE complexes of the apical plasma membrane of epithelial cells [J]. Molecular Biology of the Cells, 1998, 9(6): 14371448.
[9] RAMIREZ D M O, KHVOTCHEW M, TRAUTERMAN B, et al. Vti1a identifies a vesicle pool that preferentially recycles at rest and maintains spontaneous neurotransmission [J]. Neuron, 2012, 73(1): 121134.
[10]EMPERADORMELERO J, TOONEN R F, VERHAGE M. Vti proteins: beyond endolysosomal trafficking [J]. Neuroscience, 2019, 420:3240.
[11]QIN Faliang, LIU Wenwen, WU Nan, et al. Invasion of midgut epithelial cells by a persistently transmitted virus is mediated by sugar transporter in its insect vector [J/OL]. PLoS Pathogens, 2018, 14(7): e1007201.DOI:10.1371/journal.ppat.1007201.
[12]WANG Yajiao, Mao Qianzhuo, LIU Wenwen, et al. Localization and distribution of wheat dwarf virus in its vector leafhopper, Psammotettix alienus [J]. Phytopathology, 2014, 104(8): 897904.
[13]方敏,黃華. 包涵體蛋白體外復性的研究進展 [J].生物工程學報,2001,17(6):608612.
[14]HOGENHOUT S A, AMMAR E D, WHITFIELD A E, et al. Insect vector interactions with persistently transmitted viruses [J]. Annual Review of Phytopathology, 2008, 46: 327359.
[15]FLOWERDEW S E, BURGOYNE R D. A VAMP7/Vti1a SNARE complex distinguishes a nonconventional traffic route to the cell surface used by KChIP1 and Kv4 potassium channels [J]. Biochemical Journal, 2009, 418(3): 529540.
[16]SIDDIQI S A, SIDDIQI S, MAHAN J, et al. The identification of a novel ER to Golgi SNARE complex used by the prechylomicron transport vesicle [J]. Journal of Biological Chemistry, 2006, 281(30): 2097420982.
(責任編輯:田 喆)

