肝豆狀核變性患者肝臟剪切波速度的變化*
齊 端,唐繪卓,陽 靜,歐陽飛
肝豆狀核變性(hepatolenticular degeneration,HLD)屬常染色體單基因隱性遺傳性疾病,又稱威爾遜病(Wilson’s disease,WD),主要因血清銅藍蛋白減少致使銅代謝合成障礙致病。流行病學調查顯示國內該病較為多見,發病年齡范圍較大,青少年高發,男性發病稍多于女性[1]。HLD患者受累最多的部位為肝臟和腦組織,故多數HLD患者首發癥狀為肝功能異常,與肝組織內銅積蓄有關,而后期病情往往呈進行性進展,最后可能進展為肝纖維化和肝硬化[2]。因此,早期發現HLD患者肝損傷程度,對臨床治療具有較大的指導意義。當HLD患者出現肝功能異常時,超聲聲像圖上可顯示肝臟回聲彌漫性改變[3]。聲輻射力脈沖成像(acoustic radiation force impulse,ARFI)作為近年來推出的一種新型超聲成像新技術,可對肝臟組織彈性或硬度進行無創評估,已被證實在肝纖維化早期診斷中具有較高的特異性和敏感性[4,5]。本研究應用ARFI技術觀察了HLD患者肝臟剪切波速度,現將結果報道如下。
1 資料與方法
1.1 一般資料 2017年6月~2019年6月我院收治的HLD患者38例,男25例,女13例;年齡15~52歲,平均年齡為(28.0±6.3)歲。符合《肝豆狀核變性的診斷與治療指南》診斷標準[6],伴有錐體外系癥狀或體征,肉眼或在裂隙燈下可見角膜色素環,血清銅藍蛋白(ceruloplasmin,CP)低于200 mg/L,或/和血清銅氧化酶活力低于0.2活力單位,24 h尿銅排泄量大于100 μg(1.56 μmol)。排除標準:(1)嚴重的心、肺、腎等重要臟器功能不全;(2)存在精神疾病或精神障礙者;(3)伴有病毒性肝炎、原發性硬化性膽管炎、自身免疫性肝炎等其他肝病;(4)肝內外惡性腫瘤;(5)妊娠或哺乳期婦女。選擇同期我院收治的非HLD肝臟疾病患者49例,男29例,女20例;年齡19~54歲,平均年齡為(28.5±6.4)歲,其中慢性乙型肝炎10例,乙型肝炎肝硬化20例,丙型肝炎肝硬化6例,酒精肝硬化6例,原發性肝癌4例,布加綜合征1例,肝囊腫2例。另選擇同期入院的健康體檢者56例,男32例,女24例;年齡20~55歲,平均年齡為(28.7±6.5)歲。所有健康體檢者均無任何器質性疾病,且未發現任何神經系統癥狀和體征。所有研究對象簽署知情同意書,本研究獲得我院醫學倫理委員會批準。
1.2 超聲檢查 使用德國西門子公司生產的ACUSON-S2000彩色多普勒超聲診斷儀(腹部4 C1凸陣探頭,探頭頻率為2.5~4.6 MHz,機械指數為1.0,系統配備ARFI技術)。所有研究對象于早晨空腹狀態下行常規超聲檢查,掃查肝臟,記錄肝臟實質回聲。患者再取左側臥位,行右肋間掃查,選擇肝右后葉距肝包膜下約1 cm處為ARFI操作區域,盡可能避開肝動靜脈、門靜脈等肝內管道結構。固定探頭,以使探頭垂直于檢查部位。囑研究對象屏住呼吸,啟動ARFI成像系統,對肝臟右后葉行聲觸診組織定量(virtual touch quantification,VTQ)檢測,測量所選區域內的肝臟剪切波速度(shear wave velocity,SWV),于一個屏氣周期內連續測量5次,取其平均值,即為SWV,單位為m/s。
1.3 血清檢測 采用原子吸收光譜法測定血清銅離子(copper ion,Cu2+)水平(北京博暉創新光電技術股份公司生產的BH5100型多通道原子吸收光譜儀和北京東西分析儀器有限公司試劑);采用免疫透射比濁法測定血清CP水平(德國西門子公司生產的BNP型特種蛋白分析儀和深圳市生科源技術有限公司試劑);采用手工法測定血清銅氧化酶(copper oxidase,sCO)水平(上海鈺博生物科技有限公司);采用放射免疫法檢測血清Ⅲ型前膠原(type Ⅲ precollagen,PC-Ⅲ)、層黏蛋白(laminin,LN)、Ⅳ型膠原(collagen type Ⅳ,Ⅳ-C)和透明質酸(hyaluronic acid,HA)水平(美國Bio-Rad公司生產的Bio-Rad550型酶標儀和北京華夏遠洋科技有限公司試劑)。
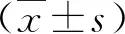
2 結果
2.1 三組血清銅有關指標比較 HLD患者血清Cu2+和CP均顯著低于非HLD或健康人(P<0.05,表1)。
2.2 三組血清肝纖維化指標比較 HLDPC-Ⅲ、Ⅳ-C、LN、HA水平均顯著高于健康人,低于非HLD(P<0.05,表2)。
2.3 HLD患者超聲聲像圖表現 見圖1。
2.4 三組SWV值比較 HLD組SWV值為(1.9±08.2)m/s,非HLD組為(2.2±0.3)m/s,健康人為(1.1±0.2)m/s,差異有統計學意義(F=296.750,P=0.000)。
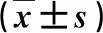
表1 三組血清銅有關指標比較
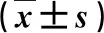
表2 三組血清肝纖維化指標比較

圖1 HLD患者超聲聲像圖表現
3 討論
HLD作為一種常染色體隱性遺傳性疾病,主要因為銅代謝異常,其致病基因ATP7B定位于染色體13q14.3,編碼P型三磷酸腺苷酶銅離子轉運蛋白,參與體內銅轉運代謝[7,8]。AIP7B基因突變致三磷酸腺苷酶功能減弱或喪失,導致血清CP合成減少,引起銅轉運蛋白合成障礙或溶酶體缺陷,促使通過膽管排泄的銅離子發生障礙,腸管吸收的銅顯著增多,而體內溶酶體缺乏,蓄積于體內的銅離子于腦組織、肝臟、角膜等處沉積,誘發一系列臨床癥狀[9]。多數HLD患者首發部位為肝臟病變,主要以肝損害為主,癥狀表現輕重不一。在超聲引導下行肝臟組織學穿刺活檢是診斷該病的金標準,但因淤積的銅在肝內沉積呈不均勻分布,故該病早期肝組織學活檢可能出現假陰性結果[10]。近年來,ARFI技術被廣泛用于臨床,其基本原理為組織受探頭發射的聲脈沖形成機械應力,出現縱向壓縮和橫向振動,而受組織硬度的影響導致組織位移不同。通常,組織硬度越高,位移越大。采用傳統連續聲束追蹤方法量化剪切波傳播速度,用量化速度值代表組織硬度,可間接判斷肝臟硬度,能很好地反映肝臟質地[11,12]。
本研究結果顯示,HLD患者肝臟SWV值顯著高于健康人,但顯著低于非HLD的慢性肝病患者。根據HLD患者二維超聲聲像圖表現的不同,可將其分為脂肪肝型、星光型、樹枝狀、巖層狀和結節狀,這些特征有助于識別特征性的病變[13-15]。
本研究結果顯示,HLD患者血清Cu2+和CP水平顯著低于非HLD患者和健康人,HLD和非HLD患者sCO水平顯著低于健康人,提示HLD患者銅代謝障礙明顯。目前,研究發現HLD的發病與銅代謝障礙有關,血清CP減少是HLD的關鍵誘因,伴有膽管排泄障礙、溶酶體缺陷、腸管內銅吸收增多、金屬巰蛋白基因或調節基因異常等[16]。機體內Cu2+代謝機制是在于ATP7B酶作用下,6個Cu2+與1個CP前體合成CP,并釋放入血,而HLD患者ATP7B酶基因缺失,致使CP合成障礙,肝臟組織中Cu2+大量蓄積,促使血液Cu2+和CP明顯減少[17,18]。sCO表示CP酶的活性,與CP含量比較,其能更好地反映機體內Cu2+代謝的活力狀態,而HLD患者sCO顯著低于正常人,可幫助診斷HLD。
本研究結果顯示,HLD患者血清PC-Ⅲ、Ⅳ-C、LN和HA水平均顯著高于健康人,但低于非HLD患者,提示HLD患者可能已經出現肝纖維化。HLD累及到肝臟時,最終會出現肝纖維化[18,19]。臨床上,應用血清PC-Ⅲ、Ⅳ-C、LN和HA水平變化協助診斷肝纖維化,其中PC-Ⅲ反映肝纖維化積蓄的敏感性較高,而Ⅳ-C和LN與肝組織匯管區和小葉內炎癥明顯相關,且與肝纖維化程度一致。有研究表明,慢性乙型肝炎進展至肝纖維化階段,采用ARFI技術測量肝臟SWV值,發現肝臟SWV值與血清PC-Ⅲ、Ⅳ-C、LN和HA均呈正相關,證實肝臟SWV值能反映慢性乙型肝炎患者肝纖維化程度[20]。本研究發現,HLD患者血清PC-Ⅲ、Ⅳ-C、LN和HA水平低于包括慢性乙型肝炎在內的普通慢性肝病患者,預示本組HLD患者肝纖維化程度可能較輕。因肝細胞內銅蓄積量不斷增加,肝細胞逐漸變性壞死,纖維組織增生,肝硬化進程才進展。

