膽總管結扎誘導大鼠肝肺綜合征模型的建立初步研究*
榮海芳,王立國
肝肺綜合征(hepatopulmonmy syndrome,HPS)是指在慢性肝病或門靜脈高壓等基礎上形成的以低氧血癥為主要臨床特征的一種病癥[1],是終末期肝硬化最嚴重的并發癥,成人終末期肝病HPS患病率為4%~47%[2],發病機制未完全闡明,治療效果差,病死率高。目前,多數研究認為多種血管活性物質和細胞因子參與了肺微血管內皮細胞的增殖和微血管擴張,并促進了HPS的發生[3]。有關HPS的臨床研究較少,多數以動物實驗研究為主。因此,良好的動物模型的建立尤為重要。一個理想的動物模型應具備模型形成率高、動物死亡率低、重復性好、方法簡單且與人類疾病特征相似等特點。HPS模型的建立應該首先建立肝硬化動物模型。目前,對于肝硬化模型的建立主要包括四氯化碳、化學致癌物、乙醇、血吸蟲感染和手術等,各有利弊。由于膽汁淤積及膽汁酸的毒性作用,肝細胞可出現進行性損傷,最終可發展為肝硬化甚至肝衰竭,膽汁淤積性肝損傷是肝纖維化和肝硬化重要的危險因素[4,5]。大量動物實驗證明,通過膽總管結扎術式可誘導肝硬化形成,而且只有膽總管結扎術能形成HPS模型。因此,建立膽總管結扎術誘導HPS形成的動物模型具有很高的研究價值。本文采用膽總管結扎術誘導大鼠HPS模型,詳細介紹了制備過程,并通過血液、超聲和組織病理學檢查等多方面進行模型驗證,發現該術式具有手術時間短、切口小、造模周期短、穩定性高、不易自發逆轉等優勢,可作為HPS基礎研究的模型應用。
1 材料與方法
1.1 動物、儀器和試劑 SD大鼠40只,體質量在180~250 g之間,購自青島派特福德白鼠養殖專業合作社[實驗動物生產許可證編號:SCXK(魯)20130001,實驗動物使用許可證編號:SYXK(黑)2011007];美國 RADISM ETER 公司生產的 ABL700血氣分析儀;使用加拿大Sonix OP超聲診斷系統;上海研卉生物科技有限公司提供的檢測血一氧化氮(nitric oxide,NO)試劑盒;檢測肝纖維化指標的ELISA試劑盒購自上海研吉生物科技有限公司。
1.2 動物模型的制備 采用隨機數字表法將大鼠分為膽總管結扎組30只和假手術組10只。術前禁食8 h,在動物實驗室手術操作臺上先用4%水合氯醛1 ml/100 g腹腔內注射麻醉,固定(圖1)。腹部備皮、消毒。沿腹白線開腹,在劍突下1 cm處行縱行小切口,于胃竇尋找十二指腸降段,分離膽總管(圖2)。用4-0線在膽總管末端雙線結扎(圖3),清理手術器械后逐層關腹;在對照組,不結扎膽總管,其他步驟同前。術后,待動物蘇醒后分籠飼養,注意保溫和局部換藥。于術后1 w、2 w、4 w、5 w和6 w各處死2只實驗組和對照組大鼠,觀察肝肺和膽總管組織結構。經左心室采血2 ml,以5000 r/m室溫離心15 min,取上層血清。
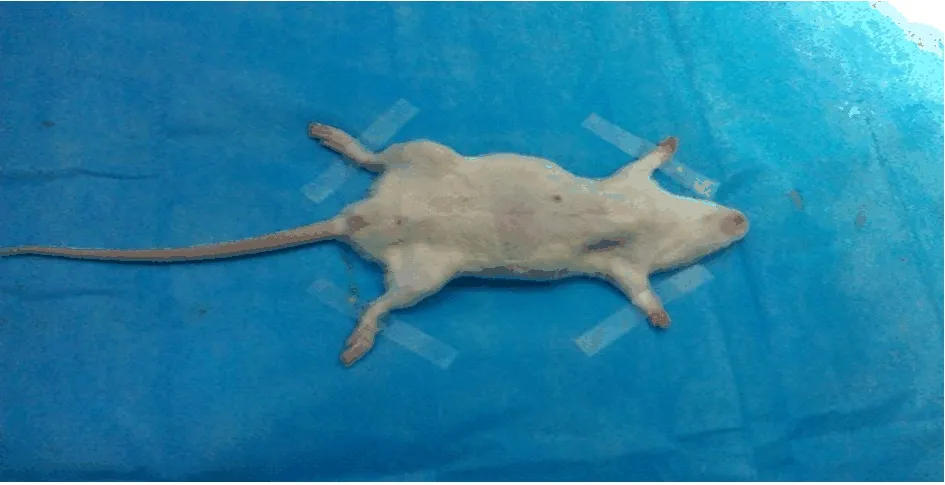
圖1 動物模型制備 固定手術操作臺
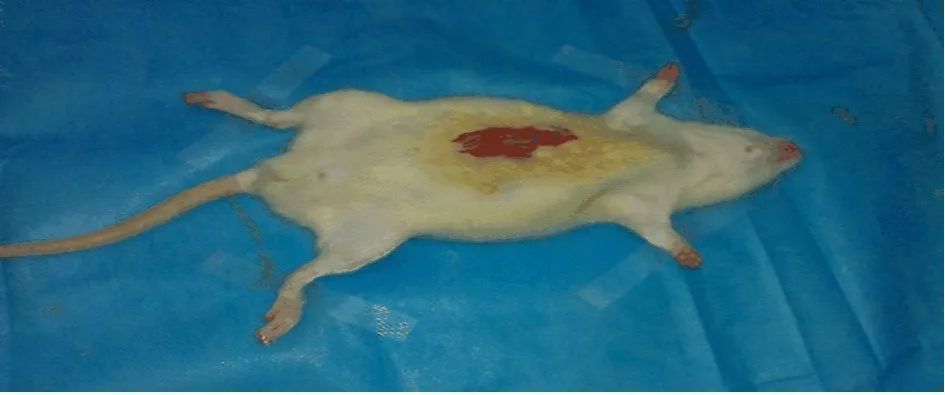
圖2 動物模型制備 尋找并分離膽總管
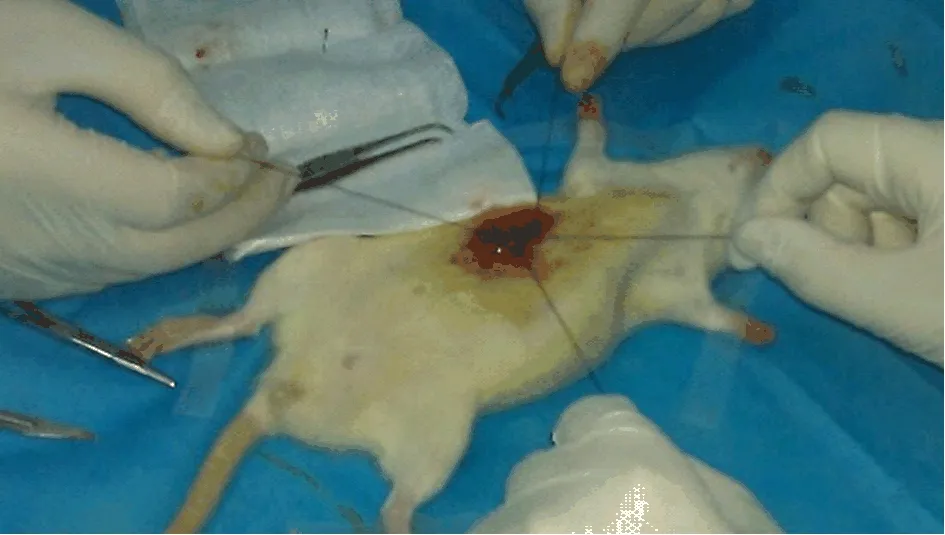
圖3 動物模型制備 雙線結扎膽總管
1.3血清檢測 使用全自動生化分析儀檢測肝功能指標;采用ELISA法測定血清透明質酸(hyaluronic acid,HA)、層粘連蛋白 (laminin,LN)、III型前膠原肽(procollagen Ⅲ N-terminal peptide ,PCⅢ)和IV型膠原(collagen type Ⅳ,Ⅳ-C)水平。
1.4 血氣分析和血漿NO水平測定 使用血氣分析儀測定PaO2、PaCO2和pH;采用硝酸還原酶法測定血清NO含量。
1.5 腹部超聲檢查 使用超聲診斷儀檢測肝臟表面形態和膽總管寬度。
1.6 病理學檢查 取大鼠肝臟和肺臟組織各約1 cm3,常規脫水、包埋、切片,行HE染色,光鏡下觀察。
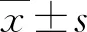
2 結果
2.1 大鼠HPS動物模型建立成功 在膽總管結扎術后4~6 w,動物形成肝硬化,部分并發HPS。在術后3 d,對照組動物活動量基本恢復,而實驗組大鼠活動遲緩,并逐漸出現毛發失去光澤、皮膚和尿液變黃(圖4)、體質量下降。至2 w后,這種現象更加顯著。術后1、2、3、5、6 w分別處死兩組大鼠各2只,發現實驗組動物肝臟逐漸增大,質地變硬,至4 w時膽總管擴張、增寬,表面見纖維條索并出現顆粒樣結節(圖5)。在6 w后,大鼠活動后氣促、呼吸困難,部分大鼠出現腹腔積液(圖6);10只對照組大鼠均無死亡,而術后3 d、7 d和10 d,30只實驗組大鼠死亡11只(27.5%)。死亡原因包括麻醉意外、腹腔出血、膽管破裂、急性肝衰竭。

圖4 術后1w大鼠精神萎靡,活動遲緩,尿色加深
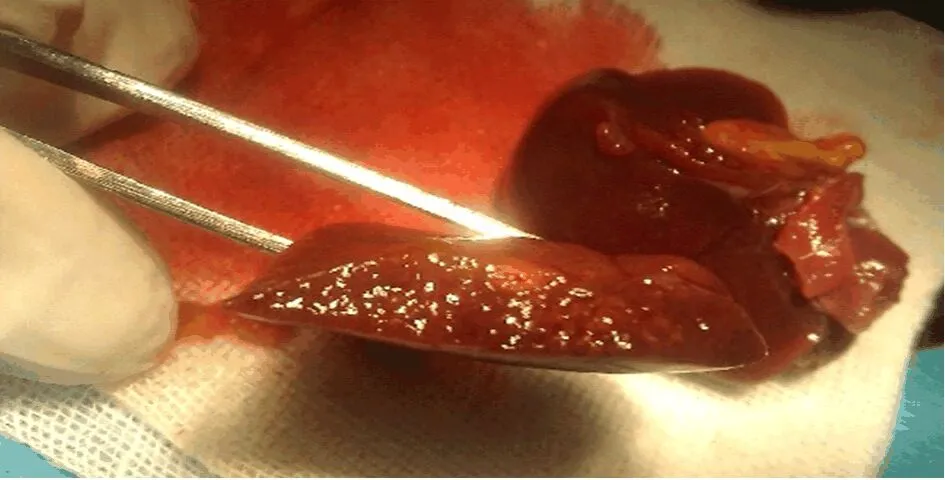
圖5 術后5 w肝臟表面粗糙不平,并見顆粒樣結節

圖6 術后4周見腹腔積液
2.2 兩組肝功能和肝纖維化指標比較 實驗組大鼠隨膽管結扎時間的延長,血清TBIL逐漸升高,術后2 w達高峰,以后膽紅素仍緩慢升高。血清AST和ALT逐漸升高,第3 d達峰值,隨后稍有下降,2 w后平穩,至4~6 w呈下降趨勢。術后第1 d血清HA、LN、PCⅢ和Ⅳ-C水平逐漸升高,至4 w達到峰值,以后逐漸平穩;對照組動物血清肝功能指標無顯著變化。
2.3 大鼠HPS建模成功 在術后1 w、2 w、4 w和6 w,動態觀察血氣分析結果表明,實驗組動物動脈血PaO2顯著低于對照組,而PaCO2逐漸升高,血漿NO水平在術后1 w逐漸升高,至4 w達到峰值,顯著高于對照組(P<0.05),差異有統計學意義(P<0.05,表1)。
表1 各組動脈血氣分析和血漿NO水平比較
2.4 腹部超聲檢查情況 腹部超聲檢查發現實驗組術后1 w動物肝臟回聲增粗,膽總管輕度擴張;在術后2 w,肝臟被膜不平整,膽總管顯著增粗;在術后4~6 w,肝臟被膜不平整,部分表面可見小結節形成,膽總管顯著增寬,并可見腹腔積液。
2.5 組織病理學表現 在4 w后,可見實驗組動物肝組織炎癥細胞浸潤,纖維條索和部分假小葉形成(圖7);在6 w后,肺臟組織見肺微血管顯著擴張(圖8)。
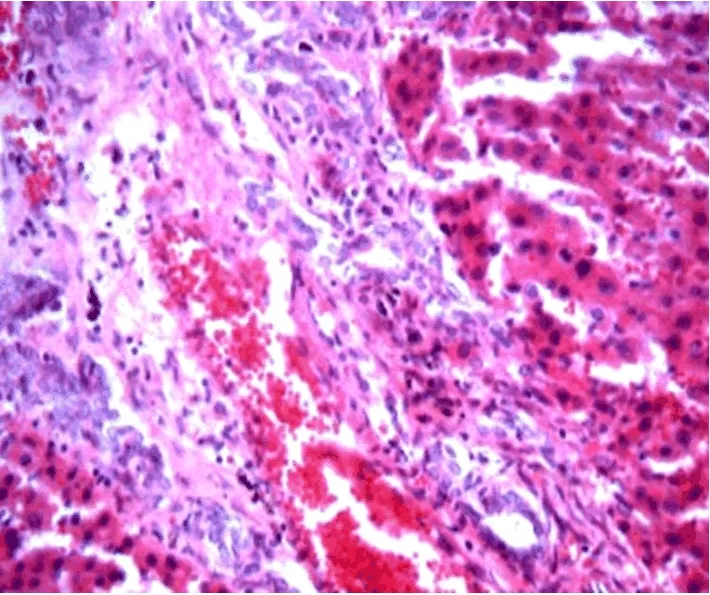
圖7 肝組織病理學變化 在術后4 w,實驗組動物肝組織炎細胞浸潤,肝細胞排列紊亂,結締組織增生,部分假小葉形成(HE,400×)
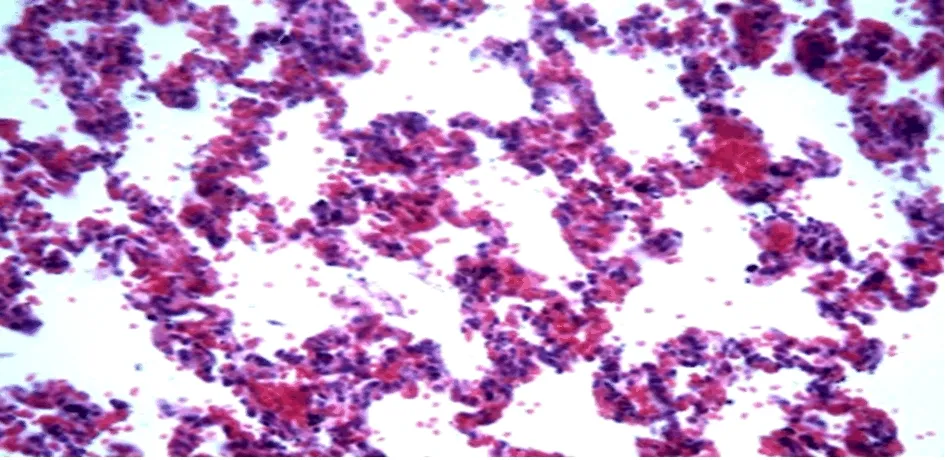
圖8 肺組織病理學變化 在術后6 w,肺組織微血管擴張,可見少量紅細胞位于肺泡壁及其腔內(HE,400×)
3 討論
HPS是終末期肝硬化最嚴重的并發癥,其病因目前不清,治療效果差,病死率高。目前,HPS的發病機制已成為國內外研究的熱點。對于HPS的發病機制研究主要集中在動物實驗上,因此一個良好的動物模型的建立顯得至關重要。HPS必將要經歷肝硬化階段,目前對于肝硬化動物模型的建立包括四氯化碳、二乙基亞硝胺等化學毒物[6]、化學致癌物、血吸蟲、手術等,還有報道將不同濃度的四氯化碳注射聯合飲用乙醇誘導大鼠肝肺綜合征模型,可顯著提高肝硬化模型的造模成功率[7],但真正能誘導形成HPS的只有膽總管結扎術[8]。
自1872年首次應用膽總管手術建立動物模型以來,一直被推舉為研究進行性肝損傷的經典模型。憑借簡單、快速、有效等優點,廣泛用于進行性肝病的多方面研究[9,10]。膽總管結扎術也是HPS模型誘導的經典術式,并被廣泛應用于實驗研究[11],具有造模周期短、穩定率好等特點。結扎方法包括單純結扎肝外膽管法、膽管結扎后切斷法和逆行性注入N-丁基-2-氰基丙烯酸鹽法三種方法[12-14]。我們的研究認為,一般大鼠在膽總管結扎術后膽總管進行性擴張,在2周后形成肝纖維化,4周形成肝硬化,而在6周左右形成HPS模型,大鼠死亡率為27.5%,死亡原因有麻醉意外、腹腔出血、膽管破裂、急性肝衰竭等。HPS模型的建立對于無動物實驗基礎的研究者來說較為困難,需不斷地摸索。我們認為需注意以下幾點:(1)需有備用大鼠,以防大鼠死亡較多,影響實驗進程;(2)大鼠難抓,我們用礦泉水瓶自制了捕鼠器,可以很好地解決這個問題;(3)多主張腹腔麻醉,以水合氯醛為首選,經濟易得且效果好;(4)在膽總管結扎后,不建議離斷膽總管,否則容易引起膽管破裂后腹膜炎,影響觀察,或切斷膽管后出現嚴重的膽汁淤積,引起急性肝壞死,動物死亡率高[15]。因此,只建議用手術縫線緊密雙重結扎即可,膽管再通發生率非常低;(5)術后第1天非常重要,大鼠很容易死亡,需加強保暖和觀察。
在膽總管結扎術后,隨著時間的延長,實驗組大鼠逐漸出現一系列與膽汁淤積性肝硬化患者相似的癥狀、體征和血清學改變。我們的研究發現大鼠出現精神萎靡、行動遲緩、尿色變黃、毛發黃染無光澤,在4周后部分實驗組大鼠出現腹腔積液。血清膽紅素和轉氨酶進行性升高,在2周后達到高峰,在4周后趨于平穩,血清肝纖維化指標逐漸升高,證明膽總管結扎引起了進行性肝臟損害,與既往文獻報道相一致[16-18]。
大鼠HPS建模成功的重要指標包括動脈血氣分析提示低氧血癥,血漿NO水平升高[19],組織病理學見肺微血管擴張。其中低氧血癥是重要的標志性指標,但低氧血癥的基礎是肺微血管擴張[20],而各種原因引起的NO增多是其發生發展的重要原因[21,22]。我們的實驗也證實了這一點。在膽總管結石術后4周,肝臟組織病理學表現為炎細胞浸潤,肝細胞排列紊亂、假小葉形成,肺血管內皮細胞擴張,證明肝硬化形成。在6周時,大鼠行動遲緩,呼吸困難,動脈血氧分壓顯著下降,二氧化碳分壓升高,血漿NO水平進行性升高,與對照組相比,差異具有統計學意義(P<0.05)。同時,我們的實驗還表明,在HPS模型形成過程中,彩色多普勒超聲同樣是一個重要的檢測手段,具有微創、準確、快速、方便等特點。它可動態觀察大鼠肝臟和膽總管的變化情況。

