替諾福韋酯與替比夫定阻斷乙型肝炎病毒攜帶孕婦病毒母嬰傳播的療效和安全性比較*
韓白乙拉,索淑一,魏冬梅,趙志峰,王炳元
母嬰傳播是乙型肝炎病毒(HBV)最主要的傳播途徑,約有30%~50%慢性HBV攜帶者經此途徑感染[1]。雖然應用乙肝疫苗和乙型肝炎免疫球蛋白聯合預防方案能夠取得明顯的阻斷傳播的效果,但仍約有5%~10%發生母嬰阻斷失敗[1,2]。目前研究認為,孕婦分娩前血液HBV DNA載量是影響母嬰阻斷效果以及是否發生嬰兒感染的主要因素[3]。對于高HBV DNA載量的孕婦,采取孕期抗病毒治療是降低HBV母嬰傳播的關鍵[1]。在妊娠中、晚期,給予替諾福韋酯(tenofovir disoproxil fumarate,TDF)或替比夫定(telbivudine,LdT)治療以降低血清HBV DNA水平,從源頭上減少HBV傳播和流行,對實現2030年前消滅乙型肝炎的目標意義重大而深遠[2]。近年來,國內已經有在該領域的部分臨床研究,并取得了比較滿意的效果[4,5]。本研究從2016年開始應用抗病毒藥物結合高效價乙型肝炎免疫球蛋白和乙肝疫苗進行母嬰阻斷,并對77例HBV攜帶孕婦及其所生的嬰兒進行了跟蹤隨訪觀察,現將結果分析、報道如下。
1 資料與方法
1.1 一般資料 2016年5月~2019年5月內蒙古自治區通遼市傳染病醫院門診孕檢和住院分娩的HBV攜帶孕婦89例,年齡為20~40歲,平均年齡為(28.01±9.11)歲。妊娠24~28周,血清HBV DNA≥2×106IU/ml。排除:(1)活動性肝炎,或合并HIV、HAV、HCV、HDV和HEV感染;(2)既往妊娠有流產史、先天性新生兒畸形或超聲提示胎兒畸形;(3)既往有抗病毒治療史;(4)既往有腎功能障礙、肝硬化或肝功能失代償、血清ALT升高;(5)應用過腎毒性藥物、類固醇類、細胞毒性藥物、非甾體類抗炎藥物或免疫調節劑等。本研究經我院醫學倫理委員會審核通過,孕婦和(或)家屬同意并簽署知情同意書。
1.2 治療方法 在妊娠24~28周時,將孕婦分為兩組,分別給予TDF(葛蘭素史克有限公司)300 mg,或LdT(北京諾華制藥有限公司)600 mg口服,1次/d,直至嬰兒分娩。在新生兒出生后12 h內,給予高價乙型肝炎免疫球蛋白(新鄉華蘭生物工程股份有限公司)200 u肌肉注射和重組酵母乙肝疫苗(大連漢信生物制藥有限公司)20μg,采取0、1、6(月)程序肌肉注射。
1.3 檢測方法 采用磁微粒化學發光法檢測血清HBV標志物(鄭州安圖生物工程有限公司);采用實時熒光定量PCR法檢測血清HBV DNA(廈門安普利生物工程有限公司)。
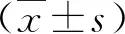
2 結果
2.1 兩組血清HBV DNA和ALT水平變化情況 在本組89例入選者中,最終有77例HBV攜帶孕婦完成了本研究,其中TDF治療組43例,LdT治療組34例。兩組用藥后至分娩時血清HBV DNA水平均顯著低于治療前,TDF組由(7.4±1.2)lg copies/mL降低至(3.6±1.1)lg copies/mL(P<0.05),LdT組由(7.3±1.1)lg copies/mL降低至(4.1±1.2)lg copies/mL(P<0.05),但治療后兩組之間血清HBV DNA水平比較無顯著性差異(P>0.05);治療前后兩組血清ALT水平的變化也無顯著性差異,停藥后部分產婦血清ALT輕度升高,但在3個月后大部分降至正常。
2.2 兩組嬰兒血清HBV標記物變化比較 出生時,兩組嬰兒各有1例血清HBsAg陽性,但HBV DNA均陰性(資料未列出);在出生7個月時,兩組血清HBsAg均陰性,血清HBsAb均轉為陽性(表1),而且效價較高(未列出)。

表1 兩組嬰兒血清HBV M陽性率(%)比較
2.3 兩組嬰兒人體學指標變化的比較 在出生時,兩組新生兒體質量、身高和頭圍等均在正常范圍內,無顯著性差異(P>0.05),兩組均未出現先天性畸形;在出生后7個月時,嬰兒發育良好,兩組體質量、身高和頭圍變化仍無顯著性差異(P>0.05,表2)。
2.4 妊娠期間抗病毒治療的安全性情況 自開始抗病毒治療至分娩后,兩組孕婦血肌酐、血磷、血肌酸激酶水平均在正常范圍內,未出現其他明顯的不良反應。
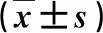
表2 兩組嬰兒人體指標比較
3 討論
普遍的疫苗接種計劃和可能有效的抗病毒治療使一些HBV高度流行的國家或地區的乙型肝炎流行率正在下降[1,6],但母嬰傳播引起的慢性HBV感染仍然是世界性的重大公共衛生問題,一半以上的現有的乙型肝炎患者是通過母嬰垂直被感染的[7]。對HBsAg陽性母親所生新生兒,應用乙肝疫苗聯合乙型肝炎免疫球蛋白能夠顯著降低母嬰病毒傳播的發生率[6],但在高危人群中還是不可能完全杜絕HBV感染[8],仍有約9%新生兒感染HBV,尤其是HBeAg陽性的母親[9]。在我國HBsAg和HBeAg陽性母親中,母嬰傳播的發生率高達7.1%[10]。
研究發現,隨著母親攜帶HBV病毒量的增加HBV感染率逐步升高,母親血清HBV DNA為1×107~9lg copies/L時,HBV感染的預測發生率分別為6.6%、14.6%和27.7%[3]。血清HBV DNA載量越高,宮內感染發生率越高[11]。目前,我國推行的乙型肝炎免疫球蛋白和乙肝疫苗計劃接種能有效地實現母嬰阻斷,但高載量HBV孕婦所生新生兒仍有5%~10%預防接種失敗,導致HBV母嬰垂直傳播[1]。
母嬰傳播主要有三種途徑,即子宮內、分娩期間和產后與母親的密切接觸。在子宮內和分娩期間傳播是最常見的途徑,這也解釋了新生兒出生后免疫接種失敗率高的原因[10]。詳細的產前常規檢查可減少新生兒持續性HBV感染的機會[12]。對于HBV陽性的孕婦,采取孕期母親接受抗病毒治療和產后新生兒免疫接種是阻斷母嬰傳播的主要措施[10]。通過網絡分析研究發現,與單純使用乙型肝炎免疫球蛋白和乙肝疫苗相比,抗病毒治療可降低母嬰病毒傳播發生率。抗病毒藥物阻斷HBV母嬰傳播是從源頭上預防和控制乙型肝炎流行的關鍵措施之一,積極開展HBV母嬰傳播的阻斷研究具有非常重要的意義[4]。本研究根據孕婦自愿選擇藥物的原則,在孕24~28周開始選用TDF或LdT進行母嬰阻斷治療,到分娩時,兩組血清HBV DNA水平均已顯著下降。
任何抗病毒藥物都比安慰劑更有效地阻斷了HBV的垂直傳播[2,13-15]。拉米夫定、LdT和TDF對HBV母嬰阻斷效果相同[16],雖然沒有一種藥物表現出不同于其他藥物的顯著療效,但都不會增加母體或胎兒的不良結局[17]。即使拉米夫定抗病毒治療也可有效降低HBV攜帶孕婦血清HBV DNA水平[4],但亞洲國家LdT的使用頻率似乎高于TDF[13]。首選TDF或LdT作為替代藥物是目前的趨勢[9]。本研究也觀察到同樣的趨勢,TDF組和LdT組血清HBV DNA水平由治療前到分娩時均大幅降低。兩組母嬰病毒傳播阻斷的成功率均達到100%,與國內學者的研究結果大致相同[18]。
關于抗病毒的孕齡,國內外并不一致。早于妊娠20周左右應用也沒有明顯的安全隱患[16]。在妊娠24周給予攜帶HBV的孕婦LdT治療可阻斷HBV母嬰傳播,對嬰兒也無不良影響[5,9]。一般,國內選擇孕24~30周為多[4,5]。有關母嬰阻斷對新生兒的影響也有一些研究,結果差異較大,還有一些問題需要澄清[2,6,9,10,14,15]。本研究兩組新生兒出生時各有一例血清HBsAg陽性,即刻HBV DNA檢測均為陰性,但在7個月齡時,血清HBsAg又消失了,個中原因不清楚。血清HBsAb陽性率達到100%。
關于抗病毒藥物的停藥時機,考慮到母乳喂養的安全性,目前無統一的標準,治療可以在分娩后立即停止,也可以在分娩后12周內停止[9,11]。根據美國和歐洲肝病學會發布的指南,母乳喂養不是禁忌,亞太肝病協會發布的指南則不鼓勵在抗病毒治療期間母乳喂養[9]。所以,國內大多采取分娩后即刻停止抗病毒治療[11,13,19]。本研究在分娩后即刻停止抗病毒治療,但4周后兩組產婦血清HBV DNA恢復到抗病毒治療前的水平,部分產婦血清ALT還出現一過性輕度升高,各有一例繼續給予抗病毒治療后ALT逐漸恢復正常。有人認為,妊娠期ALT水平是產后肝功能異常的影響因素,而與是否應用抗病毒藥物無關[19]。停藥對母親未來健康的影響以及何時再啟動抗病毒治療,仍然是今后關注的問題[11]。
綜上所述,除了產后給新生兒應用乙肝疫苗和乙型肝炎免疫球蛋白預防接種外,在妊娠中晚期給予TDF或LdT抗病毒治療已成為普遍接受的降低HBV母嬰傳播的方法,但治療方法還需進一步規范和優化,即治療的時機、藥物選擇、療效監測和停藥時機等都需要進一步研究明確。應持續密切關注母兒和胎兒/嬰兒的安全[16,20]。本研究還存在一定的局限性,研究的樣本量偏少,治療開始和停止的時間沒有設計比較,對母親和嬰兒的隨訪時間都較短,母親在停止治療后是否會引起肝功能異常,需要進一步觀察。抗病毒與聯合免疫接種的效果也需要與單純的免疫接種比較,這些都有待進一步擴大樣本和深入研究。

