慢性乙型肝炎合并非酒精性脂肪性肝病患者血清反應性氧化物和脂聯素水平變化*
王松姣,張宇晨,龔國富,王宇學
乙型肝炎病毒(hepatitis B virus, HBV)是慢性乙型肝炎(chronic hepatitis B,CHB)的病原體,人群普遍易感。病毒主要通過母嬰傳播、血傳播和性傳播等方式傳播。隨著病情發展可進展為肝纖維化,繼而發展為肝硬化或肝癌[1]。非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)或代謝相關性脂肪性肝病(MAFLD)是一種與肥胖和糖脂代謝紊亂等有關的代謝性疾病,以肝細胞內脂肪貯積和細胞變性為病理學特征[2]。根據NAFLD患者病情是否伴有炎癥反應和肝纖維化,可以將其分為單純性脂肪肝(nonalcoholic simple fatty liver,NAFL)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)和NASH相關性肝硬化[3]。近年來研究顯示[4],HBV感染與NAFLD常合并發生,兩者可相互影響,共同促進病情進展,引起肝纖維化病變[5]。目前,HBV感染與NAFLD相互作用的具體機制尚不清楚,可能與糖脂代謝紊亂、脂質過氧化和大量的炎癥介質作用等有關[6]。反應性氧化物(reactive oxygen species,ROS)是反映機體氧化應激水平的最主要的指標之一,可引起脂質過氧化,與NASH及肝纖維化的發生密切相關[7]。脂聯素(adiponectin,ADPN)是由脂肪細胞分泌的一種蛋白質,與機體的糖脂代謝、氧化應激、炎癥反應和肝纖維化等病理生理過程均密切相關[8]。本研究檢測了CHB合并NAFLD患者血清ROS和ADPN水平,分析了它們水平的變化及其臨床意義,現報道如下。
1 資料與方法
1.1 一般資料 2018年1月~2020年1月我院收治的CHB合并NAFLD患者97例,男性57例,女性40例;年齡35~60歲,平均年齡為(44.2±9.7)歲;體質指數(body mass index,BMI)為23~30 kg/m2,平均為(27.2±3.4)kg/m2;合并糖尿病4例,高血壓16例,高脂血癥34例。診斷依據中華醫學會于2010年制訂的《慢性乙型肝炎防治指南》[9]和《非酒精性脂肪性肝病診療指南》[10]的標準。排除標準:合并酒精性肝病、其它類型的病毒性肝炎、藥物性肝損傷等其他因素引起的肝損傷;合并惡性腫瘤。患者給出知情同意書,本研究經我院醫學倫理委員會審核通過。另選CHB患者97例,男性62例,女性35例;年齡35~60歲,平均年齡為(43.5±9.2)歲;BMI為20~25 kg/m2,平均為(23.9±3.2)kg/m2。
1.2 指標檢測 使用7060型全自動生化分析儀檢測血清丙氨酸氨基轉移酶(alanine aminotransferase,ALT)、天門冬氨酸氨基轉移酶(aspartate aminotransferase,AST)、谷氨酰轉肽酶(gamma-glutamyl transpeptidase,GGT)、空腹血糖(fasting plasma glucose,FPG)、總膽固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白(low density lipoprotein,LDL-C)和高密度脂蛋白(high-density lipoprotein,HDL-C,日本日立公司);采用ELISA法檢測血清ROS、ADPN和腫瘤壞死因子-α(tumor necrosis factor,TNF-α)水平(上海藍基生物科技有限公司);采用NAFLD肝纖維化評分(hepatic fibrosis score of NAFLD,NFS)系統[11]評估肝纖維化程度,NFS=-1.675+0.037×年齡+0.094×BMI kg/m2+1.13×空腹血糖受損或糖尿病(是=1,否=0)+0.99×AST(U/L)/ALT(U/L)-0.013×血小板計數(×109/L)-0.66×白蛋白(g/L)。
1.3 FibroScan檢查 使用FibroScan-502型瞬時彈性掃描儀(法國Echosens公司)行肝硬度檢測(liver stiffness measurement,LSM)和受控衰減參數(controlled attenuation parameter,CAP),選擇右側腋前線至腋中線第7~9肋間,進行10次有效測量,取均值。
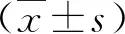
2 結果
2.1 兩組肝功能指標比較 CHB合并NAFLD患者血清GGT水平顯著高于CHB患者(P<0.05,表1)。
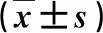
表1 兩組肝功能指標的比較
2.2 兩組血糖和血脂水平比較 CHB合并NAFLD患者空腹血糖和TC、TG和LDL-C水平顯著高于CHB患者(P<0.05,表2),而HDL-C水平顯著低于CHB患者(P<0.05,表2)。
2.3 兩組血清ROS、ADPN和TNF-α水平比較 CHB合并NAFLD患者血清ROS和TNF-α水平顯著高于CHB患者(P<0.05,表3),而血清ADPN水平顯著低于CHB患者(P<0.05,表3)。
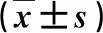
表2 兩組血糖和血脂水平的比較
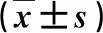
表3 兩組血清指標比較
2.4 兩組肝纖維化和脂肪變指標比較 CHB合并NAFLD患者NFS評分、LMS和CAP顯著高于CHB患者(P<0.05,表4)。
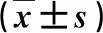
表4 兩組肝纖維化和脂肪變指標的比較
3 討論
約有15%~40%HBV感染者可發展為肝硬化,甚至肝癌[12]。研究顯示[13,14],合并NAFLD可加重CHB患者的肝損傷,加快肝組織纖維化進展,但其相互作用的機制尚未明確。因此,本研究比較了單純CHB患者與CHB合并NAFLD患者肝功能、糖脂代謝、脂質過氧化、炎癥介質水平的差異,以期分析CHB合并NAFLD進展的機制。本研究中,CHB合并NAFLD患者血清GGT和TG水平均明顯升高,而HDL-C水平明顯降低,提示CHB合并NAFLD可以加重患者的肝功能損傷,其作用可能與體內異常升高的血脂水平有關。目前,大部分研究認為NAFLD的發生與“二次打擊”學說有關,由各種原因導致的胰島素抵抗(insulin resistance,IR)可以引起體內脂質代謝異常,導致肝細胞內TG大量蓄積,大量的游離脂肪酸氧化產生過量的ROS,引起線粒體功能損傷,脂質代謝障礙,細胞內氧化/抗氧化水平失衡,肝細胞的炎癥反應活動劇烈,誘導肝組織細胞壞死[15,16]。CHB患者肝脂肪變性與病毒載量無關,而與患者的BMI和血脂水平升高有關[17]。肝脂肪變性是影響CHB患者合并NAFLD發生的獨立危險因素[18]。
本研究中,CHB合并NAFLD患者血清ROS和TNF-α水平均明顯高于CHB患者,而ADPN水平明顯低于CHB患者。TNF-α是機體的炎癥因子,可以激活炎癥信號通路,誘導多種炎癥介質的釋放,參與肝炎、肝纖維化等多種疾病的發生發展。ROS是肝細胞內過量游離脂肪酸氧化過程中產生的一系列活性氧簇,可以損傷線粒體功能,影響游離脂肪酸代謝,過多的游離脂肪酸還可以直接激活炎癥信號通路,增加TNF-α等炎癥介質的合成和釋放,加重肝組織炎癥反應,誘導肝纖維化的形成[19],提示ROS可能通過調節脂質過氧化和炎癥信號通路,推進CHB合并NAFLD的病情進展。ADPN是一種由脂肪細胞分泌的脂肪細胞因子,參與調節胰島素信號通路,影響IR、糖脂代謝等多種代謝性疾病的發生,還可以抑制炎性介質的生成,發揮抗炎作用,在肥胖、糖尿病和NAFLD的發生發展過程中發揮重要作用[20]。
肝纖維化是CHB合并NAFLD患者疾病進展為肝硬化的病理學基礎,與肝細胞內大量的炎癥介質作用有關[21]。NFS評分是一種非侵入性的肝纖維化評分系統,通過評估患者的年齡、體質量、肝功能、糖代謝等,來評估患者的肝纖維化風險,目前已廣泛用于NAFLD患者的肝纖維化評估[22]。因此,本研究結合NFS評分和影像學檢查來共同評估CHB合并NAFLD患者的肝纖維化程度。本研究中,CHB合并NAFLD患者NFS評分、CAP和LSM水平顯著高于CHB患者。CAP是臨床常用的評估肝脂肪變程度的指標,LSM是近年來常用的評估肝纖維化的指標[23]。CHB合并NAFLD患者肝脂肪變程度和肝纖維化程度明顯加重,臨床有可能聯合應用抗氧化、抗炎等藥物治療,保護肝功能損傷。研究顯示[24,25],ROS與CHB合并NAFLD患者肝纖維化、脂肪變程度和炎癥反應程度有關,低ADPN血癥是影響NAFLD發生的獨立危險因素,提示ROS和ADPN水平變化可能通過調節機體的糖脂代謝和炎癥信號通路,參與CHB合并NAFLD的發生發展。臨床可根據患者血清ROS和ADPN水平的變化評估CHB患者發生NAFLD的可能,指導臨床處置。
綜上所述,CHB合并NAFLD患者血糖、血脂、ROS水平較CHB患者明顯升高,而ADPN水平明顯降低。本研究結果為CHB合并NAFLD患者的臨床處理提供了一定的理論依據。

