聚多巴胺納米顆粒調控Raw264.7細胞M1極化
倪宇昕 章立群 謝安琪 劉學 楊旭
(1華中科技大學協和深圳醫院口腔科,廣東 深圳 518000;2深圳大學第六附屬醫院口腔科;3吉林大學口腔醫院種植科)
牙列缺失及牙列缺損是老年人常見的口腔疾病,主要表現為單個或多個牙的功能缺失,繼而影響老年人的咀嚼功能和消化系統。種植技術已經漸漸成為臨床主要的治療方法之一,具有諸多優點。但各種原因引起的種植體周圍炎會導致種植體松動脫落,影響臨床效果〔1,2〕。巨噬細胞在種植體周圍炎的發生發展中扮演重要角色〔3,4〕,在脂多糖(LPS)刺激下會向M1型進行極化,表現為白細胞介素(IL)-1β、腫瘤壞死因子(TNF)-α、IL-6等促炎因子表達升高〔5~7〕,最終促進炎癥的進展。因此,發現抑制巨噬細胞M1極化的分子具有較好的應用前景。近年來,聚多巴胺(PDA)納米顆粒因其生物相容性高、合成簡單和具備活性氧物種清除能力而備受關注〔8~10〕,本研究對PDA納米顆粒調控巨噬細胞M1極化進行研究。
1 材料和方法
1.1主要試劑和儀器 NH4OH和鹽酸多巴胺購自Sigma公司(上海,中國);達爾伯克改良伊格爾培養基(DMEM)培養液購自賽默飛公司(上海,中國);胎牛血清(FBS)購自天杭生物(杭州,中國);LPS和酶聯免疫吸附試驗(ELISA)試劑盒購自碧云天公司(北京,中國);掃描電鏡(SEM):XL-30場發射掃描電子顯微鏡;透射電鏡(TEM):Tecnai G2 F20 S-TWIN 場發射透射電子顯微鏡。
1.2PDA納米顆粒的合成方法 是在經典的St?ber方法基礎上加以改良的。室溫下將2 ml的NH4OH、40 ml乙醇和90 ml去離子水混合攪拌30 min。同時將鹽酸多巴胺(0.5 g)加入去離子水(10 ml)中制備溶液。將上述兩溶液混合并攪拌24 h,隨后采用離心方法分離聚多巴胺,去離子水洗滌后過夜凍干。使用前稱重溶解后濾器過濾除菌。
1.3PDA的表征 將合成的PDA納米顆粒進行SEM、TEM表征,以檢測其形貌、粒徑分布。
1.4細胞培養 小鼠巨噬細胞系Raw264.7細胞購自中國科學院細胞庫,用DMEM完全培養液(含10%胎牛血清和1%雙抗),置于條件為37℃和5%CO2的孵箱中培養。
1.5細胞毒性檢測 將Raw264.7細胞以104/孔的密度在96孔板中鋪板,貼壁后在培養液中加入不同濃度的PDA(25、50、100、200 ng/ml)。細胞繼續孵育48 h后,用噻唑藍(MTT)溶液處理細胞,使其形成Forazan晶體。用二甲基亞砜(DMSO)溶解后用 Bio-Rad酶標儀測定吸光度。以未處理的細胞為對照組計算相對增殖率(n=6)。
1.6巨噬細胞M1極化檢測 用含50 μg/ml LPS和20 ng/ml干擾素(IFN)γ的DMEM條件培養液刺激巨噬細胞構建M1極化模型,以不含PDA的條件培養液為對照組,以含25、50、100、200 ng/ml的PDA條件培養液為實驗組。培養48 h后,小心吸取上清液后離心,隨后保留上清液應用ELISA檢測IL-1β、TNF-α和IL-6蛋白表達。按試劑盒中說明,建立標準品對照,加入待測上清液后進行洗板和顯色等步驟,最后利用酶標儀讀數,每組重復3次。同時將貼壁的細胞用Trizol裂解后提取總RNA,隨后反轉成(cDNA),最后應用熒光定量聚合酶鏈反應(PCR)檢測IL-1β、TNF-α和IL-6的mRNA表達。引物序列見表1,采用2-ΔΔCt方法計算相對表達量。

表1 各引物序列
1.7統計學方法 采用SPSS22統計軟件進行t檢驗。
2 結 果
2.1PDA合成及電鏡表征 實驗中成功合成了PDA納米顆粒,在水溶液中具有良好的分散性。電鏡結果顯示合成的PDA呈大小均一的球形,直徑在200 nm左右。見圖1。
2.2細胞毒性 將不同濃度的PDA納米顆粒(25、50、100、200 ng/ml)與細胞共培養48 h后,對照組與25、50、100、200 ng/ml PDA組Raw264.7細胞增殖率分別為(1.00±0.24)、(1.08±0.14)、(0.03±0.38)、(0.98±0.19)、(0.99±0.15),Raw264.7細胞增殖能力未有顯著變化。
2.3巨噬細胞M1極化相關mRNA變化 聯合應用LPS和IFNγ誘導Raw264.7細胞M1極化時,3種炎癥因子的mRNA表達水平顯著升高(P<0.05),而聯合誘導培養液和PDA納米顆粒共培養時,3種炎癥因子的mRNA升高被逐漸抑制,并呈現PDA濃度依賴性。見表2。
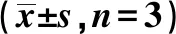
表2 Raw264.7細胞的熒光定量PCR結果
2.4Raw264.7細胞在不同培養條件下炎癥因子水平比較 與熒光定量PCR結果相似,LPS與IFNγ的組合能夠明顯的刺激巨噬細胞分泌炎癥因子,而PDA納米顆粒能夠抑制這一作用,并且隨著PDA濃度的增加,抑制作用也越發明顯,見表3。

表3 Raw264.7細胞在不同培養條件下炎癥因子水平比較
3 討 論
種植體周圍炎的始發因素是菌斑生物膜,隨后引發自身的局部炎癥反應。巨噬細胞在炎癥的活化和進展中發揮重要作用。當LPS存在時,巨噬細胞的IL-1β、TNF-α和IL-6表達會明顯升高,向M1型進行極化并加重炎癥反應。所以開發合適的能夠抑制巨噬細胞M1極化的分子或藥物尤為重要,有望通過抗炎作用預防或治療種植體周圍炎。傳統的治療雖具有一定的抗炎效果〔11~13〕,但仍存在一些缺點,包括潛在的毒副作用、價格昂貴和給藥困難等。因此,開發新的抗炎策略意義重大。
PDA是源自海洋貝類生物的一種聚合物,從被發現以來受到了廣泛的關注〔14〕。PDA具有生物相容性的優點,即便較大劑量也不會影響細胞的增殖等過程,其另一個優點是可降解性,能夠在生物體內降解從而避免潛在的毒性和不良反應。此外,PDA納米顆粒的尺寸優勢又賦予其易運載、合成成本低的特點,被廣泛應用于醫學的各個領域。近年來的研究證實PDA能夠清除細胞中的活性氧(ROS)繼而發揮抗炎作用,已被成功應用于腦卒中和肺炎的治療中〔15,16〕,成為極具應用潛力的一類生物材料。
本研究結果證實PDA能夠明顯下調IL-1β、TNF-α和IL-6的mRNA與蛋白表達,即PDA納米顆粒能夠抑制巨噬細胞的M1極化。PDA納米顆粒調控炎癥反應有效,為進一步應用PDA開展種植體周圍炎的治療奠定了基礎,但是由于體內外環境的差異,仍然需要更多的研究來確定PDA納米顆粒治療種植體周圍炎的可行性及其作用的分子機制。

