右美托咪定通過調節神經遞質水平抑制nNOS、PKCγ和PAR-2的表達發揮脊髓鎮痛作用
李鳳丹 張華 王福朝 鄭英霞
(衡水市人民醫院麻醉科,河北 衡水 053000)
內臟痛具有患病率高、病情復雜、缺乏標志物等特點,因此尚缺少治療內臟痛的特異性藥物〔1〕。脊髓鎮痛較大腦鎮痛更具針對性和選擇性。文獻顯示,脊髓鎮痛已在剖宮產術后、脊柱手術后、胃癌等〔2~4〕多種手術和疾病的治療中得到應用,并取得較好的療效,但對內臟痛的鎮痛作用尚缺少文獻報道。因此,積極探索可通過脊髓鎮痛發揮內臟痛鎮痛的新藥及其作用機制,對內臟痛的治療具有重要臨床價值。右美托咪定(DEX)是一種新型高選擇性α2 腎上腺素能受體(α2-AR)激動劑,其可通過激活突觸前、后膜α2-AR,抑制腎上腺素(EP)的釋放,阻礙疼痛信號傳導至中樞,同時還可增加脊髓中一氧化氮(NO)和乙酰膽堿(Ach)的合成與釋放,發揮脊髓水平的抗傷害效應〔5〕。但是,DEX脊髓鎮痛具體的信號轉導通路和分子傳遞過程目前尚不清楚,且其在內臟痛鎮痛中是否也可發揮作用仍缺少報道。研究發現,蛋白激酶(PK)C-NO通路在各種疼痛的產生和維持過程中發揮著重要作用,為疼痛的治療提供了新的思路〔6〕。本研究擬在確定DEX治療內臟痛大鼠具有確切療效的基礎上,考察其對大鼠脊髓中神經遞質水平的影響;同時對PKCγ、一氧化氮合酶(NOS)和蛋白酶激活受體(PAR)-2等PKC-NO痛覺通路相關信號分子水平進行檢測,以期獲得DEX脊髓鎮痛的部分可能機制。
1 材料與方法
1.1材料
1.1.1實驗動物 選取60只健康SD大鼠,雄性,6~8周齡,體重200~250 g,由河北省實驗動物中心提供,動物生產許可證號:SCXK(冀)2018-0014,動物使用許可證號:SYXK(冀)2018-0027,適應性飼養1 w,期間給予自由飲水和飲食,光照白晝各12 h。
1.1.2主要實驗試劑 鹽酸DEX(規格:2 ml∶200 μg,批準文號:H20090248,產品批號:20180511,生產廠家:江蘇恒瑞醫藥股份有限公司);Ach、去甲腎上腺素(NA)和胍丁胺(AGM)酶聯免疫吸附試驗(ELISA)試劑盒(規格均為96T,產品批號分別為:E-EL-R0355c、E-EL-0047c、E-EL-R0013c,生產廠家均為武漢伊萊瑞特生物科技股份有限公司);抗PKCγ、抗nNOS、抗PAR-2抗體(規格均為100 μl,產品批號分別為:59090S、4231S、6976S,生產廠家均為美國Cell Signaling Technology公司);免疫組化試劑盒(規格為500片,產品批號:BF06099,購自北京博奧龍免疫技術有限公司)。
1.1.3主要儀器和設備 ECG-1106L VET型數字式動物心電圖機購自深圳市凱沃爾電子有限公司;SSW-3型顯微外科手術器械包購自上海醫療器械(集團)有限公司手術器械廠;纖維素濾膜(0.22 μm)、混合纖維素濾膜(0.45 μm)購自德國BM公司;-80℃超低溫冰箱購自青島海爾集團;4℃、-20℃冰箱購自合肥美菱股份有限公司;H1650-W離心機購自湖南湘儀實驗室儀器有限公司;TGL-20M高速臺式冷凍離心機購自湖南湘儀實驗室儀器有限公司;CKX41倒置顯微鏡、IX-71熒光倒置顯微鏡均購自日本Olympus光學工業株式會社;Infinite M1000 Pro全波長酶標儀購自TECAN公司;TANKPE060高純水機購自美國Millipore公司。
1.2實驗方法
1.2.1動物分組 60只大鼠,適應性飼養1 w后,稱取體重,根據體重分層隨機分成:對照組(A組,僅鞘內注射生理鹽水10 μl,不予注射甲醛)、模型組(B組,鞘內注射生理鹽水10 μl,予以注射甲醛)和DEX低劑量組(C組,鞘內注射DEX 0.75 μg/kg,予以注射甲醛)、中劑量組(D組,鞘內注射DEX 1.5 μg/kg,予以注射甲醛)和高劑量組(E組,鞘內注射DEX 3.0 μg/kg,予以注射甲醛)〔7〕,每組12只。
1.2.2實驗動物模型的建立 鞘內注射藥物:采用吸入1.5%異氟烷將大鼠進行麻醉,俯臥位固定,使用25 μl微量注射器于脊柱 L5~6間隙的位置(髖結節水平的椎體兩側)垂直進針,試探性回抽腦脊液,當尾巴突然向側向甩動或出現顫動表示穿刺成功,此時按照分組要求緩慢注入藥物。
建立大鼠急性炎性內臟痛模型:完成藥物注射15 min后,維持麻醉,利用37℃生理鹽水清理腸道。在直腸窺器輔助下,于乙狀結腸黏膜(距直腸緣35 mm)處注射100 μl 5%甲醛(注意切勿穿透結腸壁)。完成注射后,停止麻醉,將大鼠放回籠內密切觀察。待大鼠蘇醒后,開始記錄大鼠舔腹部或外陰區域(L)、腹部收縮(A)、伸展身體(B)及肋腹部收縮(F)等行為學反應,并每隔15 min記錄一次疼痛計分〔8〕,至2 h。
1.2.3取材 依照實驗設計方案,在大鼠復蘇2 h后,采用7%濃度水合氯醛對大鼠進行麻醉,快速開胸,進行主動脈插管(遠端插管,近端夾閉),用37℃生理鹽水沖洗,除去血液,再用4℃ 500 ml 0.1 mol/L的磷酸緩沖液(PBS)進行灌注,固定標本。隨后迅速剪取大鼠脊L2~4節脊髓,置于冰面,利用顯微鏡觀察,切取約兩塊1 mm脊髓背角組織,分別利用液氮(用于ELISA檢測)和4%多聚甲醛〔用于蘇木素-伊紅(HE)染色〕各保存一份備用。
1.2.4HE染色 (1)固定:將取得的大鼠肺組織標本放置在4%濃度的甲醛溶液中充分浸泡30~50 min。 (2)脫水:分別用70%、80%、90%、95%、100%酒精進行梯度脫水。(3)透明:用二甲苯將標本透明2次,以替換標本組織內酒精,此過程需不斷觀察,直至標本透明似琥珀。(4)浸蠟:將透明標本組織放置在溶化好的石蠟里,置于溶蠟箱在65℃下保溫2 h。(5)包埋:觀察石蠟完全浸入到組織中以后進行包埋,待其冷卻凝固以后便成為蠟塊。(6)編號:記錄為標本來源大鼠編號。(7)切片:標本組織蠟塊用切片機在其中部自動橫行切取3張4 μm厚的薄片。(8)貼片:將切片在熱水中燙平,然后再貼在玻片上,置于烤箱58℃恒溫保持4 h。(9)染色:在脫蠟和水洗之后,采用蘇木素進行染色,保持3 min,繼續水洗之后再藍化,保持10 min,使用1%濃度的鹽酸酒精再進行分化,保持20 s,最后伊紅染色,保持5 min。(10)封片:使用70%、80%、90%、95%、100%酒精依次進行脫水,各自保持3 min,使用二甲苯進行透明,保持5 min,最后使用中性樹脂膠完成封片。
1.2.5ELISA 切割組織標本,稱重,利用勻漿器充分勻漿,2 000~3 000 r/min離心20 min,收集上清液,備用;按照試劑盒說明書要求制備標準品,在待測樣品孔中的酶標包被板上加40 μl樣品稀釋液,再加10 μl 5倍稀釋的待測樣品。空白對照孔不加上述試劑和樣品,其余各步操作同待測樣品孔。封板膜封板37℃溫育,30 min;將濃縮液稀釋30倍后備用;揭掉封板膜,棄去孔內的液體,甩干,在孔內加滿洗滌液,靜置30 s,棄去液體重復5次,甩干;每孔加 50 μl 酶標試劑(除空白對照孔外);操作步驟同加樣;操作步驟同配液;每孔加 50 μl 顯色劑A,加50 μl顯色劑B,輕輕震蕩,混勻,37℃下避光顯色15 min;每孔加50 μl終止液,終止反應時藍色變為黃色;450 nm波長下依次測量各孔的OD值。
1.2.6Western印跡法 采用Western印跡法對肺組織中κB激酶抑制劑(IKK)、p65的表達進行定量檢測。具體步驟:(1)取出大鼠的肺組織,立即在研磨器內加細胞裂解液放置在冰上進行研磨,持續30 min,將混合液小心吸入到離心管中。(2)將離心管置于低溫高速離心機內,11 000 r/min,4℃離心,持續15 min,棄沉淀,取上清液。(3)將上清液收集起來,BCA法定量檢測蛋白濃度,依照3∶1的比例加入上樣緩沖液,再經過沸水浴持續5 min,進行滅活,在-20℃下儲存,以備后續使用。(4)在110 mV下,用聚丙烯酰胺凝膠電脈(PAGE)進行蛋白質的分離,溴酚藍區帶到達分離膠以后,電壓調至200 mA,持續2 h,溴酚藍區帶進入分離膠末端,并即將泳出分離膠底部,轉至硝酸纖維膜上。(5)按照20∶1的比例在吐溫磷酸鹽緩沖液(PBST)溶液中加脫脂奶粉,室溫條件下封閉1 h,依照一抗的推薦濃度和用量,加入奶粉對一抗進行稀釋。將硝酸纖維膜置于雜交袋,加一抗工作液在袋中,然后封口,4℃條件下,孵育過夜。(6)采用辣根過氧化物酶(HRP)標記好的二抗(抗兔IgG抗體,1∶2 000稀釋)工作液,再封口,37℃條件下,孵育1 h。(7)凝膠成像分析儀掃描并分析結果。繪制標準曲線,并計算濃度,結果用相對灰度值進行表示。
1.3統計學方法 采用SPSS22.0軟件進行t檢驗、單因素方差分析、SNK-q檢驗。
2 結 果
2.1DEX對大鼠疼痛評分的影響 與A組相比,B組各時間點的疼痛評分均明顯升高(均P<0.05),且B組最大值出現在造模15 min,隨時間推移B組疼痛評分逐漸下降;C、D、E組大鼠疼痛評分最大值均出現在造模30 min,且較B組分數減少,除C組30 min外,差異均有統計學意義,并呈劑量依賴性(P<0.05)。以上結果提示,鞘內注射DEX對急性炎性內臟痛大鼠具有一定的鎮痛作用,且可推遲疼痛高峰的出現。見表1。
2.2DEX對急性炎性內臟痛大鼠心率的影響 各組大鼠在不同時間點心率之間均無統計學差異(P>0.05)。提示DEX鞘內注射對急性炎性內臟痛大鼠心率無明顯影響。見表1。
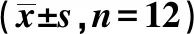
表1 DEX對造模不同時間大鼠疼痛評分和心率的影響
2.3DEX對大鼠脊髓中Ach、NA和AGM含量的影響 與A組相比,B、C、D、E組大鼠脊髓中Ach、NA含量均明顯升高(P<0.05),AGM含量均明顯下降(P<0.05);而與B組相比,C、D、E組Ach和AGM含量均明顯升高(P<0.05),NA濃度明顯降低(P<0.05),并呈劑量依賴性。見表2。
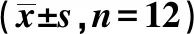
表2 DEX對大鼠脊髓中Ach、NA、AGM、nNOS、PKCγ和PAR-2含量的影響
2.4DEX對大鼠急性炎性內臟痛脊髓神經毒性的影響 HE染色結果顯示,各組大鼠脊髓神經元細胞染色后,細胞大小均勻,細胞間質光滑、整齊,細胞核和黏液呈藍色或灰藍色,軟骨基質呈深藍色,細胞質呈粉色,嗜酸性顆粒、紅細胞、蛋白性液體等為紅色。見圖1。

圖1 各組大鼠脊髓神經元HE染色(×400)
2.5免疫組化檢測大鼠脊髓組織中PKCγ和nNOS 的表達 如圖2所示,PKCγ陽性細胞多呈圓形或梭形,PKCγ主要分布于細胞胞質內和胞膜上,呈棕黃色,胞內染色較淡,胞膜染色較深。

圖2 脊髓組織中PKCγ表達免疫組化染色(×400)
如圖3所示,nNOS陽性細胞與PKCγ陽性細胞形狀相似,但胞體較小,nNOS主要分布于胞質內,呈棕褐色,染色較深,胞膜和胞核未著色。組間對比可見,與A組相比,B、C、D、E組PKCγ和nNOS陽性細胞明顯增多;而與B組相比,C、D、E組PKCγ和nNOS陽性細胞明顯下降,并呈劑量依賴性。

圖3 脊髓組織中nNOS表達免疫組化染色(×400)
2.6Western印跡檢測大鼠脊髓組織中nNOS、PKCγ和PAR-2蛋白表達 除E組nNOS外,B、C、D、E組大鼠肺組織中nNOS、PKCγ和PAR-2表達較A組明顯增加(P<0.05),而C、D、E組nNOS、PKCγ和PAR-2表達量較B組明顯下降(P<0.05),并呈劑量依賴性。由此可推斷,大鼠急性炎性內臟痛可誘導PAR-2通路激活,使nNOS、PKCγ和PAR-2蛋白表達增加,DEX可抑制PAR-2通路激活。見表2、圖4。

圖4 Western印跡檢測脊髓組織nNOS、PKCγ和PAR-2蛋白表達
3 討 論
鞘內注射可將藥物直接注入脊髓組織,使藥物富集于脊髓,同時可減少藥物劑量,因此在疼痛治療中具有一定的優勢。在對鎮痛藥物的研究中,α2腎上腺素能藥物最受重視。Nagasaka等〔9〕發現,給大鼠鞘內注射注入DEX,能顯著減弱疼痛刺激,提示DEX具有一定的神經鎮痛作用,且與可樂定相比,DEX鎮痛療效更優,不良反應較小。也有研究證明,鞘內注射1.5 μg/kg DEX在10 min時可發揮最大鎮痛效應,并持續約6 h,其產生的抗傷害效應約為其他鞘外注射用藥量的5倍,機制主要與激活通過外周和脊髓的α2-AR有關〔10〕。本研究結果顯示,鞘內注射DEX可對急性炎性內臟痛大鼠具有一定的鎮痛作用,且可推遲疼痛高峰的出現,同時結果還顯示鞘內注射DEX對大鼠心率和神經元損傷無明顯影響,但可增加Ach和AGM的表達,降低NA水平。
PKC是蛋白激酶超家族成員的一種,可發揮信號轉導、神經元興奮性調節、細胞增生及神經遞質釋放等多種生物學活性〔11~13〕。當神經發生損傷時,神經細胞會釋放大量P物質(SP),使胞質內無活性的PKC轉至細胞膜發生活化,活化的PKC又可誘導NOS發生磷酸化,使信號維持時間延長,導致中樞敏化〔14〕。PKCγ是PKC亞型的一種,其主要分布于三叉神經、丘腦核束、皮質脊髓束等神經元細胞〔15〕。有研究表明,PKCγ活化是神經疼痛和炎性疼痛產生的主要機制之一,當小鼠敲除PKCγ基因后,其對刺激性傷害的疼痛反應明顯下降〔16〕。國外研究還發現,利用甲醛在大鼠足底進行注射致痛后,大鼠脊髓背角神經元中的膜上PKCγ明顯增加〔17〕,提示PKCγ參與了機體的軀體痛覺傳入。牛敬忠等〔18〕研究發現,利用甲醛進行直腸內注射致痛后,模型組大鼠神經元PKCγ膜轉位明顯多于對照組;同時,給予PKC激動劑(PMA)刺激后,神經元細胞的膜轉位的程度也顯著增加,說明PKCγ還與炎性內臟疼痛形成密切相關。
早期研究發現,DEX可直接抑制突觸釋放興奮性神經遞質〔SP、降鈣素基因相關肽(CGRP)等〕到脊髓背角,達到抗傷害作用〔19〕。有研究表明,鞘內注射DEX能明顯抑制骨癌大鼠的熱痛覺過敏,同時還可改善大鼠運動功能障礙〔20〕;其機制研究發現,與模型組相比,DEX組大鼠同側脊髓背角中PKCγ水平明顯下降,并呈劑量依賴性〔21〕。也有研究發現,鞘內注射DEX后,坐骨神經損傷大鼠痛覺敏感明顯減輕,其機制與DEX抑制大鼠脊髓背角PKCγ轉膜有關〔22〕。國外研究也表明,鞘內注射DEX可使脊神經結扎大鼠機械性痛敏顯著下降,這與DEX抑制脊髓中NO、nNOS等表達有關〔23〕。為進一步探究DEX發揮鎮痛作用的機制,本研究結果顯示,DEX可明顯降低模型大鼠脊髓 nNOS、PKCγ和PAR-2表達水平。

