miR-29a-3p靶向組蛋白去乙酰化酶4對高糖誘導的小鼠足細胞損傷的影響
徐艷梅 黃杰 熊艷 許琛 汪磊 趙夏 張璐璐 許傳文
(華中科技大學同濟醫學院附屬普愛醫院腎內科,湖北 武漢 430030)
糖尿病腎病(DN)是糖尿病常見并發癥并可導致終末期腎衰竭,其發病機制較為復雜,既往研究顯示炎癥介質釋放、細胞凋亡及氧化應激等均可通過破壞腎小球過濾屏障進而引發DN〔1〕。足細胞又稱為腎球臟層上皮細胞,具有合成腎小球基底膜主要成分及維持腎小球過濾屏障完整性等功能,研究發現腎小球足細胞損傷可能是導致DN發生及發展的主要因素〔2〕。因此尋找有效治療及防止足細胞損傷的方法成為亟待解決的問題。研究表明,高糖可顯著下調體外培養的人近端腎小管上皮細胞中微小RNA(miR)-29a的表達,高糖可通過下調miR-29a進而造成基質膠原聚集最終導致DN〔3〕。急性腎損傷患者血清中miR-29a表達水平降低,過表達miR-29a能抑制腎小管上皮細胞凋亡〔4〕。在糖尿病小鼠中,miR-29表達下調,過表達miR-29能夠抑制高糖環境導致的腎小管上皮細胞的損傷〔5〕。通過生物信息學軟件預測miR-29a-3p與組蛋白去乙酰化酶(HDAC)4的 3′UTR存在結合位點,研究顯示HDAC4在STZ誘導的DN大鼠模型的腎臟中表達顯著增加,同時體外實驗顯示高糖刺激能誘導足細胞HDAC4的表達〔6〕。但miR-29a-3p靶向HDAC4對高糖誘導的小鼠足細胞損傷的影響未見相關研究。本研究通過高糖誘導小鼠足細胞MPC5模擬DN環境,探討miR-29a-3p對高糖誘導損傷MPC5細胞的影響,并驗證其與HDAC4的靶向關系,為臨床靶向治療DN提供理論依據。
1 材料與方法
1.1細胞與試劑 小鼠腎臟足細胞系MPC5購自上海康朗生物科技有限公司。DMEM培養基、胰蛋白酶及胎牛血清均購自上海滬峰生物科技有限公司;miR-29a-3p mimic及陰性轉染質粒、miR-29a-3p抑制劑(anti-miR-29a-3p)、anti-miR-NC均購自上海吉瑪有限公司;si-HDAC4、陰性對照siRNA(si-NC)、HDAC4過表達質粒(pcDNA-HDAC4)與空白對照空質粒(pcDNA)均購自廣州銳博生物科技有限公司;實時熒光定量試劑盒、反轉錄試劑盒及Trizol試劑均購自美國Life Technology公司;細胞凋亡檢測試劑盒及脂質體Lipofectamine2000轉染試劑盒均購自杭州吉諾生物醫藥技術有限公司;兔抗鼠HDAC4一抗購自美國Protein Tech Group公司;兔抗鼠結蛋白(desmin)抗體、兔抗鼠Bcl-2、Bax、酶切caspase-3多克隆抗體均購自美國Santa Cruz公司;兔抗鼠synaptopodin抗體、GAPDH及辣根過氧化物酶(HRP)標記的山羊抗兔IgG均購自北京博奧森公司。
1.2方法
1.2.1細胞培養、轉染及分組 MPC5細胞復蘇,放入DMEM培養基,培養基主要成分為體積分數10%胎牛血清、青霉素(100 kU/L)、鏈霉素(100 mg/L)及γ-干擾素(10 kU/L),在溫度37℃、5%CO2培養箱中進行培養,第2天更換為不含γ-干擾素的DMEM培養基培養,培養10~14 d后收集細胞用于后續實驗〔7〕。收集成熟MPC5細胞接種于培養瓶(25 cm2)中,密度為5×108/L,待細胞生長融合至70%~80%時更換為不含胎牛血清的DMEM培養基,饑餓處理24 h,隨機分為正常對照(NG)組、高糖刺激(HG)組,其中NG組中加入D-葡萄糖5 mmol/L;HG組中加入D-葡萄糖30 mmol/L〔8〕。收集HG組對數生長期MPC5細胞并接種于6孔細胞培養板,待細胞融合度至90%時參照Lipofectamine2000轉染試劑盒說明書進行miR-29a-3p mimic、miR-NC細胞轉染,si-HDAC4、si-NC轉染至MPC5細胞中,轉染6 h后更換新鮮培養基,繼續培養48 h收集細胞用于后續實驗。
1.2.2qRT-PCR法檢測MPC5細胞中miR-29a-3p及HDAC4 mRNA表達 參照Trizol提取試劑盒說明書提取各組MPC5細胞總RNA,利用紫外分光光度計檢測RNA濃度、純度,RNA反轉錄為cDNA,以cDNA為模板進行qRT-PCR擴增,miR-29a-3p及HDAC4 引物均由上海生工生物工程股份有限公司合成。PCR擴增反應條件為95℃ 5 min循環1次,95℃變性15 s,60℃退火30 s,72℃延伸30 s,共循環40次。miR-29a-3p以U6為內參基因,HDAC4以GAPDH為內參基因,采用2-ΔΔCt法計算miR-29a-3p及HDAC4 mRNA相對表達量。
1.2.3Western印跡法檢測MPC5細胞中HDAC4、synaptopodin、desmin、Bcl-2、Bax及酶切caspase-3蛋白表達 收集各組MPC5細胞,裂解蛋白后提取細胞總蛋白,利用二喹啉甲酸(BCA)法測定蛋白濃度,分別取40 μg蛋白經10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE),結束后將蛋白凝膠轉移至聚偏氟乙烯(PVDF)膜,5%BSA脫脂奶粉封閉,30 min后分別加入蛋白一抗,置于4℃孵育過夜,次日使用TBST洗膜,分別加入二抗,室溫下孵育2 h,TBST洗膜,使用增強型化學發光試劑(ECL)顯影,各蛋白均以GAPDH為內參基因,放入凝膠成像系統分析儀并采用Quantity One軟件分析各蛋白條帶灰度值。
1.2.4流式細胞術檢測MPC5細胞凋亡 分別取各組MPC5細胞,胰蛋白酶消化后收集細胞,預冷磷酸鹽緩沖液(PBS)清洗細胞,1 200 r/min轉速離心5 min(離心半徑 6 cm),棄PBS,加入結合緩沖液,重懸細胞,分別加入Annexin V-FITC(5 μl)、PI(1 μl),使用流式細胞儀檢測MPC5細胞凋亡情況并利用Flowjo軟件計算細胞凋亡率。
1.2.5雙熒光素酶報告基因實驗 收集對數生長期MPC5細胞接種于24孔細胞培養板(1×105個/ml),待細胞融合度至80%時分別將miR-29a-3p mimic、miR-NC與WT-HDAC4、MUT-HDAC4質粒轉染入MPC5細胞中,繼續培養48 h后檢測MPC5細胞熒光強度。
1.3統計學方法 采用SPSS21.0統計學軟件進行t檢驗、單因素方差分析、SNK-q檢驗。
2 結 果
2.1高糖刺激對各組腎臟足細胞MPC5中miR-29a-3p和HDAC4基因表達的影響 qRT-PCR法與Western印跡法分別檢測NG組與HG組腎臟足細胞MPC5中miR-29a-3p和HDAC4基因表達,結果顯示HG組腎臟足細胞MPC5中miR-29a-3p表達水平顯著低于NG組(P<0.01),而HDAC4 mRNA及蛋白表達均顯著高于NG組(P<0.01),見圖1、表1。

圖1 HDAC4蛋白表達
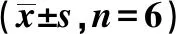
表1 高糖刺激對各組腎臟足細胞MPC5中miR-29a-3p和HDAC4基因表達的影響
2.2miR-29a-3p過表達對高糖刺激各組腎臟足細胞MPC5中synaptopodin和desmin表達的影響 將miR-29a-3p mimic、miR-NC分別轉染至高糖誘導的MPC5細胞中,qRT-PCR檢測結果顯示HG+miR-29a-3p組MPC5細胞中miR-29a-3p表達水平顯著高于HG+miR-NC組(P<0.05),提示轉染成功。Western印跡法檢測MPC5細胞中synaptopodin、desmin蛋白表達,結果顯示HG組MPC5細胞中synaptopodin蛋白表達明顯降低(P<0.05),miR-29a-3p mimic轉染入HG組MPC5細胞中,發現HG+miR-29a-3p MPC5細胞中synaptopodin蛋白表達明顯增加(P<0.05);HG組MPC5細胞中desmin蛋白表達明顯升高(P<0.05),轉染miR-29a-3p mimic后MPC5細胞中desmin蛋白表達明顯降低(P<0.05),見圖2、表2。表明miR-29a-3p過表達可減緩高糖刺激腎臟足細胞損傷。

1~4:NG組、HG組、HG+miR-NC組、HG+miR-29a-3p組,下圖同圖2 synaptopodin和desmin蛋白表達
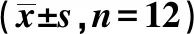
表2 miR-29a-3p過表達對高糖刺激各組腎臟足細胞MPC5中synaptopodin和desmin表達的影響
2.3miR-29a-3p過表達對高糖刺激腎臟足細胞MPC5凋亡的影響 流式細胞術檢測miR-29a-3p過表達后MPC5細胞凋亡情況,結果顯示HG組MPC5細胞凋亡率顯著高于NG組(P<0.05),miR-29a-3p過表達后HG+miR-29a-3p組MPC5細胞凋亡率顯著降低(P<0.05),進一步采用Western印跡法檢測細胞凋亡蛋白表達,結果發現相較于NG組,HG組MPC5細胞中抗凋亡蛋白Bcl-2蛋白表達明顯降低(P<0.05),促凋亡蛋白Bax、酶切caspase-3蛋白表達均顯著升高(均P<0.05);與HG+miR-NC組相比,HG+miR-29a-3p組MPC5細胞中Bcl-2蛋白表達顯著升高(P<0.05),而Bax、酶切caspase-3蛋白表達均顯著降低(均P<0.05),見圖3、表3。表明miR-29a-3p過表達可抑制小鼠腎臟足細胞MPC5凋亡。

圖3 miR-29a-3p過表達對高糖刺激各組腎臟足細胞MPC5凋亡蛋白的影響
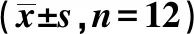
表3 miR-29a-3p過表達對高糖刺激各組腎臟足細胞MPC5凋亡蛋白及凋亡率的影響
2.4抑制HDAC4表達對高糖刺激腎臟足細胞MPC5損傷的影響 為了驗證HDAC4對高糖刺激腎臟足細胞MPC5損傷的影響,采用基因干擾技術抑制HDAC4表達,Western印跡法驗證轉染結果,HG+si-HDAC4組MPC5細胞中HDAC4蛋白表達顯著降低(P<0.05),提示基因干擾技術成功抑制HDAC4表達。通過Western印跡法檢測抑制HDAC4表達后MPC5細胞中足細胞損傷及細胞凋亡相關蛋白表達,以此驗證HDAC4表達變化對足細胞MPC5損傷的影響,結果顯示與HG+si-NC組比較,HG+si-HDAC4組MPC5細胞中synaptopodin與Bcl-2蛋白表達均明顯升高(P<0.05),而desmin、Bax、酶切caspase-3蛋白表達均明顯降低(P<0.05),見圖4、表4。說明抑制HDAC4表達可減輕高糖刺激腎臟足細胞MPC5細胞損傷,抑制MPC5細胞凋亡。

1~4:NG組、HG組、HG+si-NC組、HG+si-HDAC4組圖4 HDAC4、synaptopodin、desmin及凋亡相關蛋白表達

表4 抑制HDAC4表達對高糖刺激腎臟足細胞MPC5損傷的影響
2.5miR-29a-3p靶向調控HDAC4的表達 用生物信息學軟件預測HDAC4為miR-29a-3p潛在靶基因,見圖5A。采用熒光素酶報告實驗發現miR-29a-3p過表達可降低WT-HDAC4的熒光素酶活性(P<0.05),而MUT-HDAC4與miR-29a-3p mimic共轉染MPC5細胞其熒光素酶活性無明顯變化(P>0.05),見表5。Western印跡實驗結果顯示miR-29a-3p過表達后MPC5細胞中HDAC4蛋白表達水平明顯下降(P<0.05),抑制miR-29a-3p表達后MPC5細胞中HDAC4蛋白表達水平明顯升高(P<0.05),見圖5B、表6。

A:HDAC4的3′UTR中含有與miR-29a-3p互補的核苷酸序列;B:HDAC4蛋白表達,1~4:miR-NC組、miR-29a-3p組、anti-miR-NC組、anti-miR-29a-3p組圖5 miR-29a-3p靶向調控HDAC4的表達
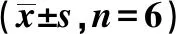
表5 雙熒光素酶報告實驗
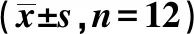
表6 miR-29a-3p調控HDAC4蛋白的表達
2.6HDAC4過表達逆轉了miR-29a-3p過表達對高糖刺激腎臟足細胞MPC5損傷的作用 構建HDAC4過表達質粒與miR-29a-3p mimic共轉染入MPC5細胞,相對于HG+miR-29a-3p+pcDNA組,HDAC4過表達后,流式細胞術檢測結果顯示MPC5細胞凋亡率增加(P<0.05),Western印跡檢測結果顯示synaptopodin與Bcl-2蛋白表達均明顯降低,而desmin、Bax、酶切caspase-3蛋白表達均顯著升高(P<0.05),見表7、圖6。
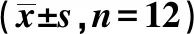
表7 HDAC4過表達逆轉了miR-29a-3p過表達對高糖刺激腎臟足細胞MPC5損傷的作用

1~4:miR-NC組、miR-29a-3p組、miR-29a-3p+PCDNA組、miR-29a-3p+PCDNA-HDAC4組圖6 HDAC4、synaptopodin、desmin蛋白及凋亡相關蛋白表達
3 討 論
DN患者主要臨床表現為微量尿蛋白,隨著疾病進展會出現腎小球濾過率降低及蛋白尿惡化等,最終導致腎功能喪失,蛋白濾過最后屏障是足細胞,足細胞損傷是導致蛋白尿產生的主要原因〔9〕。研究表明DN發展為腎小球硬化及纖維化的主要原因在于足細胞凋亡,成熟足細胞持續凋亡可促使其功能發生紊亂進而產生蛋白尿〔10,11〕。Zhou等〔12〕研究顯示miRNA在DN發病機制中發揮重要作用并可成為治療DN新靶點。因此,本研究探討DN高糖誘導足細胞損傷的機制有助于尋找防治DN的新靶點,對改善DN治療方案及降低死亡率均具有重要意義。
miR-29a在腎臟疾病發生及發展過程中發揮重要調控作用,研究顯示下調miR-29a表達可通過促進MMP-2表達進而促使腎小管間質及腎臟纖維化發生〔13~15〕。相關研究表明DN患者與1型糖尿病患者血清中miR-29a-3p表達水平降低,并可參與疾病發生及發展過程〔16,17〕。本研究結果顯示高糖誘導腎臟足細胞MPC5中miR-29a-3p表達水平明顯降低,說明miR-29a-3p表達水平降低可能促進MPC5損傷。通過將miR-29a-3p mimic及其陰性對照質粒轉染入高糖誘導的MPC5細胞,結果發現高糖誘導的MPC5細胞中synaptopodin蛋白表達降低,上調miR-29a-3p表達后其表達水平明顯上升;而desmin蛋白表達明顯高于正常組,上調miR-29a-3p表達后其表達水平明顯降低,其中desmin蛋白是足細胞損傷特異性和敏感指標,在足細胞損傷時表達增加;synaptopodin是成熟足細胞表型的一個重要標志蛋白,在足細胞損傷時表達減少〔18〕。提示高糖環境下miR-29a-3p表達水平降低并可造成腎臟足細胞MPC5損傷,上調miR-29a-3p表達可緩解高糖所致足細胞損傷。本研究結果發現高糖誘導的MPC5細胞凋亡率顯著升高,抗凋亡蛋白Bcl-2蛋白表達水平降低,促細胞凋亡蛋白Bax、酶切caspase-3蛋白表達均明顯升高,上調miR-29a-3p表達后高糖誘導的MPC5細胞凋亡率明顯降低,Bcl-2蛋白表達明顯升高,而明Bax、酶切caspase-3蛋白表達均顯降低,研究報道指出Bcl-2蛋白表達降低與Bax、酶切caspase-3蛋白表達升高可促進DN蛋白尿形成過程〔19〕。提示上調miR-29a-3p表達可通過減少足細胞凋亡進而降低蛋白尿生成。
HDAC4作為HDACs家族的一員可通過去除乙酰基促使組蛋白染色質凝集進而抑制基因轉錄激活,研究顯示HDAC4可在基因轉錄調控及細胞凋亡等多種生物進程中發揮調控作用,并可促進心血管疾病、骨關節炎等多種疾病發生及發展〔20〕。HDAC4在高脂血癥小鼠大腦皮質呈高表達并可促進高脂血癥誘發的腦神經退行性疾病〔21〕。楊雪琛等〔22〕研究表明HDACs與糖尿病發生發展過程密切相關并可能作為治療糖尿病的藥物靶點。本研究結果說明HDAC4 表達水平升高可能促進高糖誘導足細胞損傷。采用基因干擾技術抑制HDAC4表達后MPC5細胞中synaptopodin、Bcl-2蛋白表達明顯升高,而desmin、Bax、酶切caspase-3蛋白表達均顯著降低,提示抑制HDAC4表達可抑制腎臟足細胞MPC5凋亡,延緩高糖誘導的足細胞損傷。Li等〔23〕研究表明HDAC4是miR-29a-3p的靶基因并可參與胃癌發生及發展進程。本研究采用熒光素酶實驗發現miR-29a-3p可靶向結合HDAC4并負向調控其表達水平,為了進一步驗證HDAC4在高糖誘導足細胞損傷中的作用,本研究結果提示miR-29a-3p通過抑制HDAC4表達進而抑制高糖誘導MPC5細胞凋亡并減緩足細胞損傷。
綜上,高糖誘導小鼠足細胞MPC5中miR-29a-3p表達下調,HDAC4表達上調,miR-29a-3p可通過抑制HDAC4表達并減少MPC5細胞凋亡進而防止足細胞損傷最終延緩DN發生及發展,可為早期防治DN足細胞損傷提供理論依據。但關于miR-29a-3p如何調控DN足細胞損傷相關通路仍需深入研究。

