優化青花椒多酚提取工藝及多酚成分測定和抗氧化性研究
郭彩慧,朱毅*,馬雪穎,邵萌萌,于夢淇,王永剛
(1.中國農業大學 食品科學與營養工程學院,北京 100089;2.解放軍總醫院,北京 100039)
花椒(ZanthoxylumschinifoliumSieb.et Zucc)屬于蕓香科,是一種常見的香料和油料作物,富含多種生物活性成分[1],且具有較強的抗氧化能力,生活中還可用于抗菌、止痛等[2]。花椒有青、紅兩種顏色,青花椒主要產于南方,而紅花椒在北方居多。兩種花椒除外觀上有較大差異外,在風味和組分方面也有一定差別[3-4]。本實驗選用青花椒進行實驗,相較于紅花椒,青花椒個頭更大,麻味更濃。如今,花椒的選種和栽培已取得較大的進展,但在深加工產業技術方面有所欠缺,需進一步研究[5-7]。
植物多酚,又稱植物單寧,具有很強的抗氧化能力和抗菌活性[8-9],可以減少細胞和組織中的氧化損傷[10],因此可以作為天然抗氧化劑應用在不同領域中[11]。目前國內對植物多酚的提取和抗氧化性的研究臻于完善,花椒多酚的相關研究也多基于紅花椒,但是對于青花椒多酚的研究未見報道,因此,本實驗選用優質青花椒為實驗原料,利用有機溶劑浸提法提取多酚類物質,研究A,B,C,D 4個因素對花椒多酚提取率的影響,采用正交實驗優化花椒多酚的提取條件;采用柱層分析法純化青花椒多酚粗提液,進行成分和抗氧化能力測定。花椒被廣泛用作調味品,但在其他方面應用較少,所以本文旨在增加花椒的綜合利用,為花椒深加工技術的發展提供一定的理論基礎。
1 材料與方法
1.1 材料與試劑
青花椒:魯甸縣明德農業開發有限公司。將青花椒在45 ℃下干燥24 h,用粉碎機粉碎成花椒粉,常溫避光儲藏。
抗壞血酸(Vc)、福林酚、2,2-聯苯基-1-苦基肼基、2,2′-聯氨-雙二胺鹽:北京索萊寶科技有限公司;過硫酸鉀:國藥集團化學試劑有限公司;以上試劑均為分析純。沒食子酸、兒茶素、綠原酸、咖啡酸、對香豆酸、槲皮素、表兒茶素、山奈酚、阿魏酸、表兒茶素沒食子酸酯:北京世紀奧科生物技術有限公司;以上試劑均為標準品。聚酰胺粉(規格100~200目):上海麥克林生化科技有限公司。
1.2 儀器與設備
ZBRTD-211數顯恒溫水浴鍋;UV5300紫外可見分光光度計;SHB循環水式多用真空泵;BYB-300A高速多功能粉碎機;XMTD-8222電熱恒溫水槽;RE-2000A旋轉蒸發儀;FD-1B-50冷凍干燥機;BT-200B數顯恒流泵;2XZ(S)-2旋片式真空泵:以上儀器均為國產;5430R冷凍離心機:德國Eppendorf公司。
1.3 實驗方法與內容
1.3.1 沒食子酸標準曲線的繪制
將0.1 g沒食子酸溶于蒸餾水中,定容至100 mL,得1.0 mg/mL的沒食子酸溶液,50 mL容量瓶中分別移入0,0.05,0.10,0.15,0.20,0.25,0.30 mL,加25 mL蒸餾水和2 mL Folin-Ciocalteu試劑,混合均勻后靜置4~5 min,加入4 mL 10% Na2CO3試劑并用少量蒸餾水稀釋,在30 ℃下恒溫水浴2 h,在765 nm處測量樣品的吸光值[12-14],繪制樣品標準吸光曲線。
1.3.2 青花椒多酚的提取及測定
將2.00 g花椒粉溶解在60%的乙醇中,料液比為1∶20 (g/mL),40 ℃下恒溫水浴60 min,在7000 r/min、4 ℃下離心20 min。將提取物在50 ℃下濃縮至25%,以便從花椒中獲得多酚的粗提取物。按1.3.1方法測量吸光度后,根據下式計算多酚含量[15]:
W=C×V×N/M×1000。
式中:W為多酚含量(mg/g);C為沒食子酸的濃度(μg/mL);V為粗提液的體積(mL);N為稀釋的倍數;M為取樣量(g)。
1.3.3 青花椒多酚提取單因素實驗[16]
根據1.3.2的方法,將乙醇提取青花椒多酚濃度(20%、30%、40%、60%、80%)、提取溫度(30,40,50,60,70 ℃)、提取時間(30,50,60,70,90 min)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50,g/mL)作為單因素條件,探究其對青花椒多酚提取量的影響,每組實驗重復3次。
1.3.4 青花椒多酚的分離純化[17-19]
取適量的聚酰胺粉溶于95%的乙醇溶液,反復攪拌直至除去白色氣泡后倒入裝柱,用95%乙醇洗脫,洗脫液透明后用5% NaOH、蒸餾水、10%醋酸洗脫,最后用蒸餾水洗脫至中性。將濃縮的青花椒多酚粗提液(1.5 BV)進行上樣,保留30 min,分別用蒸餾水(1.5 BV)、70%乙醇洗脫,收集2,3 BV洗脫液,用真空旋轉蒸發儀濃縮后得到青花椒多酚純化物。
1.3.5 高效液相色譜法測定青花椒多酚成分[20-23]
1.3.5.1 供試品溶液的準備
用色譜級甲醇溶解1 mg青花椒多酚純化物,得到1 mg/mL的樣品溶液,用0.45 μm微孔濾膜進行過濾后置于棕色進樣瓶中。
1.3.5.2 標準品溶液的準備
分別稱量兒茶素等10種標準品20 mg,溶解于色譜級甲醇中,得1 mg/mL的標準品溶液,保存在棕色容量瓶中,隨后將其配制成濃度為1,5,10,20,40,60 μg/mL的混合標準溶液,用0.45 μm微孔濾膜過濾后置于一個棕色進樣瓶中。
1.3.5.3 色譜條件
色譜柱:Inert Sustain C18柱(5 μm,250 mm×4.6 mm);流動相A:0.1%甲酸水溶液,流動相B:色譜甲醇,柱溫:40 ℃,流速:1 mL/min,進樣量:10 μL,檢測波長:280 nm,檢測器:Agilent 1200,DAD檢測器。
HPLC色譜梯度洗脫條件見表1。
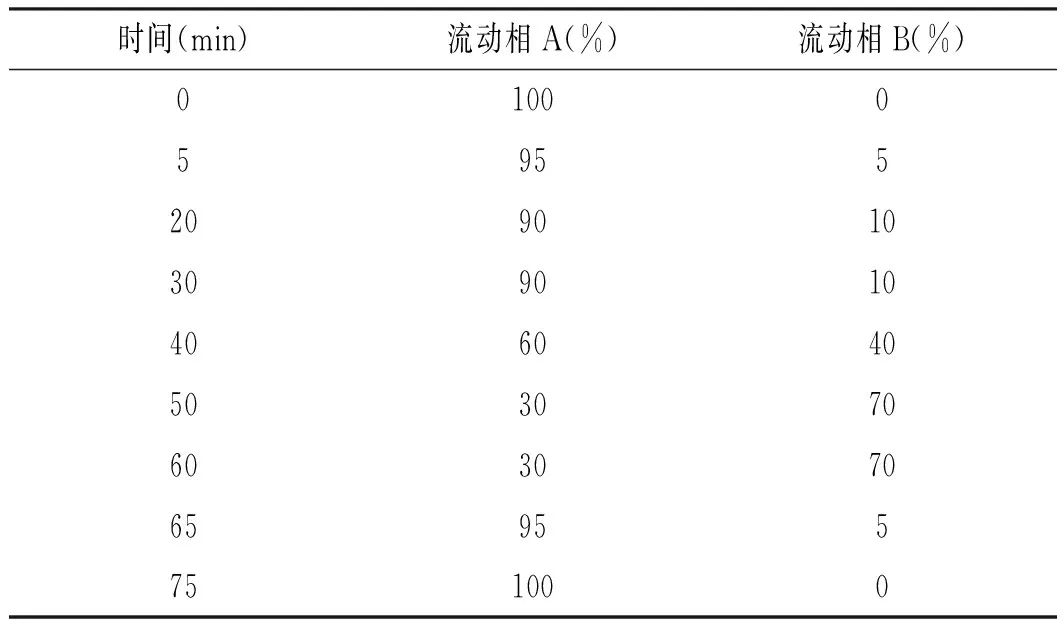
表1 HPLC色譜梯度洗脫條件Table 1 The gradient elution conditions of HPLC
1.3.6 青花椒多酚與Vc對DPPH、ABTS+自由基的清除作用
用無水乙醇分別溶解10 mg的青花椒多酚粗提物、純化物和Vc,定容至10 mL,保存到棕色容量瓶中,濃度為1 mg/mL,用無水乙醇分別稀釋,得到濃度為0.001,0.002,0.004,0.006,0.008,0.10,0.20,0.40 mg/mL的樣品溶液[24]。取2 mL DPPH乙醇溶液和2 mL樣品溶液混合,并在常溫、黑暗條件下保存30 min,測量517 nm處的吸光度,并使用無水乙醇作為對照和空白;將4.0 mL ABTS+測定液和0.4 mL樣品溶液混合,振蕩30 s后靜置5 min,在734 nm處測量吸光度,無水乙醇溶液作為對照和空白。
DPPH 自由基清除率(%)=[1-(Ai-Aj)/A0]×100%。
公式(1)
式中:Ai為吸光值(2 mL DPPH+2 mL樣品溶液);Aj為吸光值(2 mL無水乙醇+2 mL樣品溶液);A0為吸光值(2 mL DPPH+2 mL無水乙醇)。
ABTS+自由基清除率(%)=(1-A1/A0)×100%。
公式(2)
式中:A1為吸光值(4.0 mL ABTS+測定液+0.4 mL樣品溶液);A0為吸光值(4.0 mL ABTS+測定液+0.4 mL無水乙醇)。
1.3.7 數據統計與分析
數據使用SPSS 25.0進行分析,Origin 9.0進行作圖,結果用平均值±標準偏差表示。
2 結果與分析
2.1 青花椒多酚提取單因素實驗結果
2.1.1 沒食子酸標準曲線
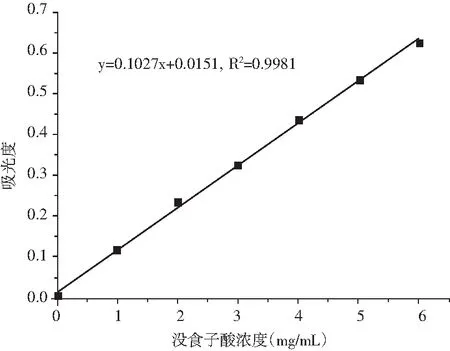
圖1 沒食子酸標準曲線
橫坐標為沒食子酸濃度,縱坐標為765 nm處的吸光度,繪制標準曲線,得到標準曲線回歸方程:y=0.1027x+0.0151,R2=0.9981。
2.1.2 單因素實驗結果
由圖2中(a)可知,青花椒多酚含量隨著提取溫度的升高呈先上升后下降的趨勢,60 ℃時達到峰值,較高的加工溫度提高了細胞壁的滲透性,如果適當地升高溫度,則原料中的蛋白質可以被固化,且酶可以被破壞以增加提取溶液的穩定性,從而使多酚的提取量增加[25-27];但是溫度過高,一些耐熱的活性成分反而會被破壞,同時引起多酚類物質發生氧化反應及聚合反應,其分子結構受到影響,同時容易引起溶劑蒸發損失和其他組分的溶解度增加,多酚提取量下降[28-29]。因此,提取溫度為60 ℃最適宜。
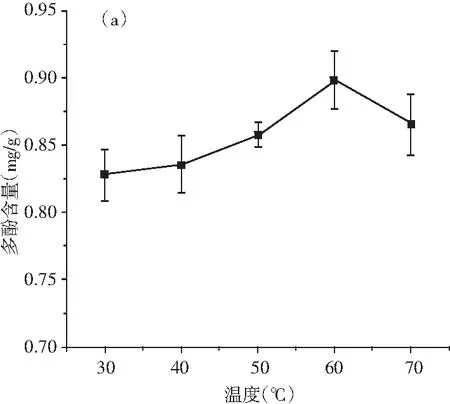
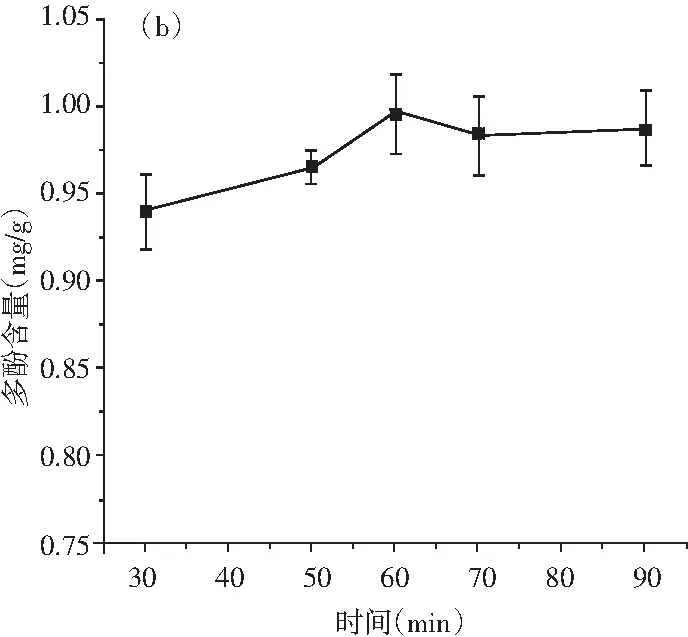
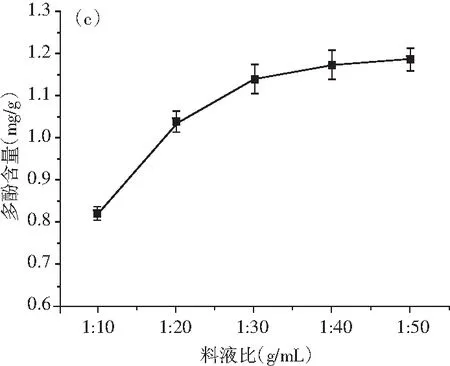
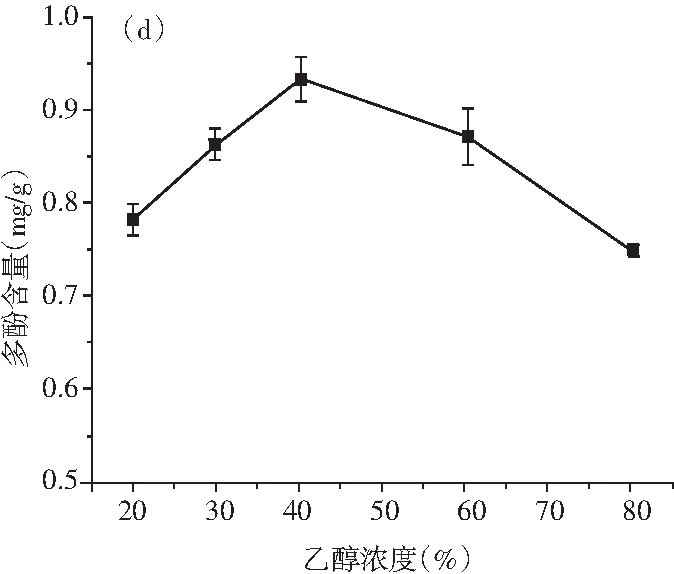
圖2 溫度、時間、料液比、乙醇濃度對青花椒多酚提取量的影響Fig.2 Effects of temperature, time, solid-liquid ratio, ethanol concentration on the extraction amount of polyphenols from Zanthoxylum schinifolium Sieb. et Zucc
由圖2中(b)可知,在多酚提取的初始階段,多酚提取含量增加較快。提取時間在30~60 min階段變化時,曲線的斜率較大,當時間達到60 min時,多酚提取含量最高,隨后逐漸減小,最后多酚含量的增加率趨于平穩,原因可能是提取時間越長,提取物和被提取物的作用時間越長,有利于多酚的釋放,但時間過長時,由于缺乏穩定的多酚,在萃取過程中氧氣會進入,會導致多酚的氧化分解,多酚的提取量降低[30]。因此,選取最優提取時間為60 min。
由圖2中(c)可知,隨著乙醇用量的增加,青花椒多酚提取含量先快速升高后趨于平緩,料液比為1∶10~1∶30時,多酚提取速度增加較快,料液比為1∶30~1∶50時,多酚提取量的增速逐漸緩慢,這是因為多酚類物質會通過氫鍵、疏水鍵結合其他物質,而有機溶劑可以破壞這些結合鍵,因而在一定范圍內,可通過增加溶劑量來促進多酚的溶解[31]。但基于降低實驗成本等角度的考慮,有機溶劑乙醇用量不宜過多,選取1∶30為最適宜的料液比。
由圖2中(d)可知,隨著乙醇濃度的增加,青花椒多酚提取含量呈先升高后下降的趨勢,乙醇濃度達到40%時提取含量最高,之后明顯下降。當溶劑濃度低時,極性強,導致水溶性物質(如糖)的浸出增加,糖和多酚結合降低了多酚提取量,從而影響了多酚的提取。根據相似相溶原理,隨著乙醇濃度的增加,多酚和乙醇的極性越來越近,使多酚的提取量增加,但乙醇濃度過高可使組織中蛋白質變性,而且乙醇濃度過高更加容易揮發,這些都影響多酚類物質的提取效果[32]。考慮到環保問題,選取40%為最適宜的乙醇濃度。
2.2 正交實驗因素水平設計
通過單因素實驗,比較了4種不同水平的因素對青花椒多酚提取率的影響,選取最適提取條件,設計了四因素三水平的正交實驗,見表2。
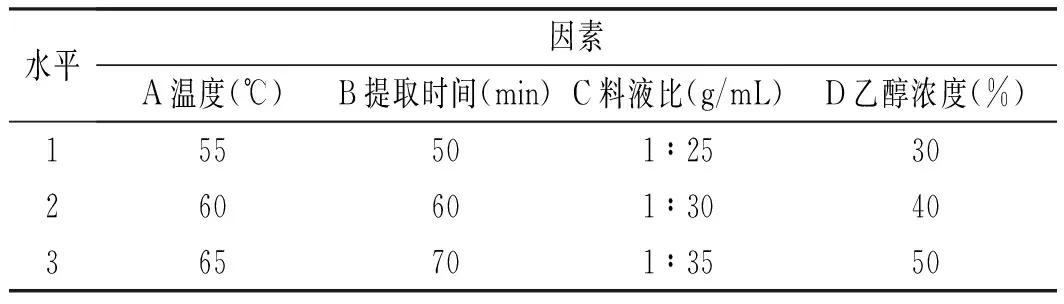
表2 正交實驗因素水平設計Table 2 The factors and levels of orthogonal experiment
2.3 青花椒多酚提取工藝正交實驗設計結果分析
設計L9(34)正交實驗,通過比較K值和R值,得出各因素對青花椒多酚提取率的影響程度為D>C>B>A;結合表2和表3和圖2可知,最佳因素水平組合為A1B2C2D2;由表4可知,正交實驗中的A,B,C,D 4個因素對青椒多酚提取率的影響并不顯著。因此,不再在每個因子級別之間進行多次比較。
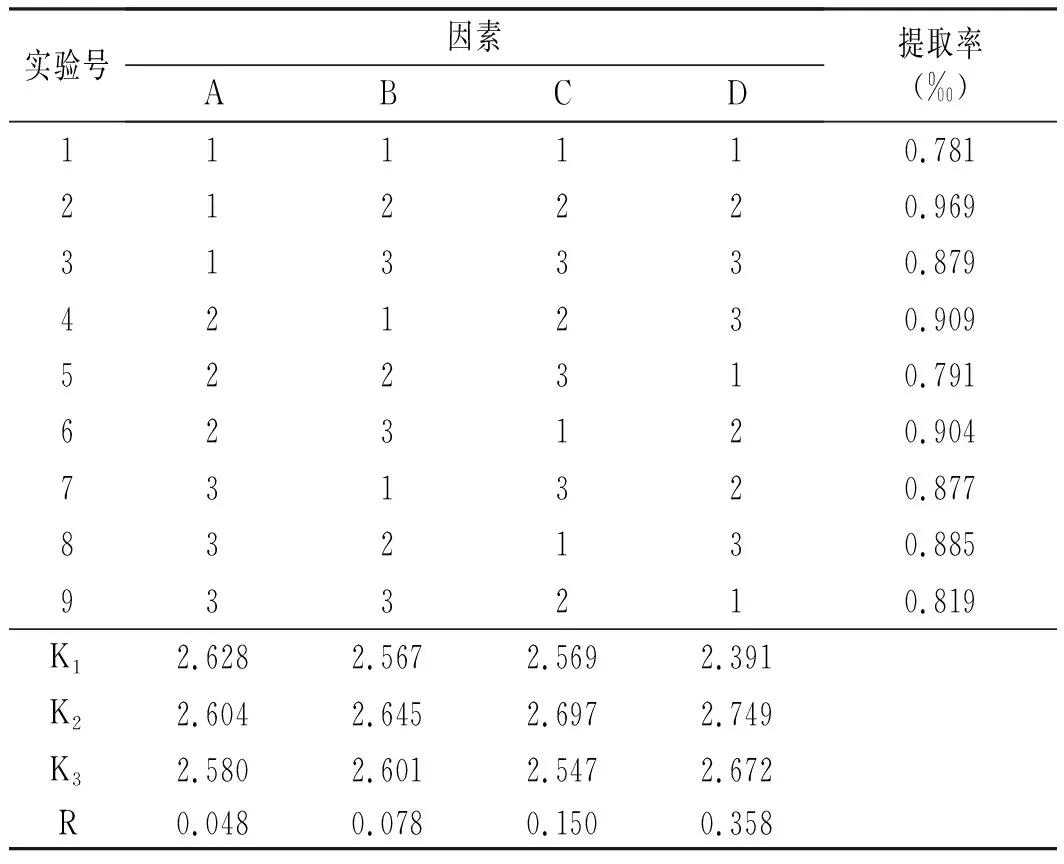
表3 正交實驗方案及結果Table 3 Orthogonal experiment scheme and results
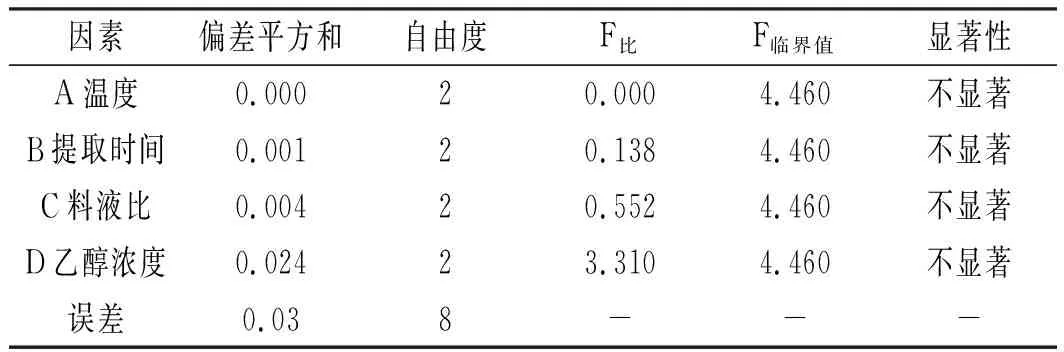
表4 正交實驗結果方差分析Table 4 Analysis of variance of orthogonal experimental results
2.4 青花椒多酚成分測定結果
對應圖3標準品的出峰時間,檢測出圖4青花椒多酚純化物樣品中共含有5種成分:表兒茶素、槲皮素、對香豆酸、山奈酚、阿魏酸,分別將這5種成分在1,5,10,20,40,60 μg/mL濃度下建立標準曲線,根據線性回歸方程得出青花椒多酚純化物成分含量檢測結果,見表5。
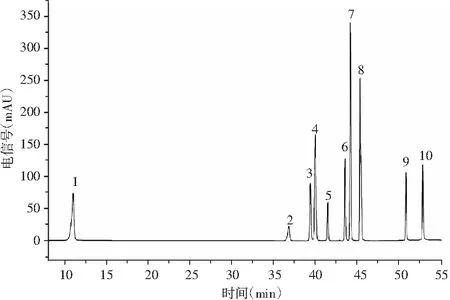
圖3 混合標準品HPLC圖

圖4 青花椒多酚純化物HPLC圖
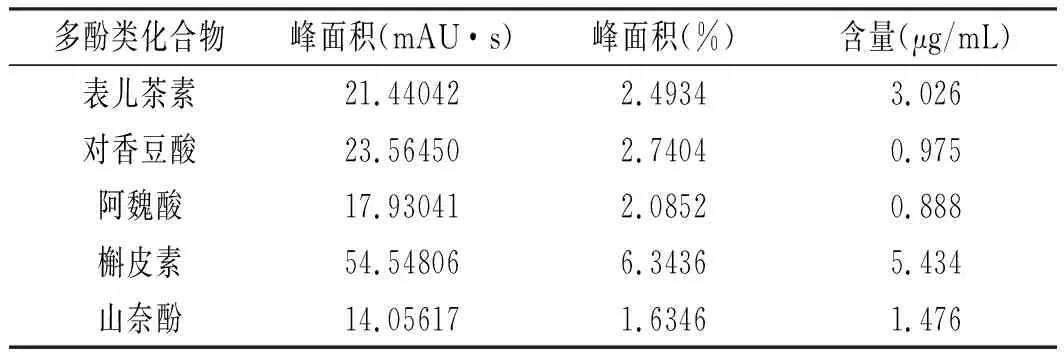
表5 青花椒多酚成分檢測結果Table 5 The determination results of polyphenols from Zanthoxylum schinifolium Sieb. et Zucc
2.5 青花椒多酚抗氧化性測定
由圖5和圖6可知,青花椒多酚DPPH、ABTS+自由基清除能力較強,不難看出青花椒多酚對ABTS+自由基清除能力優于DPPH自由基,當濃度為0.2 mg/mL時,VC、青花椒多酚純化物和青花椒多酚粗提物DPPH自由基清除率分別為93.34%、91.76%、88.11%,ABTS+自由基清除率分別為100%、97.39%、81.47%。無論是青花椒多酚純化物還是粗提物,它們的DPPH自由基清除率略低于Vc,但是,純化物的ABTS+自由基清除率達到97.39%,接近Vc的清除效果;在濃度為0.40 mg/mL時,青花椒多酚純化物的清除率高達99.90%,近似等同于Vc的清除效果,粗提物的清除率為96.91%,接近純化物的清除效果。由此可知,青花椒多酚具有很強的抗氧化能力,并且具有清除ABTS+自由基的強大能力。同樣有研究表明,青、紅花椒提取物抗氧化作用存在差異,其中青花椒提取物脂質過氧化的抑制能力較強,紅花椒提取物DPPH自由基清除率較高。
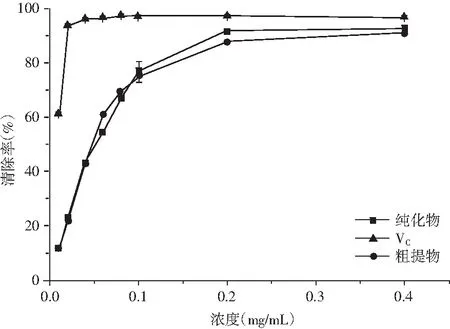
圖5 不同樣品對DPPH自由基的清除率
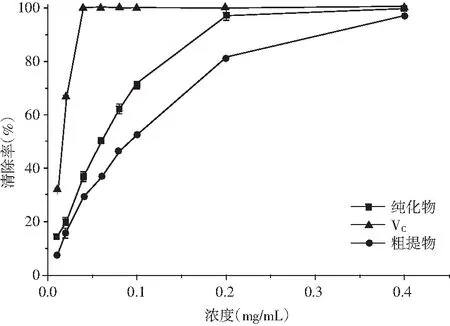
圖6 不同樣品對ABTS+自由基的清除率
3 結論
由單因素實驗結果可知,乙醇濃度對青花椒多酚提取率的影響程度最大,接著是料液比提取時間和溫度,正交實驗得到青花椒多酚的最佳提取工藝:溫度55 ℃,提取時間60 min,料液比1∶30 (g/mL),乙醇濃度40%,得率0.097%。在抗氧化實驗中,DPPH自由基和ABTS+自由基的清除能力依次為Vc>純青椒多酚>粗青椒多酚提取物,隨著樣品濃度的增加,青花椒多酚的DPPH自由基清除能力始終略低于Vc,但青花椒多酚對ABTS+自由基清除能力與Vc相當,甚至有超過Vc的趨勢,這表明青花椒多酚的ABTS+自由基清除能力較強。總之,研究表明青花椒多酚具有很強的抗氧化能力,這說明青花椒多酚具有作為天然抗氧化劑的潛力,以便在各領域中得到應用。

