血清C肽及胰島素抵抗在糖尿病視網膜病變中的應用價值
張娜 王玲 陳玲

【摘要】 目的:分析血清C肽與胰島素抵抗水平對2型糖尿病患者糖尿病視網膜病變(diabetic retinopathy,DR)的預測價值。方法:選取2019年6月-2020年6月就診于遼寧省健康產業集團撫礦總醫院內分泌科的266例2型糖尿病患者。根據是否合并DR分為DR組(n=168)與單純糖尿病組(DM組,n=98)。比較兩組一般資料及實驗室指標,分析DR的影響因素及各影響因素對DR的預測價值。結果:DR組病程、BMI、空腹胰島素(FINS)、糖化血紅蛋白(HbA1c)及胰島素抵抗指數(HOMA-IR)均高于DM組,且空腹C肽(FCP)低于DM組(P<0.05)。病程、BMI、HbA1c、FINS及HOMA-IR是DR的危險因素,FCP是DR的保護因素(P<0.05)。ROC曲線顯示FCP與HOMA-IR的AUC分別為0.779與0.721,均高于其他指標。結論:病程、BMI、HbA1c、FINS及HOMA-IR是DR的危險因素,FCP是DR的保護因素,其中FCP與HOMA-IR對DR具有較高的預測價值。
【關鍵詞】 2型糖尿病 糖尿病視網膜病變 空腹C肽 HOMA-IR
Application Value of Serum C-peptide and Insulin Resistance in Diabetic Retinopathy/ZHANG Na, WANG Ling, CHEN Ling. //Medical Innovation of China, 2021, 18(16): 120-124
[Abstract] Objective: To analyze the predictive value of serum C-peptide and insulin resistance in diabetic retinopathy (DR) in patients with type 2 diabetes. Method: A total of 266 patients with type 2 diabetes who were admitted to the department of endocrinology of Fukuang General Hospital of Liaoning Health Industry Group from June 2019 to June 2020 were selected. The patients were divided into DR group (n=168) and DM group (n=98) according to whether they were complicated with DR. The general data and laboratory indicators of the two groups were compared to analyze the influencing factors of DR and the predictive value of each influencing factor on DR. Result: The duration, BMI, fasting insulin (FINS), hemoglobin A1c (HbA1c) and insulin resistance index (HOMA-IR) in the DR group were higher than those in the DM group, and fasting C-peptide (FCP) was lower than that in the DM group (P<0.05). Duration, BMI, HbA1c, FINS and HOMA-IR were risk factors for DR, and FCP was a protective factor for DR (P<0.05). ROC curve showed that the AUC of FCP and HOMA-IR were 0.779 and 0.721, respectively, which were higher than other indexes. Conclusion: Duration, BMI, HbA1c, FINS and HOMA-IR are risk factors for DR, FCP is protective factor for DR, and FCP and HOMA-IR have higher predictive value for DR.
[Key words] Type 2 diabetes Diabetic retinopathy Fasting C-peptide HOMA-IR
First-author’s address: Postgraduate Training Base of Liaoning Health Industry Group Fukuang General Hospital of Jinzhou Medical University, Fushun 113000, China
doi:10.3969/j.issn.1674-4985.2021.16.029
作為糖尿病重要微血管并發癥之一的糖尿病視網膜病變(diabetic retinopathy,DR),是導致糖尿病患者失明的主要原因[1]。DR的發病機制仍不明確,認為與胰島素抵抗、炎癥狀態等密切有關。也有研究顯示血清C肽除了能加強胰島素功能外,也可對糖尿病所致的微血管病變產生有益影響[2]。由此提出,C肽及胰島素抵抗可能在糖尿病微血管病變發生、發展中起到重要作用[3-4]。而關于C肽及胰島素抵抗與2型糖尿病視網膜病變發生情況的研究尚少,因此本研究探索血清C肽與胰島素抵抗水平在2型糖尿病視網膜病變患者中的應用價值,為早期預防及診治DR提供臨床新思路,現報道如下。
1 資料與方法
1.1 一般資料 選取2019年6月-2020年6月就診于遼寧省健康產業集團撫礦總醫院內分泌科的2型糖尿病患者266例。納入標準:年齡大于18歲;符合WHO糖尿病診斷和2型標準[5]。排除標準:特殊類型糖尿病(如糖尿病合并妊娠或妊娠糖尿病等);合并糖尿病嚴重急性代謝紊亂并發癥(如糖尿病酮癥酸中毒、高滲高血糖綜合征等);合并嚴重心腦血管、肝臟胰腺、腎臟疾病[GFR≤60 mL/(min·1.73 m2)]、惡性腫瘤、血液疾病等嚴重慢性并發癥;合并精神疾病、需要長期應用抗精神病藥物或類似藥物;因某些疾病需要長期應用糖皮質激素;其他各種原因引起的眼病;應用可能影響C肽測定藥物。其中男140例,女126例,年齡40~79歲。所有患者及家屬均知情同意并簽署知情同意書,本研究已經醫院倫理委員會批準。
1.2 方法 收集患者的年齡、糖尿病病程、收縮壓、舒張壓、BMI等一般資料。所有入選患者均于清晨空腹狀態(至少8 h沒有進食熱量)抽取靜脈血液立即送檢空腹血糖(FPG)、空腹C肽(FCP)、空腹胰島素(FINS)、糖化血紅蛋白(HbA1c)等指標。采用穩態模型評估法計算胰島素抵抗指數(HOMA-IR),HOMA-IR=FPG×FINS/22.5;正常參考值為1[6]。由專業經驗豐富的眼科醫師進行常規檢查眼底,根據是否合并DR分為DR組(n=168)與單純糖尿病組(DM組,n=98)。比較兩組一般資料及實驗室指標,分析DR的影響因素及各影響因素對DR的預測價值。
1.3 統計學處理 采用SPSS 26.0軟件對所得數據進行統計分析,計量資料用(x±s)表示,組間比較采用獨立樣本t檢驗;計數資料以率(%)表示,比較采用字2檢驗。采用logistic回歸分析DR的影響因素。繪制ROC曲線分析各指標對DR的預測價值。以P<0.05為差異有統計學意義。
2 結果
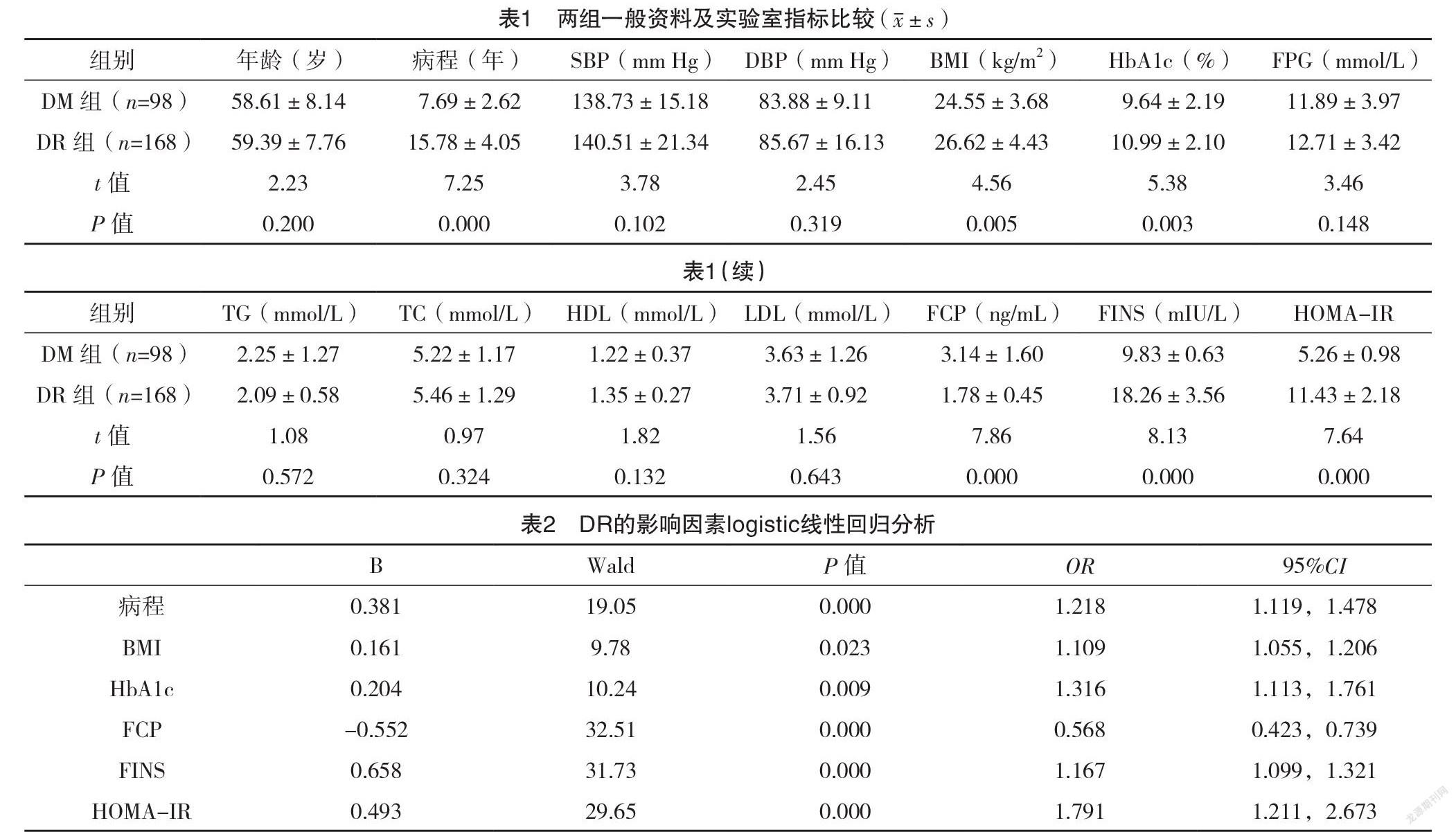
2.1 兩組一般資料及實驗室指標比較 DR組病程、BMI、HbA1c、FINS及HOMA-IR均高于DM組,且FCP低于DM組,差異均有統計學意義(P<0.05),見表1。
2.2 DR的影響因素logistic線性回歸分析 以DR為因變量,以病程、BMI、FCP、HbA1c、FINS、HOMA-IR為自變量,進行logistic 回歸分析。結果顯示糖尿病病程、BMI、HbA1c、FINS及HOMA-IR是DR的危險因素,FCP是DR的保護因素(P<0.05)。見表2。
2.3 各指標對2型糖尿病視網膜病變的預測價
值 FCP、HOMA-IR、HbA1c、病程、BMI、FINS預測DR的AUC分別為0.779、0.721、0.598、0.565、0.558、0.533,其中FCP與HOMA-IR的AUC更高,FCP的敏感度為79.6%,特異度為64.3%;HOMA-IR的敏感度為71.0%,特異度為69.4%。見圖1。
圖1 各指標預測2型糖尿病視網膜病變的ROC曲線
3 討論
糖尿病視網膜病變的發生發展受多種因素的影響,研究認為其與高血糖、胰島素抵抗、氧化應激、炎癥狀態、血管內皮功能紊亂等多種因素有關。胰島素抵抗和胰島β細胞功能障礙是2型糖尿病糖代謝紊亂的兩個重要危險因素[7]。C肽作為胰島素原的裂解產物,最初僅用于評估胰島β細胞功能,目前國內外大量研究發現,C肽可與細胞膜特異性結合,具有多種生物活性,在預防及治療糖尿病并發癥過程中有十分重要的作用[8-9]。
本研究發現,DR組FCP低于DM組(P<0.05),與Kuo等[10]研究一致。FCP是DR的保護因素(P<0.05),分析其原因可能是:C肽可降低糖尿病患者餐后高血糖,也可發揮與胰島素的協調作用,增強血糖控制,減少高血糖導致的血管破壞。同時C肽水平的下降可降低過氧化氫酶的表達,促進氧化應激,使β細胞更容易破壞和死亡,從而引起或加重分泌功能障礙、糖尿病及其并發癥的發生[11]。同時,C肽還可與細胞膜上的G蛋白耦聯受體結合,激活Na+-K+-ATP酶的同時,也激活一氧化氮合成酶,改善內皮細胞通透性,改善微血管血流及神經功能障礙[12-14]。在糖尿病患者組織中,C肽可通過激活AMP活化蛋白激酶α抑制細胞內活性氧(ROS)介導的內皮細胞凋亡來改善內皮功能障礙[15-16]。C肽還可以改善紅細胞變形能力,進而改善組織缺氧,抑制DR的發生與進展。本研究結果顯示,DR組HOMA-IR水平較DM組升高,HOMA-IR是DR的危險因素(P<0.05),分析其原因,HOMA-IR可引起C反應蛋白、腫瘤壞死因子及前列腺素等炎癥因子釋放增加,導致白細胞的黏附和聚集,從而引起視毛細血管阻塞,視毛細血管退化,最后局部缺血[17]。隨著胰島素抵抗程度的增加,脂肪細胞游離脂肪酸及血漿中的二甲基精氨酸表達均增加,而兩者可抑制內源性一氧化氮合成酶的激活,使血管自身舒縮失調,微循環障礙[18]。同時糖尿病患者由于視網膜毛細血管通透性增加,血管生長因子可滲漏進入視網膜組織中,從而促使新生血管生成,導致糖尿病視網膜病變。而HOMA-IR可促進視網膜血管內皮生長因子的表達,故其可能在某種程度上導致或加重糖尿病視網膜病變。與此同時,纖溶酶原激活物抑制劑-1(PAI-1)在HOMA-IR時表達也顯著增加[19]。而PAI-1可選擇性地抑制某些舒張血管的作用,引起毛細血管的閉塞,導致缺血、新生血管生成等。ROC曲線顯示FCP和HOMA-IR的AUC均高于其他指標,FCP的敏感度與特異度分別為79.6%、64.3%;HOMA-IR的敏感度與特異度分別為71.0%、69.4%;FCP、HOMA-IR對DR的篩查均具有一定的診斷價值,FCP敏感度較高原因可能與外源性的胰島素對C肽的分泌不造成干擾,其可以明確機體自身所產生的胰島素量;特異度略低可能是C肽也是內分泌系統腫瘤、胃泌素瘤、多囊卵巢綜合征等疾病的高危風險因子。
綜上所述,FCP水平越低,HOMA-IR水平越高,糖尿病視網膜病變的風險越大,FCP及HOMA-IR有可能作為2型糖尿病患者罹患視網膜病變的風險評估指標。但糖尿病視網膜病變發病機制極其復雜,非常有必要更進一步深入研究FCP及HOMA-IR在糖尿病視網膜病變中所發揮的作用及其機制。本研究還缺乏長期及動態觀察分析FCP、HOMA-IR與2型糖尿病視網膜病變的關系,仍存在一定的局限性,還需要更大樣本、更長期的臨床試驗來進一步研究驗證這一觀點。
參考文獻
[1] Hill L,Makaroff L E.Early detection and timely treatment can prevent or delay diabetic retinopathy[J].Diabetes Research & Clinical Practice,2016,120:241-243.
[2] Brunskill N J.C-peptide and diabetic kidney disease[J].J Intern Med,2017,281(1):41-51.
[3] Bhatt M P,Lim Y C,Hwang J,et al.C-Peptide Prevents Hyperglycemia-Induced Endothelial Apoptosis Through Inhibition of Reactive Oxygen Species-Mediated Transglutaminase 2 Activation[J].Diabetes,2013,62(1):243-253.
[4] Wang Y,Wan H,Chen Y,et al.Association of C-peptide with diabetic vascular complications in type 2 diabetes[J].Diabetes Metab,2020,46(1):33-40.
[5] American Diabetes Association.Classification and Diagnosis of Diabetes:Standards of Medical Care in Diabetes-2019[J].Diabetes Care,2019,42(Suppl 1):S13-S28.
[6]中華醫學會眼科學會眼底病學組.我國糖尿病視網膜病變臨床診療指南(2014年)[J].中華眼科雜志,2014,50(11):851-865.
[7] Ismail-Beigi F,Craven T,Banerji M A,et al.Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes:an analysis of the ACCORD randomised trial[J].Lancet,2010,376(9739):419-430.
[8] Wahren J,Larsson C.C-peptide:New findings and therapeutic possibilities[J].Diabetes Research & Clinical Practice,2015,107(3):309-319.
[9] Leighton E,Sainsbury C A,Jones G C.A Practical Review of C-Peptide Testing in Diabetes[J].Diabetes Therapy,2017,8(3):475-487.
[10] Kuo J Z,Guo X,Klein R,et al.Association of fasting insulin and C peptide with diabetic retinopathy in Latinos with type 2 diabetes[J].BMJ Open Diabetes Research or Care,2014,2(1):e000027.
[11] Luppi P,Drain N,To R,et al.Autocrine C-peptide protects INS1 β cells against palmitic acid-induced oxidative stress in peroxisomes by inducing catalase[J].Endocrinol Diabetes Metab,2020,3(3):e00147.
[12] Kolar G R,Grote S M,Yosten G L.Targeting orphan G protein-coupled receptors for the treatment of diabetes and its complications:C-peptide and GPR146[J].J Intern Med,2017,281(1):25-40.
[13] Essid S M, Bevington A, Brunskill N J.Proinsulin C-Peptide Enhances Cell Survival and Protects against Simvastatin-Induced Myotoxicity in L6 Rat Myoblasts[J].Int J Mol Sci,2019,20(7):1654.
[14] Bhatt M P,Lim Y C,Kim Y M,et al.C-peptide activates AMPKαand prevents ROS-mediated mitochondrial fission and endothelial apoptosis in diabetes[J].Diabetes,2013,62(11):3851-3862.
[15] Lim Y C,Bhatt M P,Kwon M H,et al.Proinsulin C-Peptide Prevents Impaired Wound Healing by Activating Angiogenesis in Diabetes[J].Journal of Investigative Dermatology,2015,135(1):269-278.
[16] Hills C E,Brunskill N J.Cellular and physiological effects of C-peptide[J].Clinical Science,2009,116(7):565-574.
[17] Fain J N.Release of interleukins and other inflammatory cytokines by human adipose tissue is enhanced in obesity and primarily due to the nonfat cells[J].Vitam Horm,2006,74:443-477.
[18] Artunc F,Schleicher E,Weigert C,et al.The impact of insulin resistance on the kidney and vasculature[J].Nature Reviews Nephrology,2016,12(12):721-737.
[19] Jin R,Krasinskas A,Le N A,et al.Association between plasminogen activator inhibitor-1 and severity of liver injury and cardiovascular risk in children with non-alcoholic fatty liver disease[J].Pediatric Obesity,2016,13(1):23-29.
(收稿日期:2021-04-25) (本文編輯:田婧)

