小細胞肺癌可視化PDOX腫瘤動物模型免疫表型Ki-67表達的研究進展
吳柳盛 李小強

【摘要】 小細胞肺癌(SCLC)是肺癌所有病理類型中預后最差的一種,患者生存周期極短,死亡率極高。雖然SCLC對化療藥物敏感,臨床上抗腫瘤藥物治療成為主流,但有循證醫學研究發現在臨床中不同的患癌個體之間對抗腫瘤藥物的敏感性和耐受性存在著差異,這給臨床治療帶來了困難和挑戰。因此,人們急需要一種能高度模擬體內腫瘤細胞生長微環境,能與患者進行同步化動態觀察抗腫瘤藥物應答的理想動物模型。可視化PDOX腫瘤動物模型滿足了這些需求,這也是目前國際上最前沿的腫瘤動物模型構建技術,避免了個體差異,為臨床治療提供了個性化思路,同時Ki-67免疫表型表達的監測為早期SCLC的診斷提供了有效幫助。現對最近國內外SCLC可視化PDOX腫瘤動物模型構建技術和免疫表型Ki-67表達監測的研究進展以及該模型對臨床上不同個體之間抗腫瘤藥物應答差異做全面綜述。
【關鍵詞】 小細胞肺癌 可視化PDOX腫瘤動物模型 Ki-67
[Abstract] Small cell lung cancer (SCLC) has the worst prognosis among all pathological types of lung cancer. The survival cycle of patients is very short and the mortality rate is very high. Although SCLC is sensitive to chemotherapy drugs and anti-tumor drug therapy has become the mainstream in clinical practice, evidence-based medicine studies have found that there are differences in the sensitivity and tolerance of anti-tumor drugs among different cancer patients in clinical practice, which brings difficulties and challenges to clinical treatment. Therefore, there is an urgent need for an ideal animal model that can highly simulate the microenvironment of tumor cell growth in vivo and can dynamically observe the response to antitumor drugs in synchronization with patients. Visualized PDOX tumor animal model meets these needs, which is also the most advanced tumor animal model construction technology in the world at present. It avoids individual differences and provides personalized ideas for clinical treatment. Meanwhile, the monitoring of Ki-67 immunophenotype expression provides effective help for the diagnosis of early SCLC. In this paper, the research progress of visualized PDOX tumor animal model construction technology and immunophenotype Ki-67 expression monitoring of SCLC at home and abroad, as well as the clinical differences of anti-tumor drug response among different individuals in this model are comprehensively reviewed.
[Key words] SCLC Visualized PDOX tumor animal model Ki-67
First-author’s address: Peking University Shenzhen Hospital, Shenzhen 518036, China
doi:10.3969/j.issn.1674-4985.2021.25.042
小細胞肺癌(small cell lung cancer,SCLC)占全部肺癌的15%~17%[1],病情惡化快,可迅速出現遠處內臟腫瘤轉移,生存壽命短,死亡率極高,同時在臨床上不同腫瘤患者個體之間存在著抗腫瘤藥物的耐受差異,給臨床治療與療效評估帶來了困難。目前,小細胞肺癌發病率居高不下,而臨床治療效果不明確,所以可視化PDOX小細胞肺癌動物模型的構建對于其病因學研究和臨床抗腫瘤藥物耐受機制研究顯得相關重要。實驗對象多為免疫缺陷小鼠(裸鼠)典型代表,普通小鼠具有NK細胞和T淋巴細胞等存在免疫排斥,移植效果差。目前可通過綠色熒光蛋白(GFP)的腫瘤在小鼠體內動態生長的無創成像技術[2]。這種方法既能夠更加準確地復制患者腫瘤的發生發展,生物學行為和抗腫瘤治療藥物應答,也能夠有效避免動物倫理學問題,促進了臨床上小細胞肺癌患者個性化和精準化抗癌治療,提升治療效果,降低毒副作用和治療費用,并且小細胞肺癌病情發展迅速,如果沒有進行早期診斷和及時化療,患者會因為小細胞肺癌的遠處轉移迅速死亡[3]。因此,在臨床中探索無創普遍簡便迅速的檢查來確診早期SCLC具有十分重要的意義。本文探討Ki-67與SCLC臨床特征關系,免疫組化染色以細胞質或細胞核出現背景清晰的黃色或棕黃色顆粒為陽性表達,其中Ki-67著色部位在細胞核,免疫組化是確診SCLC的重要方法之一。在檢索諸多文獻資料中發現3/4的SCLC患者Ki-67指數≥60%,因此,筆者猜測Ki-67≥60%對于臨床分期及評估預后具有一定的指導意義。
1 體內外腫瘤模型的發展演變歷程(從腫瘤細胞2D培養模型到可視化PDOX腫瘤動物模型的跨越)
PDOX腫瘤動物模型構建技術還很年輕,是最近幾年才發展起來的一門新技術。早在1986年Freeman等[4]研究證明了腫瘤組織在體外培養條件下,可以長期存活并維持類似體內的腫瘤微環境,奠定了PDOX模型構建的基礎,使得培養的腫瘤成了實際癌癥患者的代表,支持腫瘤生物學的基礎研究以及臨床相關藥物測試。隨著技術的不斷完善和發展,PDOX腫瘤動物模型構建正在不斷向臨床診療方向靠攏。Higuchi等[5]成功構建體外PDOX模型與臨床腫瘤患者進行同步化觀察,這兩者的結合促進了對因腫瘤異質性和腫瘤微環境異質性而導致抗腫瘤藥物耐受性個體差異及效果不確定性的機制研究。對于了解體內外腫瘤動物模型構建的發展歷程有利于新技術的研發和完善。
1.1 體外腫瘤細胞2D培養 文獻[6-7]報道了一個可量化的3D肺癌模型,并通過全基因組CRISPR篩選發現2D肺癌細胞培養與3D肺癌模型之間存在的基因差異,尤其是突變基因的差異巨大。體外腫瘤細胞2D培養方法:通過組織消化獲取腫瘤細胞(原代細胞),然后進行體外傳代擴增(2D)和體外給藥觀察,最后再利用ATP-TCA檢測獲取結果。
1.2 體外腫瘤細胞3D培養 Rodrigues等[8]利用腫瘤細胞體外立體三維結構進行傳代培養,雖說開發了一個可量化的3D原發惡性腫瘤球狀模型,但仍然不能形成與體內類似的三維空間結構。體外腫瘤細胞3D培養方法:同樣通過組織消化獲取腫瘤細胞(原代細胞),然后再進行基質膠進行包埋和3D支架誘導擴增培養,最后在利用ATP-TCA檢測獲取結果。
1.3 體內腫瘤細胞包埋培養 張曉斌等[9]利用沉渣包埋技術來進行體內腫瘤細胞的培養,這種培養技術在很早就應用實施了,該種建模成本比較低,同時操作簡便,但缺點就是無法貼近臨床上腫瘤患者的真實情況。體內腫瘤細胞包埋培養方法:組織消化獲取原代腫瘤細胞,然后用專門的裝置將腫瘤細胞埋入小鼠體內,最后再利用ATP-TCA檢測獲取結果。
1.4 類器官培養 北京協和醫院的周魯林[10]提出建立一種循環腫瘤干細胞的3D類器官培養技術,以及基于微流控液滴的單細胞分離和標記技術,通過上述同樣的方法進行3D類器官培養,成功培養獲得肺癌的腫瘤細胞微球。類器官培養方法:組織消化獲取腫瘤細胞(干性細胞),然后體外細胞因子調控培養來構建類器官,最后再利用ATP-TCA檢測獲取結果。
1.5 活組織體外培養(3D-histoculture drug response assay ,3D-HDRA) 將手術切除或活檢獲取的活性腫瘤組織塊,經體外培養后,進行抗腫瘤藥物試驗的獨特體內外腫瘤活組織器官模型。3D-HDRA維持了腫瘤組織體外的三維立體生長方式,能夠更精準地模擬腫瘤細胞生長微環境,對于研究腫瘤之間信息傳導以及新的靶向藥物研發具有更多的優勢[11-13]。
1.6 異種移植物(PDX)體內腫瘤細胞培養 SCLC患者來源的PDX可以通過活檢或循環腫瘤細胞(CTC)產生。Drapkin等[14]利用已建立的用于組織采集的臨床平移管道和用于CTC濃縮的自動化微流控平臺,成功構架小細胞肺癌(SCLC)的PDX培養,證明這些模型中供體腫瘤的突變景觀和功能特征。
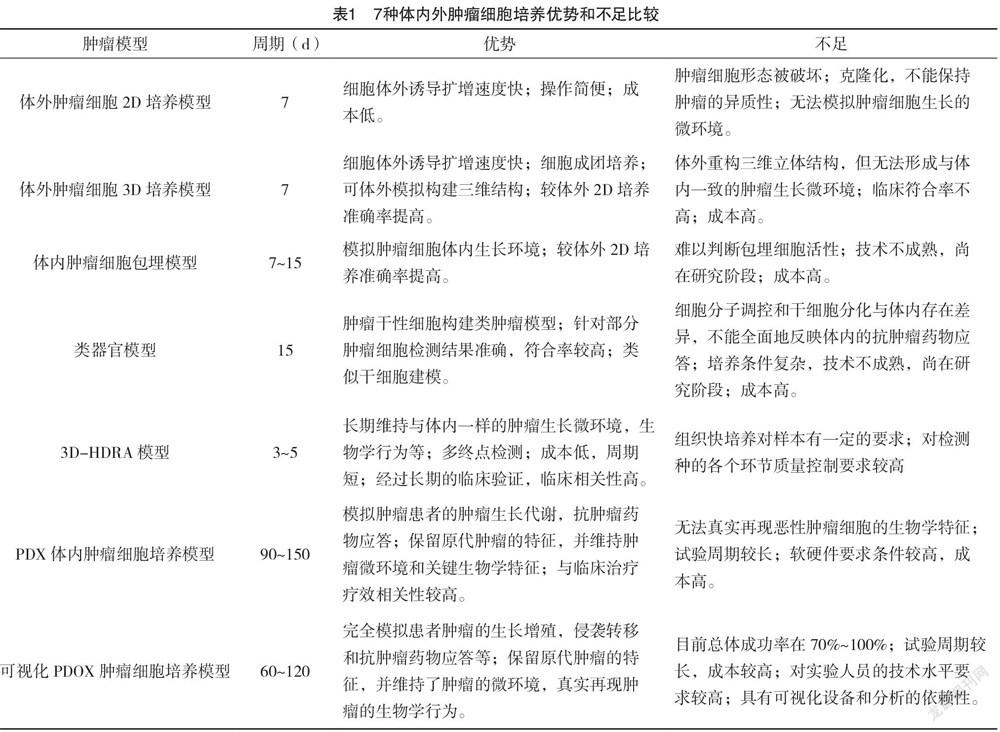
1.7 可視化PDOX體內腫瘤細胞培養 目前腫瘤動物模型構建的最前沿的技術:可視化PDOX腫瘤模型構建,即通過對裸鼠進行腫瘤細胞的原位器官移植,無限性地模擬患者機體內腫瘤的動態環境變化[15-17]。利用綠色熒光蛋白(GFP)/熒光素酶(Luc)的活體成像技術等,可視化地觀察動物模型體內腫瘤的生長情況[18-19]。該模型的構建極大地推動了臨床腫瘤個性化治療和精準治療,特別是SCLC術后化療中不同個體對抗腫瘤藥物的耐受機制的研究。上述7種體內外腫瘤細胞培養優勢和不足比較見表1。
2 SCLC可視化PDOX腫瘤動物模型的應用
隨著可視化PDOX腫瘤動物模型的技術的不斷完善和發展,越來越多臨床上惡性腫瘤模型成功構建,這對于腫瘤患者的抗腫瘤治療的藥物篩選和療效評估具有重大的現實意義。可視化PDOX腫瘤動物模型在乳腺癌以及前列腺癌領域較為常用,但在小細胞肺癌領域很少報道。而SCLC具有轉移早,進展快的特點,這就需要在很短的時間內進行有效化療,還需要觀察患者對某一種化療藥物療效如何以及其毒副作用評估,同時克服不同SCLC患者之間的個體差異,而SCLC可視化PDOX小細胞肺癌模型的出現為臨床治療提供一個個性化治療的手段[19]。
2.1 SCLC可視化PDOX裸鼠模型的構建 裸鼠是腫瘤動物模型中最常用的一種免疫缺陷小鼠。李一鳴[20]構建個體化裸鼠荷人肺癌動物模型腫瘤組織的基因突變和表達狀況各不相同,進一步證實其具備個體化特征,該動物模型可作為今后研究肺癌個體化治療的工具。張楨等[21]利用裸鼠構建SCLC動物模型來檢測S100A2的陽性表達。但當時的建模技術還沒有采用可視化PDOX模型技術,在國外應用比較多。Kiyuna等[22]采用綠色熒光蛋白技術(GFP)建立PDOX裸鼠模型來研究惡性腫瘤的動態演變,這種模型無創且避免動物的倫理學問題,也是目前國內外最為推崇的腫瘤動物模型。
2.2 SCLC可視化PDOX SCID小鼠模型的構建 SCID小鼠是有自發重癥聯合免疫缺陷突變的白化品系,這種突變使得T細胞和B細胞的發育成熟受到限制。SCID小鼠模型具有T淋巴細胞與B淋巴細胞聯合功能缺失的優勢,同時該模型在腫瘤學、免疫學、微生物學、生殖醫學等領域研究中得到廣泛應用,是PDOX模型的良好宿主[23-25]。
2.3 SCLC可視化PDOX NOD-SCID小鼠模型的構建 與普通SICD相比NK細胞活性低,具有更低的免疫恢復概率。NOD-SCID小鼠既有先天免疫缺陷,又有T淋巴細胞和B淋巴細胞缺乏的特征,適合腫瘤細胞植入培養,同樣也是可視化PDOX小細胞肺癌理想的建模對象[26-27]。
2.4 SCLC可視化PDOX CBA/N小鼠模型的構建 CBA/N小鼠B淋巴細胞功能缺陷,位于X性染色體上xid基因出現缺陷突變。CBA/N小鼠對非胸腺依賴性Ⅱ型抗原沒有體液免疫反應[27]。該類小鼠雖也是免疫缺陷,比較適合B淋巴細胞血液腫瘤的研究,但不適合應用于小細胞肺癌(SCLC)動物模型的構建。
2.5 SCLC可視化PDOX Beige (bg)小鼠模型的構建 bg小鼠是細胞活性缺陷的突變系小鼠,在第13號染色體上的隱性遺傳基因bg發生突變引起[28]。該類模型的NK細胞功能缺陷,其免疫抗腫瘤殺傷作用比較弱,缺乏細胞毒性T細胞功能,并且對同種或異種腫瘤細胞的體液免疫功能減弱,欠缺巨噬細胞的抗腫瘤活性等。該類模型對各種致病因子較敏感,需良好SPF環境[29]。上述5種可視化PDOX小細胞肺癌(SCLC)實驗對象模型的優勢與不足比較見表2。
3 免疫表型Ki-67在小細胞肺癌中表達的監測應用
小細胞肺癌(SCLC)治療手段單一且缺少有效的療效預測指標[30-31],而Ki-67在多種惡性腫瘤中呈高表達狀態,也是細胞增殖常用的檢測指標,并可作為療效預測指標。
Ki-67對于患者來講,所長組織是良性或者惡性,其增殖情況有所不同,它通常在腫瘤良惡性的鑒別和腫瘤增殖的情況當中有所使用,比如對于免疫組化的輔助診斷和日后的判定;通常情況下,良性腫瘤大概增殖大于5%或者小于10%左右,惡性腫瘤一般情況下細胞增殖大于10%,但是有一些低度惡性的腫瘤,其Ki-67的表達率可能低于5%,大部分情況Ki-67的增殖,隨著腫瘤細胞的惡性程度增高而增加;其功能與有絲分裂密切相關,在細胞增殖中是不可缺少,但其確切機制尚不清楚。
3.1 Ki-67在臨床SCLC患者中的監測應用 早期數據表明,如果確診后未進行積極治療,SCLC患者的生存期僅為2~4個月[32]。近年來SCLC患者的生存期略有改善,局限期和廣泛期患者的中位生存期分別為15~20個月和8~13個月[33]。SCLC的診斷和治療已進入分子分型時代,但SCLC分期仍遵循美國退伍軍人肺癌協會標準[34]。將SCLC分為局限期和廣泛期,尚缺乏有效的指導預后的標志物,臨床迫切希望能夠有更加細致的指標用于指導SCLC的治療及監測預后。SCLC是神經內分泌腫瘤的重要組成部分,但目前尚未將Ki-67納入SCLC的分型及預后評估。有研究發現,當Ki-67數≥60%時,疾病進展快,惡性程度高,預后不佳,由此提出將Ki-67是否大60%定為臨床分期及評估預后的界限。
3.2 小細胞肺癌Ki-67在實驗腫瘤模型中的監測應用 馬連君等[35]采用組織塊懸液注射法構建肺內腫瘤種植模型,觀察該腫瘤動物模型在不同時間點腫瘤細胞Ki-67陽性率。文獻[36]報道想要探究小細胞肺癌臨床化療中G31P和吉非替尼的抑制機制和療效評估,就利用熒光技術來檢測裸鼠模型SCLC組織的Ki-67表達水平,充分地體現了SCLC與Ki-67免疫表達存在有統計學意義的相關性,對SCLC的早期免疫診斷以及療效預測提供了新的思路。
4 可視化PDOX小細胞肺癌腫瘤動物模型與免疫表型Ki-67表達檢測的組合應用
現在很多實驗研究越來越傾向于將多種擁有特征的動物模型融合成一個更具有完善性和兼容性的標準化腫瘤動物模型,這種模型的好處就是能從一開始在臨床上模擬患者早期腫瘤診斷,同時觀察患者體內腫瘤病情的發展狀況,給予該類腫瘤動物模型藥物治療,觀察其藥物反應,毒副作用,免疫應答以及療效評估[37-40]。總而言之,就是能高度還原該小細胞肺癌患者腫瘤體外發生發展的全過程,這樣對于臨床的治療比較有精準化和整體化。同時,也能夠幫助腫瘤患者進行化療時對于抗腫瘤藥物的篩選,節省很多時間,避免了化療后期出現耐藥再盲目性隨機試驗性治療的風險,極大地為小細胞肺癌患者爭取了治療時間,使得在小細胞肺癌在發生轉移前進行有效的免疫檢查點的抑制干預,從而提高腫瘤患者的生存率。
目前,SCLC的早期臨床診斷方式多為免疫組化的方式[41]。有很多文獻數據分報道和循證醫學驗證Ki-67表達陽性率與SCLC存在有診斷價值的相關性,且在預測患者1年生存率方面具有一定的價值,可為臨床評估腫瘤侵襲及預后提供循證支持[42];SCLC可視化PDOX模型構建方向是為了高度模擬臨床腫瘤患者個體情況以及藥物篩選和藥物應答機制研究,前者運用于早期小細胞肺癌快速診斷,后者運用于臨床抗腫瘤藥物個性化治療。兩者的結合模型構建極大地促進臨床腫瘤化療的時效性和新的靶向藥物的研發[43-44]。
雖然很多腫瘤動物模型的兼容性不佳,存在很多特異性較差,有建模效果不理想的情況,存在實驗對象的匹配性的篩選整合難度大以及試驗方法的改進完善,但是我相信在未來還有更多特征的標準化腫瘤動物模型進行融合構建,研究人員正在不斷地探索多方位的腫瘤動物模型的構建技術,這也是一種前沿可視化PDOX腫瘤動物模型構建技術的發展趨勢[45]。
5 總結
Ki-67陽性表達率升高均參與SCLC的發生發展,同時SCLC腫瘤侵襲轉移特性存在密切相關性,有利于SCLC的早期診斷和預后評估;另外它們作為腫瘤的潛在標志物,將會成為推動SCLC研究進展的新動力,同樣可視化PDOX腫瘤動物模型將會是它表達驗證的一個理想載體。該模型的構建技術是現在國際上認可的最為前沿的腫瘤動物模型,技術的不斷進展,更多綜合干擾因素的排除,更多優勢的整合,一個更貼近臨床患者的體外腫瘤細胞生長微環境培養技術在不斷完善和提高[46]。有相關研究進一步通過隨訪發現通過檢測Ki-67的陽性表達情況,可能用于SCLC患者預后評估,有可能成為SCLC患者診斷治療的新靶點[47]。通過建立人SCLC的模型,探討其用于人SCLC的治療研究的可行性,同時為人SCLC實驗性治療的研究提供一種高效的實驗模型。該標準化動物模型的成功構建將會進一步地深入研究臨床中SCLC患者個體之間的藥物耐藥機制和藥物免疫應答研究,能夠在早期對SCLC患者進行干預治療,達到精準醫療的效果,為臨床醫生提供更加個性化診療思路,大大降低患者的死亡率,延長其生存周期。
參考文獻
[1]王中玉,史清明.154例小細胞肺癌預后因素分析[J].臨床肺科雜志,2018,23(9):1572-1577.
[2]柏文,彭曉清,王佩文,等.GFP/Luc雙標食管癌細胞動物模型建立及其活體成像觀察[J].中國比較醫學雜志,2018,28(11):89-94.
[3]李向敏,許瑤琳,于莉,等.52例小細胞肺癌免疫組化表型的臨床特點分析[J].中國醫科大學學報,2017,46(5):460-462.
[4] Freeman A E,Hoffman R M.In vivo-like growth of human tumors in vitro[J].Proc Natl Acad Sci USA,1986,83(8):2694-2698.
[5] Higuchi T,Sugisawa N,Miyake K,et al.Combination Treatment With Sorafenib and Everolimus Regresses a Doxorubicin-resistant Osteosarcoma in a PDOX Mouse Model[J].Anticancer Res,2019,39(9):4781-4786.
[6] Souza A G,Silva I B B,Campos-Fernandez E,et al.Comparative Assay of 2D and 3D Cell Culture Models:Proliferation,Gene Expression and Anticancer Drug Response[J].Curr Pharm Des,2018,24(15):1689-1694.
[7] Han K,Pierce S E,Li A,et al.CRISPR screens in cancer spheroids identify 3D growth-specific vulnerabilities[J].Nature,2020,580(7801):136-141.
[8] Rodrigues T,Kundu B,Silva-Correia J,et al.Emerging tumor spheroids technologies for 3D in vitro cancer modeling[J].Pharmacol Ther,2018,184:201-211.
[9]張曉斌,楊勇,趙玲玲,等.胸腹水細胞包埋并進行免疫組化標記對良惡腫瘤的診斷與臨床指導的意義[J].世界最新醫學信息文摘,2015,15(74):111-112.
[10]周魯林.循環腫瘤干細胞類器官培養技術以及單細胞分離標記技術的建立[D].北京:北京協和醫學院,2019.
[11] Hoffman R M,Vescio R A.Development of the Histoculture Drug Response Assay(HDRA)[J].Methods Mol Biol,2018,1760:39-48.
[12] Hoffman R M.Clinical Correlation of the Histoculture Drug Response Assay in Gastrointestinal Cancer[J].Methods Mol Biol,2018,1760:61-72.
[13] Ohashi T,Yoshimasu T,Oura S,et al.ClassⅢ Beta-tubulin Expression in Non-small Cell Lung Cancer:A Predictive Factor for Paclitaxel Response[J].Anticancer Res,2015,35(5):2669-2674.
[14] Drapkin B J,George J,Christensen C L,et al.Genomic and Functional Fidelity of Small Cell Lung Cancer Patient-Derived Xenografts[J].Cancer Discov,2018,8(5):600-615.
[15] Hoffman R M.Patient-Derived Orthotopic Xenograft(PDOX)Models of Melanoma[J].Int J Mol Sci,2017,18(9):1875.
[16] Jiang T,Shi T,Zhang H,et al.Tumor neoantigens:from basic research to clinical applications[J].J Hematol Oncol,2019,12(1):93.
[17] Tsoukalas N,Aravantinou-Fatorou E,Baxevanos P,et al.Advanced small cell lung cancer(SCLC):new challenges and new expectations[J].Ann Transl Med,2018,6(8):145.
[18] O’Neill K,Lyons S K,Gallagher W M,et al.Bioluminescent imaging:a critical tool in pre-clinical oncology research[J].J Pathol,2010,220(3):317-327.
[19]崔鶴滕,徐建明.肺神經內分泌腫瘤診療進展[J].中國腫瘤臨床與康復,2019,26(1):125-128.
[20]李一鳴.個體化裸鼠荷人肺癌動物模型的基因檢測[D].天津:天津醫科大學,2013.
[21]張楨,程哲,蔣天賜,等.裸鼠肺癌移植瘤中S100A2表達的研究[J].中國實用醫刊,2016,43(24):5-7.
[22] Kiyuna T,Tome Y,Murakami T,et al.Tumor-targeting Salmonella typhimurium A1-R arrests a doxorubicin-resistant PDGFRA-amplified patient-derived orthotopic xenograft mouse model of pleomorphic liposarcoma[J].J Cell Biochem,2018,119(9):7827-7833.
[23] Ramani V C,Lemaire C A,Triboulet M,et al.Investigating circulating tumor cells and distant metastases in patient-derived orthotopic xenograft models of triple-negative breast cancer[J].Breast Cancer Res,2019,21(1):98.
[24] Moret R,Hellmers L,Zhang X,et al.Patient-derived Orthotopic Xenograft Models for Human Urothelial Cell Carcinoma and Colorectal Cancer Tumor Growth and Spontaneous Metastasis[J].J Vis Exp,2019(147).
[25]郝智慧,閻一鳴,孔麗娟,等.對NOD/SCID和SCID小鼠皮下接種的黑色素瘤生長特性比較[J].沈陽藥科大學學報,2019,36(7):607-611.
[26] Gorskaya Y F,Tukhvatulin A I,Dzharullaeva A S,et al.Effect of Activated Immunocompetent Cells on the Number of Multipotent Stromal Cells in Bone Marrow Transplants of CBA and CBA/N Mice in a Short Time after Polyvinylpyrrolidone Administration to Animals[J].Bull Exp Biol Med,2019,166(3):348-352.
[27] Kiyoi T,Liu S,Sahid M N A,et al.Morphological and functional analysis of beige mouse mast cells with giant granules[J].Int Immunopharmacol,2019,69:202-212.
[28]惲時鋒,胡玉紅,田小蕓,等.SPF環境中實驗動物微生物質量控制[J].實驗動物科學與管理.2006,23(3):37-39.
[29]桑垚,王績英.肺癌在裸鼠腫瘤模型中的研究進展[J/OL].世界最新醫學信息文摘(連續型電子期刊),2016,16(69):75-76,78.
[30]段樺,崔慧娟.不同Ki-67表達水平小細胞肺癌2例報告及文獻回顧[J].癌癥進展,2020,18(2):213-216.
[31] Rudin C M,Ismaila N,Hann C L,et al.Treatment of Small-Cell Lung Cancer:American Society of Clinical Oncology Endorsement of the American College of Chest Physicians Guideline[J].J Clin Oncol,2015,33(34):4106-4111.
[32] Micke P,Faldum A,Metz T,et al.Staging small cell lung cancer:Veterans Administration Lung Study Group versus International Association for the Study of Lung Cancer--what limits limited disease?[J].Lung Cancer,2002,37(3):271-276.
[33] Zhang C,Schmidt LA,Hatanaka K,et al.Evaluation of napsin A,TTF-1,p63,p40 and CK5/6 immunohistochemical stains in pulmonary neuroendocrine tumors[J].Am J Clin Pathol,2014,142(3):320-324.
[34]張榮榮,李文武,左文述,等.局限期小細胞肺癌增強CT與Ki-67抗原表達的對照研究[J].中華腫瘤防治雜志,2016,23(6):373-377.
[35]馬連君,周乃康,祁彥君,等.兔肺內腫瘤射頻消融后殘存腫瘤細胞增殖和新生血管變化[J].中華醫學雜志,2014,94(21):1671-1673.
[36] Muhammad Noman Khan.(CXCR1/CXCR2拮抗劑-CXCL8(3-72)K11R/G31P(G31P)在非小細胞癌中的抑制作用及機制的研究[D].大連:大連醫科大學,2015:1-128.
[37] Dhupkar P,Gordon N,Stewart J,et al.Anti-PD-1 therapy redirects macrophages from an M2 to an M1 phenotype inducing regression of OS lung metastases[J].Cancer Med,2018,7(6):2654-2664.
[38] Yao Y,Wu J,Zhou H,et al.A deficiency in cathelicidin reduces lung tumor growth in NNK/NTHi-induced A/J mice[J].Am J Cancer Res,2018,8(7):1190-1199.
[39] Singh A P,Adrianzen Herrera D,Zhang Y,et al.Mouse models in squamous cell lung cancer:impact for drug discovery[J].Expert Opin Drug Discov,2018,13(4):347-358.
[40] Ishibashi N,Maebayashi T,Aizawa T,et al.Correlation between the Ki-67 proliferation index and response to radiation therapy in small cell lung cancer[J].Radiat Oncol,2017,12(1):16.
[41]安曉穎,李曉霞,陳寧,等.BAP1、Ki-67表達與老年肺腺癌患者腫瘤侵襲及預后的關系[J].分子診斷與治療雜志,2020,12(5):661-665.
[42] Owen D H,Giffin M J,Bailis J M,et al.DLL3:an emerging target in small cell lung cancer[J].J Hematol Oncol,2019,12(1):61.
[43] Deneka A Y,Boumber Y,Beck T.Tumor-Targeted Drug Conjugates as an Emerging Novel Therapeutic Approach in Small Cell Lung Cancer(SCLC)[J].Cancers(Basel),2019,11(9):1297.
[44]丁小青,蔣留留,張志堅,等.轉移性人小細胞肺癌裸鼠模型的建立[J].臨床檢驗雜志,2012,30(5):321-323.
[45] Wang H Y,Li Z W,Sun W,et al.Automated quantification of Ki-67 index associates with pathologic grade of pulmonary neuroendocrine tumors[J].Chin Med J(Engl),2019,132(5):551-561.
[46] Kawaguchi K,Han Q,Li S,et al.Efficacy of Recombinant Methioninase(rMETase)on Recalcitrant Cancer Patient-Derived Orthotopic Xenograft(PDOX)Mouse Models:A Review[J].Cells,2019,8(5):410.
[47]熊煥文,夏國際,吳冠楠.晚期肺腺癌患者Ki-67表達水平與臨床療效的關系[J].醫學研究生學報,2018,31(12):1281-1284.
(收稿日期:2020-09-15) (本文編輯:田婧)

