苯并咪唑離子液體的合成及其催化尼泊金甲酯的合成
劉玉婷,鄒倩,尹大偉
(陜西科技大學 化學與化工學院 教育部輕化工助劑化學與技術重點實驗室,西安 710021)
近年來,基于環保理念,從源頭上減少或消除化學工業對環境的危害,使綠色有機合成得到了足夠的重視。在有機化合物的合成中,綠色合成方法的設計和選擇、 綠色試劑、溶劑及催化劑的使用、副產品及產品的處理等的綠色化是目前有機合成的主要目標。離子液體作為新型溶劑及催化劑,本身是一種低熔點的有機鹽,具有很多優異特性[1],例如低毒性、低蒸氣壓、高堆積密度、寬液相線范圍、離子電導率具有較高的熱穩定性、低腐蝕性和易處理性等。苯并咪唑離子液體作為咪唑離子液體的衍生物[2],因此具有咪唑離子液體的多種優良性質,例如對空氣和水不敏感、熔點低、穩定性高等。尼泊金酯具有化學穩定性高、不揮發、抗菌、成本低且無氣味等優勢。由于其優越的抗真菌和抗微生物特性,常用于化妝品[3]、食品和飲料中作為防腐劑[4]。酯化反應通常采用濃硫酸催化,但濃硫酸存在腐蝕設備、催化產率低、產物分離困難、后處理較復雜、有大量廢酸產生等缺點,因此為了解決傳統方法產生的環境污染、經濟成本高、不利于工業生產的問題,人們開始嘗試使用綠色催化劑,如離子液體、酶、殼聚糖等催化酯化反應。特別是離子液體催化反應,不僅效率高、產品純度高,而且催化劑可以回收再利用,降低了反應成本。本課題組近年來一直在探索高效綠色合成尼泊金酯的方法[5-9]。本文中首先合成了8種苯并咪唑離子液體,并通過FT-IR、1H NMR、13C NMR
對其結構進行了表征,并對其溶解性、吸水性、pH、電導率、SEM、TGA等進行了系統分析,同時重點考察了離子液體催化合成尼泊金甲酯,并優化了反應條件。
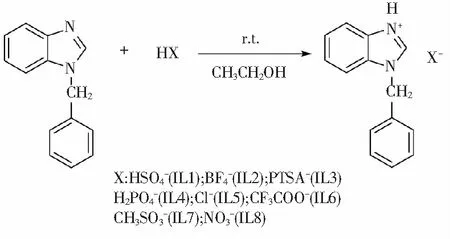
圖1 苯并咪唑離子液體的合成

圖2 尼泊金甲酯的合成
1 實驗部分
1.1 試劑及儀器
紅外光譜采用德國Bruker公司的VECTOR-22傅立葉紅外光譜儀測定(KBr壓片);核磁共振采用德國Bruker公司的ADVANCE Ⅲ 400 MHz核磁共振儀測定(以DMSO-d6為溶劑,以TMS為內標);熔點采用北京泰克儀器有限公司的X-4型數字顯示顯微熔點儀測定(溫度計未經校正);電導率采用DDS-11A 型電導率儀(電導電極為 DDS-1型鉑電極)測定;熱重分析采用美國TA公司的TGA Q500型熱重分析儀測定;場發射掃描電鏡(SEM)采用日本Hitachi公司的S4800型場發射掃描電鏡儀測定。
所用試劑均為市售分析純。N-芐基苯并咪唑按文獻[10]的方法合成。
1.2 N-芐基苯并咪唑離子液體的合成
在干燥的100 mL三口燒瓶中,加入0.208 g(1 mmol)N-芐基苯并咪唑、30 mL無水乙醇,攪拌至全溶。冰浴下緩慢滴加酸,然后室溫反應8 h,至反應完全(TLC監測)。蒸除溶劑,殘余物用乙醚洗滌、抽濾、干燥得白色固體。用無水乙醇重結晶得到N-芐基苯并咪唑離子液體純品。
N-芐基苯并咪唑硫酸氫鹽(IL1):白色固體,產率88.6%, m.p.195~197 ℃(194.8~195.2 ℃[11])。IR(KBr)ν:3108(ν=C-H), 1613(νC=N), 1548, 1442(ν苯環骨架),1312(νC-N), 758 (γ1,2-Ph-H);1H NMR (400 MHz, DMSO-d6)δ: 9.84 (s, 1H,N-CH), 7.91 (d, J=7.56 Hz,2H, Ar-H),7.50(m,7H,Ar-H),5.74(s,2H,N-CH2);13C NMR(101 MHz,DMSO-d6)δ:142.01,134.49,130.85, 129.02,128.66,128.23,126.49,126.06,115.36,113.51,49.93。
N-芐基苯并咪唑氟硼酸鹽(IL2):白色固體,產率85.9%,m.p.106~108 ℃(108~110 ℃[12]。IR(KBr)ν:3141(ν=C-H), 1622(νC=N), 1553, 1440(ν苯環骨架),1371(νC-N),753(γ1,2-Ph-H);1H NMR (400 MHz,DMSO-d6)δ: 9.77 (s, 1H,N-CH),7.89(d,J=7.50 Hz,2H, Ar-H), 7.49 (m, 7H, Ar-H),5.76(s,2H,N-CH2);13C NMR(101 MHz,DMSO-d6)δ:141.70,134.15,131.05,128.91,128.56,128.06,126.48,126.09,115.03,113.35,49.76。
N-芐基苯并咪唑對甲苯磺酸鹽(IL3):白色固體,產率82.4%,m.p.113~115 ℃。IR(KBr)ν 3104(ν=C-H),1609(νC=N),1540,1440(ν苯環骨架), 1371(νC-N), 753 (γ1,2-Ph-H);1H NMR (400 MHz,DMSO-d6)δ: 9.80 (s, 1H,N-CH), 7.87 (d, J=7.11 Hz,2H, Ar-H), 7.41 (m, 9H, Ar-H), 7.10 (s, 2H, Ar-H),5.76(s,2H, N-CH2), 2.27 (s, 3H, -CH3);13C NMR(101 MHz,DMSO-d6)δ:145.18,142.00,138.12,134.36,131.58,130.80,128.96,128.59,128.28,128.20,126.37,126.04,125.56,115.32,113.44,49.60,20.94。
芐基苯并咪唑磷酸二氫鹽(IL4):白色固體,產率88.1%,m.p.146~148 ℃。IR(KBr)ν:3104(ν=C-H), 1722(νC=N), 1553, 1446(ν苯環骨架), 1302(νC-N), 753 (γ1,2-Ph-H);1H NMR (400 MHz,DMSO-d6)δ:8.50(s, 1H,N-CH), 7.68 (d, J=7.58 Hz,2H, Ar-H),7.27 (m, 7H, Ar-H), 5.51 (s, 2H, N-CH2);13C NMR(101 MHz,DMSO-d6)δ:144.14,136.69,133.44,128.88,127.99,127.53,123.00,122.32,119.19,111.12,47.99。
N-芐基苯并咪唑鹽酸鹽(IL5):白色固體,產率80.2%,m.p.136~138 ℃。IR(KBr)ν:3058(ν=C-H), 1626(νC=N), 1556, 1451(ν苯環骨架), 1302(νC-N), 761 (γ1,2-Ph-H);1H NMR(400 MHz,DMSO-d6)δ: 9.29 (s, 1H,N-CH), 7.71 (d, J=7.46 Hz,2H, Ar-H),7.35 (m, 7H, Ar-H), 5.67 (s, 2H, N-CH2);13C NMR(DMSO-d6,101 MHz)δ:143.16,135.93,132.37,129.01,128.35,128.02,124.46,124.25,117.4,112.36,48.83。
N-芐基苯并咪唑三氟乙酸鹽(IL6):淡黃色黏狀固體,產率78.6%,m.p.107~109 ℃。IR(KBr)ν:3110(ν=C-H), 1790(νC=O), 1671(νC=N), 1546(ν苯環骨架), 1371(νC-N), 715 (γ1,2-Ph-H);1H NMR (400 MHz,DMSO-d6)δ: 9.75 (s, 1H,N-CH), 7.90 (d, J=7.68 Hz,2H,Ar-H), 7.39 (m, 7H, Ar-H), 5.76 (s, 2H, N-CH2);13C NMR(101 MHz,DMSO-d6)δ:141.97,134.46,130.90,128.78,128.36,127.91,125.85,125.53,115.44,113.05,49.34。
N-芐基苯并咪唑甲磺酸鹽(IL7):淡黃色黏狀固體,產率75.9%,m.p.70~72 ℃。IR(KBr)ν:3097(ν=C-H),1630(νC=N),1553,1442(ν苯環骨架),1312(νC-N),758(γ1,2-Ph-H);1H NMR(400 MHz,DMSO-d6,)δ:9.89 (s, 1H,N-CH), 7.89 (d, J=7.24 Hz,2H, Ar-H), 7.34 (m, 7H, Ar-H), 5.79 (s,2H, N-CH2), 2.42 (s, 3H, -CH3);13C NMR(101 MHz,DMSO-d6)δ:141.98,134.48,131.20,130.77,129.11,128.76,128.34,126.66,126.35,115.21,113.66,49.62。
N-芐基苯并咪唑硝酸鹽(IL8):白色固體,產率81.5%,m.p.97~99 ℃。IR(KBr)ν:3097(ν=C-H), 1615(νC=N), 1546, 1459(ν苯環骨架), 1378(νC-N), 740 (γ1,2-Ph-H);1H NMR(400 MHz,DMSO-d6)δ: 9.63 (s, 1H,N-CH),7.84 (d,J=7.47 Hz, 2H, Ar-H), 7.41 (m, 7H, Ar-H),5.74 (s, 2H, N-CH2);13C NMR(101 MHz,DMSO-d6)δ:142.37,134.77,131.20,128.95,128.50,128.06,125.80,125.60,115.83,113.09,49.19。
1.3 尼泊金甲酯的合成
在干燥的100 mL三口燒瓶中,加入1.381 g(10 mmol)對羥基苯甲酸和4.143 g(30 mmol)甲醇攪拌至全溶,再加入15%的苯并咪唑離子液體(相對于酸的物質的量)。緩慢升溫回流反應6 h,TLC監測至反應結束。減壓蒸除溶劑,剩余物用乙醚洗滌,抽濾,濾餅即苯并咪唑離子液體,可循環使用多次;濾液旋干,用無水乙醇重結晶得到純品,m.p.122~124 ℃(126~128 ℃)。IR(KBr)ν:3410(νO-H),3072(νPh-H),2878(νC-H),1728(νC=O),1615,1433(ν-苯環),1202(νC-O-C),828(γ1,4-Ph-H)。
2 結果與討論
2.1 離子液體的溶解性
分別以乙酸乙酯、甲醇、乙醇、乙醚、苯、甲苯、氯仿、二氯甲烷、水、正已烷、乙腈及丙酮為溶劑,考察離子液體的溶解性。溶解度標準根據《中國藥典》易溶、溶解、略溶、微溶、幾乎不溶或不溶來描述其溶解性能[13]。離子液體的溶解性結果見表1。
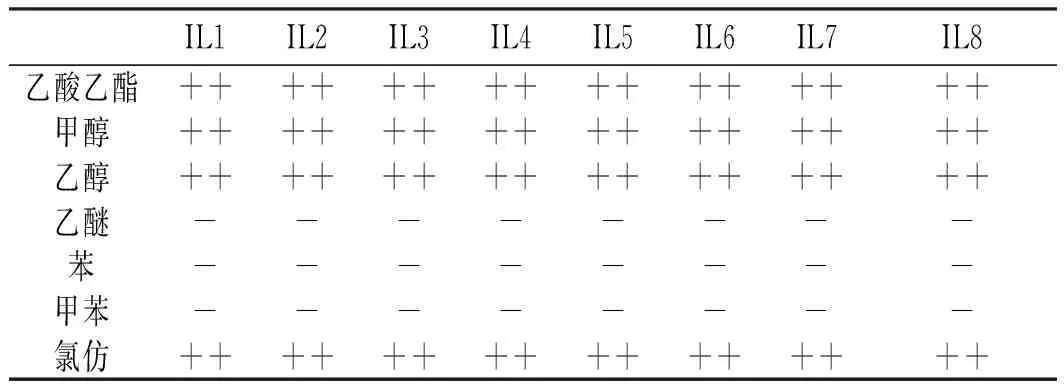
表1 離子液體的溶解性Table 1 The solubility of ionic liquid
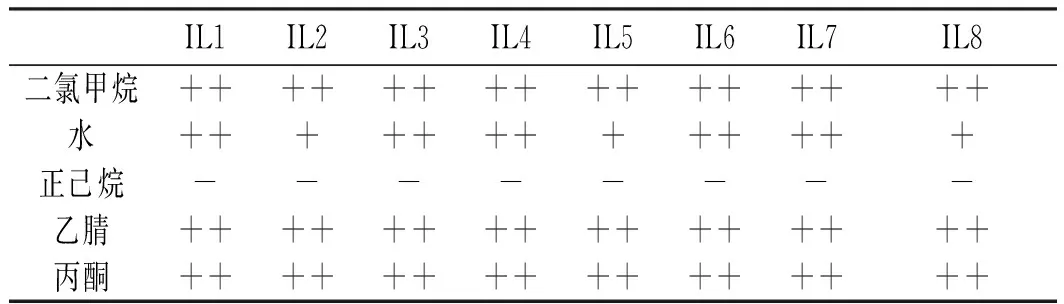
續 表
由表1可知,離子液體(IL1-8)在乙酸乙酯、甲醇、乙醇、氯仿、二氯甲烷、乙腈、丙酮里溶解而在乙醚、苯、甲苯、正已烷中不溶。IL1、IL3、IL4、IL6、IL7在水中溶解而IL2、IL5、IL8在水中微溶。離子液體在乙醚、苯、甲苯、正己烷中不溶,可能與溶劑的極性有關,一般溶劑的極性越大,化合物在其中的溶解性越好。
2.2 離子液體的吸水性
將離子液體(IL1-8)放在烘箱中干燥24 h后分別取0.01 g放在表面皿上,并平整地鋪開,在室溫下每隔2 h分別稱其質量,共放置24 h,計算其吸水率。離子液體(IL1-8)吸水性結果見表2。
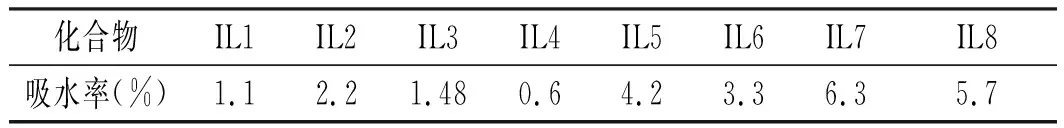
表2 離子液體的吸水性Table 2 The hygroscopicity of ionic liquid
由表2可知,所有離子液體(IL1-8)都有較好的吸水性。離子液體IL7(N-芐基苯并咪唑甲磺酸鹽)吸水性最好,而離子液體IL4(N-芐基苯并咪唑磷酸二氫鹽)吸水性最差。
2.3 離子液體的pH值
將能溶于水的離子液體IL1、IL3、IL4、IL6、IL7配成不同濃度的水溶液,然后測其pH值,其pH結果見表3(因IL2、IL5、IL8微溶于水,因此無法測其pH)。

表3 離子液體的pH值Table 3 The pH values of ionic liquid
由表3可知,5種測試的離子液體都有較強的酸性。同一種離子液體,pH值隨著質量分數的增大而減小。IL1(N-芐基苯并咪唑硫酸氫鹽)的pH值最小,pH值可能與陰離子有關,HSO4-電離出H+濃度大,因此酸性高。
2.4 離子液體的電導率
電導率是離子液體的一個重要參數。分別以水、無水乙醇為溶劑把離子液體配成10~5 mol/L的溶液,測定不同溫度下的電導率,在水中的電導率見表4(由于IL2、IL5、IL8微溶于水,因此無法測其在水中的電導率);在無水乙醇中的電導率見表5。
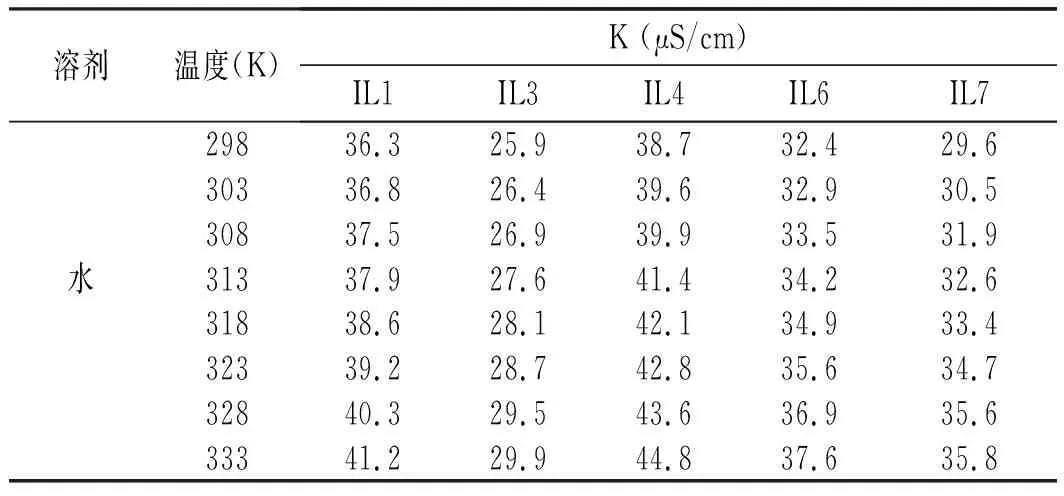
表4 離子液體在水中的電導率Table 4 The electrical conductivity of ionic liquid in water
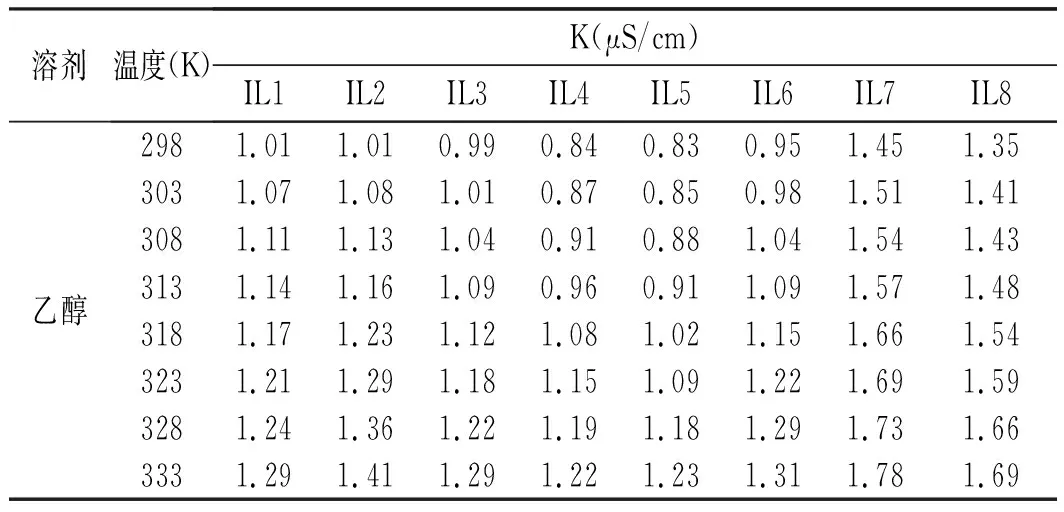
表5 離子液體在乙醇中的電導率Table 5 The electrical conductivity of ionic liquid in ethanol
由表4和表5可知,離子液體的電導率隨著溫度的升高而增大,在水中的電導率遠遠大于在乙醇中的電導率。IL3(N-芐基苯并咪唑對甲苯磺酸鹽)在水中的電導率最小,IL4(芐基苯并咪唑磷酸二氫鹽)在水中的電導率最大,這可能和陰離子空間構型有關。IL7(芐基苯并咪唑甲磺酸鹽)在乙醇中的電導率最大,而IL5(N-芐基苯并咪唑鹽酸鹽)的最小。IL1(N-芐基苯并咪唑硫酸氫鹽)與IL2(芐基苯并咪唑氟硼酸鹽),IL4(芐基苯并咪唑磷酸二氫鹽)與IL5(N-芐基苯并咪唑鹽酸鹽)的電導率接近。
2.5 離子液體的熱重分析
用TGA Q500型熱重分析儀測試離子液體(IL1~L18)的熱穩定性,在氮氣保護下,以升溫速率10 ℃/min測定了8種離子液體的熱穩定性,結果見圖3。
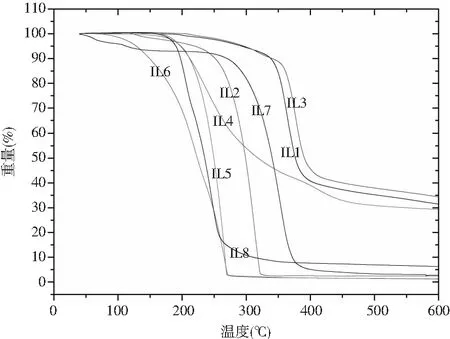
圖3 離子液體的TGA圖
由圖3可知,離子液體(IL1~L18)的分解溫度都大于250 ℃,說明離子液體比較穩定。IL7(芐基苯并咪唑甲磺酸鹽)最先出現質量損失。離子液體在剛開始逐漸升溫的過程中有一個較長的恒重過程,但是在255~300 ℃左右,有明顯的質量損失,這是失去了結晶水的緣故。在320~370 ℃,有特別明顯的質量損失,可能是苯并咪唑環、陰離子的結構遭到破壞。
2.6 離子液體的場發射掃描電鏡(SEM)數據分析
用S4800型場發射掃描電鏡(SEM),放大一定倍數,觀測離子液體(IL1-8)的表面形貌,結果見圖4。


圖4 離子液體的SEM圖
由圖4可知,IL1、IL2、IL5分別放大22000,12000,15000倍觀察到的形態是規則的,表面均勻且光滑,由棒組成,直徑分別是20,40,5 μm。而IL3、IL4、IL6、IL7、IL8分別放大10000,11000,15000,20000,22000倍后觀察到其表面是堆積顆粒的形態,表面積較大,可能具有優異的催化活性,直徑分別為50,40,30,20,20 μm。
2.7 離子液體催化合成尼泊金甲酯
以離子液體IL1(N-芐基苯并咪唑硫酸氫鹽)為催化劑,考察其催化尼泊金甲酯合成的效果。在單因素實驗的基礎上,通過正交實驗,考察反應溫度、反應時間、催化劑用量、原料摩爾比對尼泊金甲酯產率的影響。正交實驗因素水平見表6,正交實驗結果見表7。
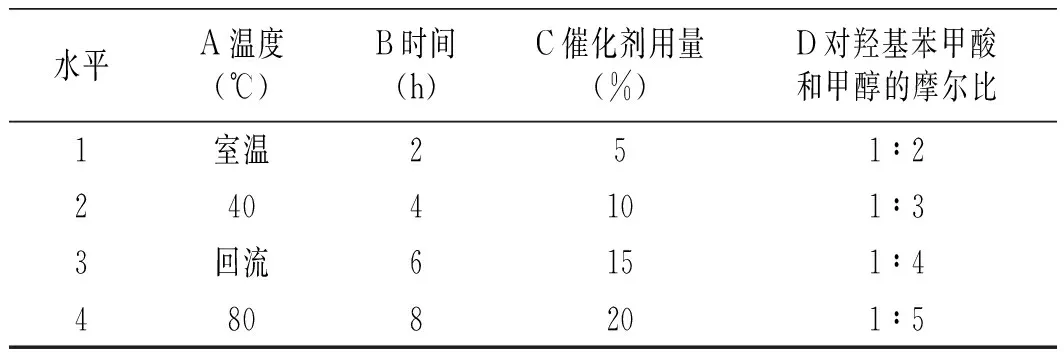
表6 正交實驗因素水平表Table 6 The factors and levels of orthogonal experiment
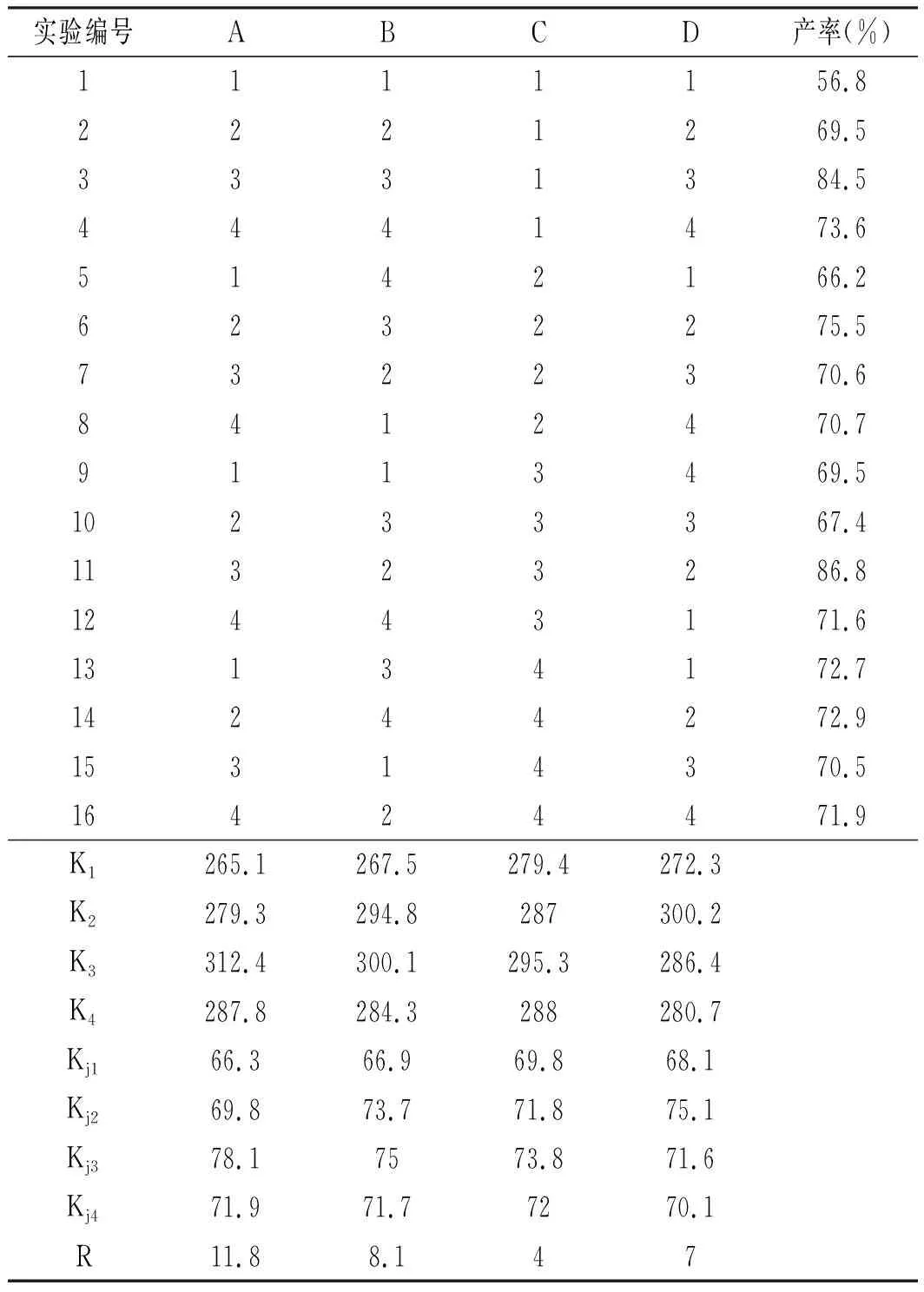
表7 正交實驗與結果Table 7 The results of orthogonal experiment
由表7可知,各因素對尼泊金甲酯產率影響的主次順序為反應溫度>反應時間>對羥基苯甲酸和甲醇的摩爾比>催化劑用量。各因素的較優水平組合為A3B3C3D2,即合成尼泊金甲酯的最佳反應條件:對羥基苯甲酸和甲醇的摩爾比為 1∶3,回流反應6 h ,催化劑用量n=15%n對羥基苯甲酸。
為了考察正交實驗得出的最佳反應條件的合理性,以最佳反應條件合成尼泊金甲酯,結果見表8。
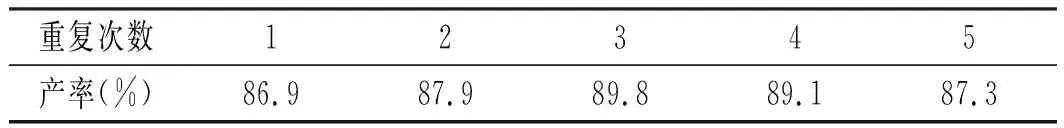
表8 最佳反應條件的重復Table 8 The repetition of optimal reaction conditions
由表8可知,最佳反應條件重復5次 ,尼泊金甲酯的產率均比正交表里的數據高。
2.8 離子液體的重復使用
為了考察離子液體的重復使用性,在最佳反應條件下,以IL1(N-芐基苯并咪唑硫酸氫鹽)催化合成尼泊金甲酯,循環使用5次,考察催化劑的重復使用對尼泊金甲酯產率的影響,結果見表9。

表9 離子液體的重復使用性Table 9 The reusability of ionic liquid
由表9可知,隨著重復使用次數的增多,產率降低,但是降低幅度不大,說明離子液體作為催化劑的重復使用效果良好。
3 結論
本文提供了一種綠色、經濟、高效、低成本合成尼泊金甲酯的方法。首先合成了8種苯并咪唑離子液體,并將其用于催化尼泊金甲酯的合成,同時優化了反應條件,得出最佳反應條件為:對羥基苯甲酸和甲醇的摩爾比1∶3,回流反應時間6 h,催化劑用量n=15%n對羥基苯甲酸,產率高達86%以上,為尼泊金甲酯的綠色合成提供了理論依據。

