鐵酸鋅還原-氧化選擇性分解行為研究①
鄔桂婷, 劉 維, 韓俊偉, 張添富
(中南大學 資源加工與生物工程學院,湖南 長沙410083)
我國是世界第一產鋅大國,其中約70%的鋅是通過濕法煉鋅方式獲得的[1]。 在傳統濕法煉鋅過程中,鐵酸鋅是不可避免的生成產物;此外,鋼廠煙塵中鋅含量高,主要以氧化鋅和鐵酸鋅形式存在,其中鐵酸鋅的鋅含量占總鋅量的30%以上[2-4]。 由于鐵酸鋅結構穩定,難于浸出或還原,導致這些物料被直接堆存,大量浪費資源且嚴重污染環境。 因此,含鐵酸鋅物料的資源化利用關鍵在鐵酸鋅的分解[5-6]。
20 世紀60 年代前,主要采用火法工藝處理鐵酸鋅[7-8],這些工藝大都存在能耗高、流程長、貴金屬回收率低等缺點。 20 世紀60 年代后,鐵酸鋅處理技術逐步轉向熱酸浸出的濕法工藝[9-12],濕法工藝雖然提高了鋅浸出率,但產生大量沉鐵渣。 近年來,研究人員進行了大量火法-濕法聯合工藝研究,發現磁化焙燒[13-16]是鋅鐵分離的有效途徑,但該方法正處于研究階段,且磁化焙燒技術存在一個很難解決的問題:在工業應用上鐵酸鋅的完全分解和磁鐵礦的過還原控制兩者不能同時實現。
針對上述一段焙燒中鐵酸鋅分解不徹底的難題,本文提出一種強化鐵酸鋅選擇性分解新方法,先通過還原焙燒將鐵酸鋅分解為氧化鋅和鐵氧化物,然后冷卻至低溫,利用氧化亞鐵在低溫下化學活性強、不穩定的特性,在CO2氣氛下將過還原的氧化亞鐵轉化為磁性四氧化三鐵。
1 試 驗
1.1 試驗原料
試驗用原料為實驗室合成的純鐵酸鋅:將分析純氧化鋅和三氧化二鐵按照鋅鐵摩爾比1 ∶1充分混勻,將混合物置于高溫爐中,在1 000 ℃下焙燒4 h,取出樣品,采用1 mol/L 鹽酸溶液在40 ℃下攪拌1 h,以除去焙燒過程中未反應的氧化鋅及三氧化二鐵。 浸出渣洗滌3 次后再次置于高溫爐中,在1 000 ℃下焙燒1 h,冷卻后取出樣品并保存于干燥器中備用。 化學分析結果表明:合成產物鋅含量27.04%,鐵含量46.32%,與純鐵酸鋅的化學組成基本一致。 合成產物XRD 圖譜見圖1。 圖中只有鐵酸鋅的峰,無雜相,晶形較好。
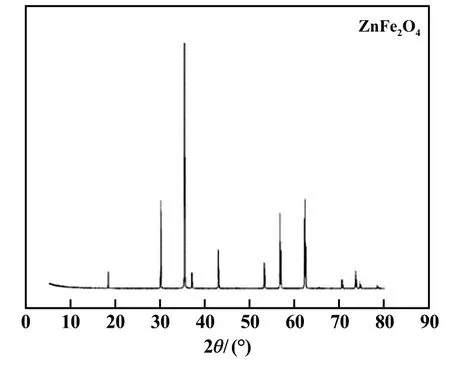
圖1 合成產物鐵酸鋅XRD 圖譜
焙燒使用的氣體有CO、CO2、N2。 CO 作為還原氣體,N2作為補充氣體和保護氣體,CO2的作用是控制還原強度。
1.2 試驗方法及設備
焙燒采用密閉管式爐,設備圖見圖2。 首先稱取一定質量的鐵酸鋅,平鋪在60 mm ×120 mm 的剛玉瓷舟中,將瓷舟放入密閉管式爐內,在N2保護下加熱至設定的還原溫度,并通入一定比例的CO 和CO2氣體,調節N2流量以構成2 L/min 的氣流,恒溫焙燒一定時間,待還原焙燒結束后停止通入CO 和CO2,并冷卻至磁化溫度,通入一定濃度CO2,進行氧化焙燒,最后在N2保護下自然冷卻到室溫,取出樣品分析化學成分、磁性能。
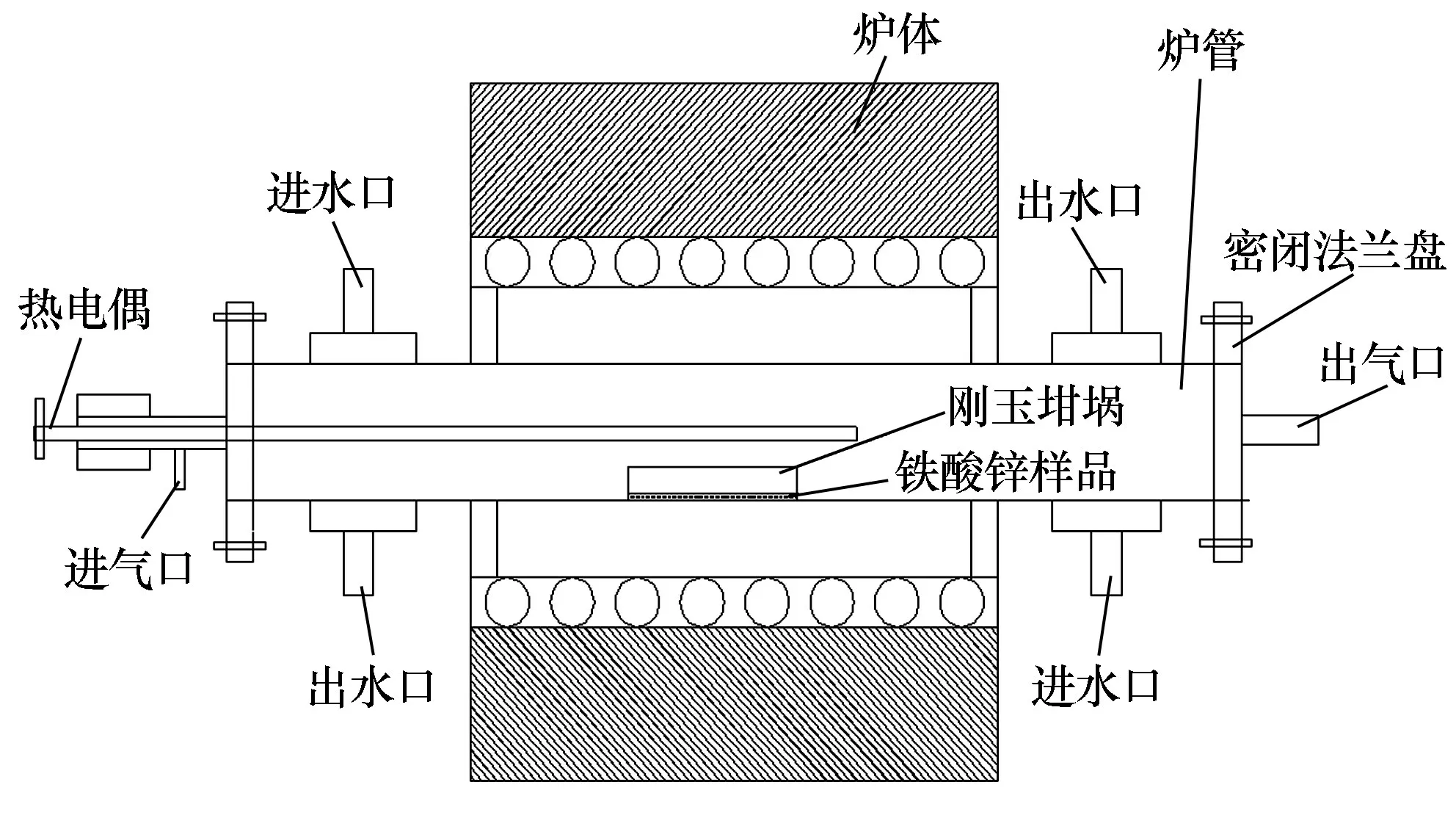
圖2 密閉管式爐示意
1.3 可溶鋅率和磁性鐵測定
用化學滴定法測定還原焙砂氧化鋅和總鋅含量,并計算可溶鋅率;用比磁化率反映還原焙砂、氧化焙砂的磁性,從而確定過還原的氧化亞鐵被氧化的程度。
2 結果與討論
2.1 熱力學討論
從熱力學角度,在CO 作為還原劑條件下鐵酸鋅可能發生如下反應:
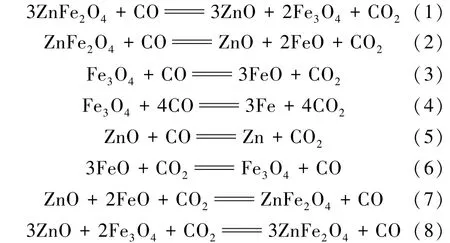
運用HSC5.0 軟件計算各反應在0 ~1 000 ℃范圍內的標準吉布斯自由能變化,結果見圖3。 在所研究的溫度范圍內,對于鐵酸鋅的還原(式(1)),標準吉布斯自由能變化表現為較大的負值,表明此溫度范圍內有利于鐵酸鋅還原為磁鐵礦和氧化鋅。 隨著溫度升高,式(2)的標準吉布斯自由能變化持續下降,在大約270 ℃時,吉布斯自由能變化為負值,說明還原過程中鐵酸鋅不可避免地過還原為方鐵礦。 式(3)的吉布斯自由能變化大約570 ℃時變為負值。 在500 ℃以下磁鐵礦可能還原為金屬鐵(式(4))。 在研究范圍內,式(5)的標準吉布斯自由能變化為正,溫度升高有利于氧化鋅的還原。 當溫度低于600 ℃時,式(6)的標準吉布斯自由能變化為負值,說明在低溫條件下,以CO2為氧化劑可以實現方鐵礦向磁鐵礦的轉化。 在300 ℃以上,式(7)、式(8)標準吉布斯自由能變化均為正。因此,為了將方鐵礦轉化為磁鐵礦,且避免鐵酸鋅的生成,在高于600 ℃條件下進行還原反應,而在不低于300 ℃的較低溫條件下進行氧化反應。
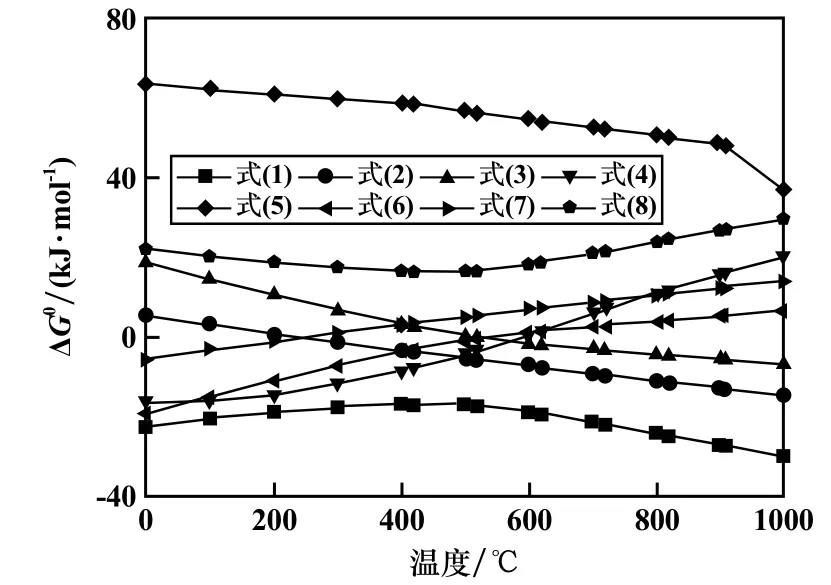
圖3 可能發生的反應標準吉布斯自由能變化
2.2 還原焙燒
2.2.1 還原氣氛對鐵酸鋅還原的影響
通過已有研究[16-17]可知,CO2可以調節CO 還原分解為鐵酸鋅的程度,因而避免鐵酸鋅過度還原為單質鐵,VCO/(VCO+VCO2)體積比對鐵酸鋅分解有重要影響。 在CO 濃度20%、焙燒時間90 min、溫度750 ℃條件下,考察了VCO/(VCO+VCO2)比對鐵酸鋅還原產物中可溶鋅率的影響,結果見圖4。 當VCO/(VCO+VCO2)比小于67%時,隨著比值增大,可溶鋅率增加。 但當VCO/(VCO+VCO2)比超過67%時,可溶鋅率反而降低。在VCO/(VCO+VCO2)比為67%時,可溶鋅率達到最大值96.63%。 這可能是在弱還原氣氛下,隨著VCO/(VCO+VCO2)比增大,還原氣氛加強,鐵酸鋅的分解率增加,導致可溶鋅率增加。 但過強的還原性氣氛下,鐵酸鋅分解生成的氧化鋅和鐵氧化物生成鋅鐵固溶體,從而降低可溶鋅率[18]。
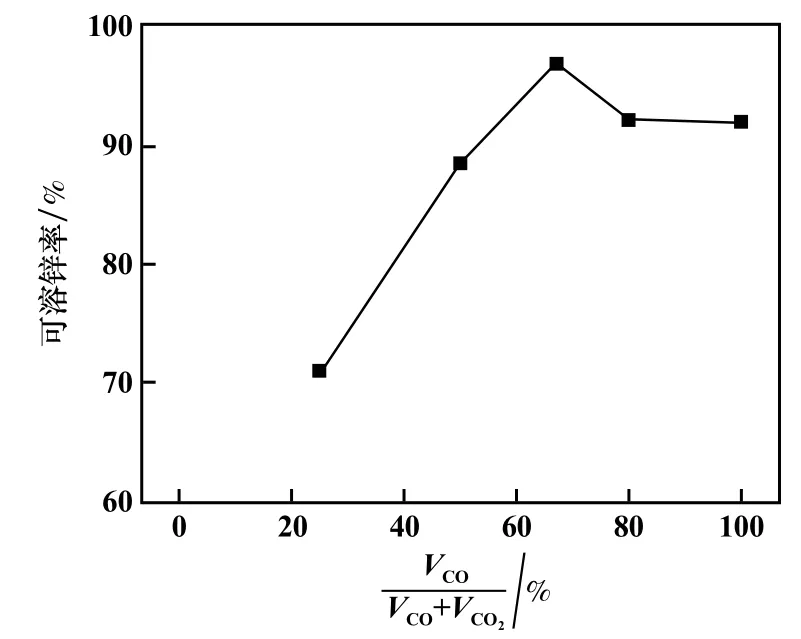
圖4 還原氣氛對還原焙燒產物中可溶鋅率的影響
2.2.2 還原焙燒時間對鐵酸鋅還原的影響
VCO/(VCO+VCO2)比67%,其他條件不變,還原焙燒時間對鐵酸鋅還原焙燒后可溶鋅率的影響見圖5。 在90 min 之前,可溶鋅率隨著時間增加而增加;但超過90 min 后,可溶鋅率降低。 因此,最佳還原焙燒時間控制為90 min。
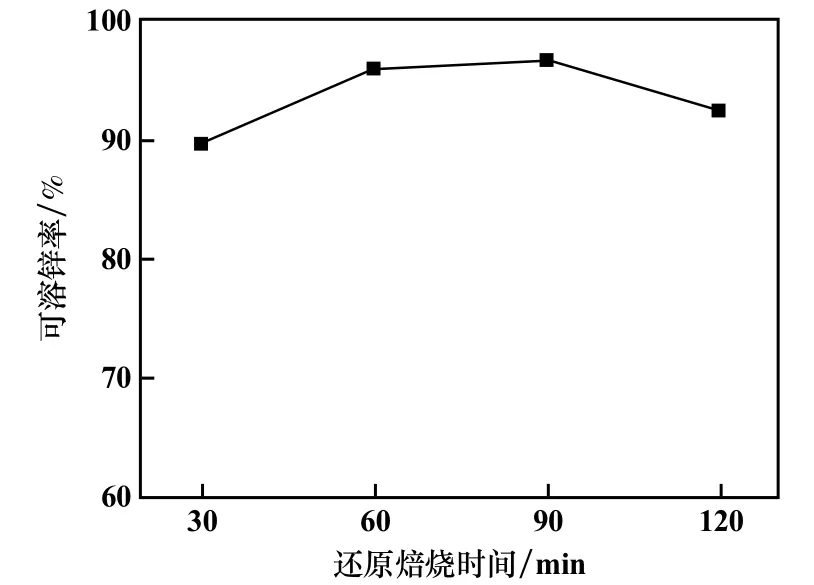
圖5 還原焙燒時間對還原焙燒產物中可溶鋅率的影響
2.2.3 還原焙燒溫度對鐵酸鋅還原的影響
還原焙燒時間90 min,其他條件不變,還原焙燒溫度對鐵酸鋅還原焙燒渣可溶鋅率的影響見圖6。 從圖6可以看出,可溶鋅率在750 ℃時出現拐點,超過750 ℃,可溶鋅率出現下降趨勢。 這是因為鐵酸鋅過還原形成Fe0.85-xZnxO[19],從而降低了可溶鋅率。 因此,最佳還原溫度為750 ℃。
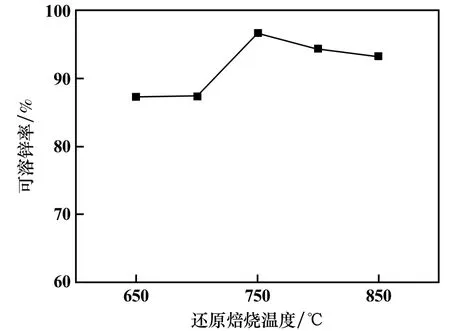
圖6 還原焙燒溫度對還原焙燒產物中可溶鋅率的影響
2.3 氧化焙燒
通過還原焙燒,鐵酸鋅分解率達到97%,但鐵仍主要以方鐵礦的形式存在。 方鐵礦無磁性,易溶于低酸性溶液,不利于后續鋅鐵分離。 為解決這個問題,使用CO2在低溫條件下進行氧化焙燒,將方鐵礦轉化為磁鐵礦。
2.3.1 氧化焙燒溫度對方鐵礦磁化的影響
測得制備的鐵酸鋅樣品比磁化率為3.99×10-13m3/kg,鐵酸鋅樣品在750 ℃、焙燒時間90 min、VCO/(VCO+VCO2)比67%條件下還原焙燒后,焙燒產物比磁化率為5.30×10-11m3/kg。
固定CO2流量0.4 L/min、氧化焙燒時間75 min,氧化焙燒溫度對氧化焙砂比磁化率的影響見圖7。 首先隨著溫度升高,比磁化率增加;當溫度超過600 ℃時,比磁化率下降。 因此,最佳氧化焙燒溫度為600 ℃。
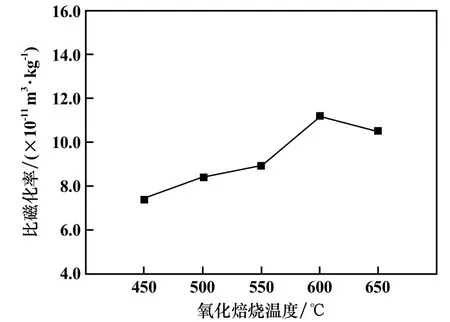
圖7 氧化焙燒溫度對氧化焙砂比磁化率的影響
2.3.2 氧化焙燒時間對方鐵礦磁化的影響
氧化焙燒溫度600 ℃,其他條件不變,氧化焙燒時間對焙砂磁化率的影響見圖8。 由圖8 可知,氧化焙燒時間為90 min 時達到最佳效果。 所以,最佳氧化焙燒時間為90 min。
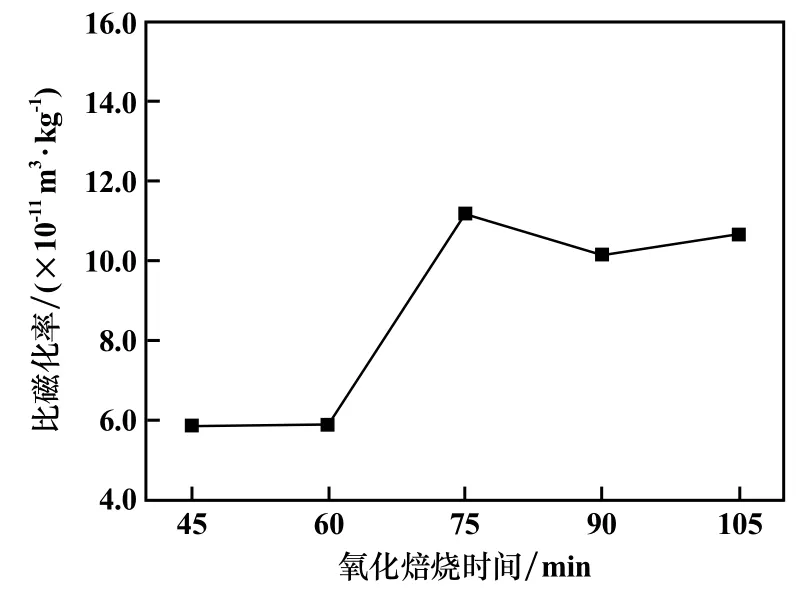
圖8 氧化焙砂比磁化率隨氧化焙燒時間變化曲線
2.3.3 CO2流量對方鐵礦磁化的影響
氧化焙燒時間90 min,其他條件不變,CO2流量對氧化焙砂磁化率的影響見圖9。 CO2流量從0.4 L/min增加到1.2 L/min,氧化焙燒后樣品的比磁化率從1.12×10-10m3/kg 增加到1.17×10-10m3/kg,繼續增加CO2流量,比磁化率基本不變,說明方鐵礦已基本磁化,因此選擇CO2流量為1.2 L/min。
2.4 優化條件試驗
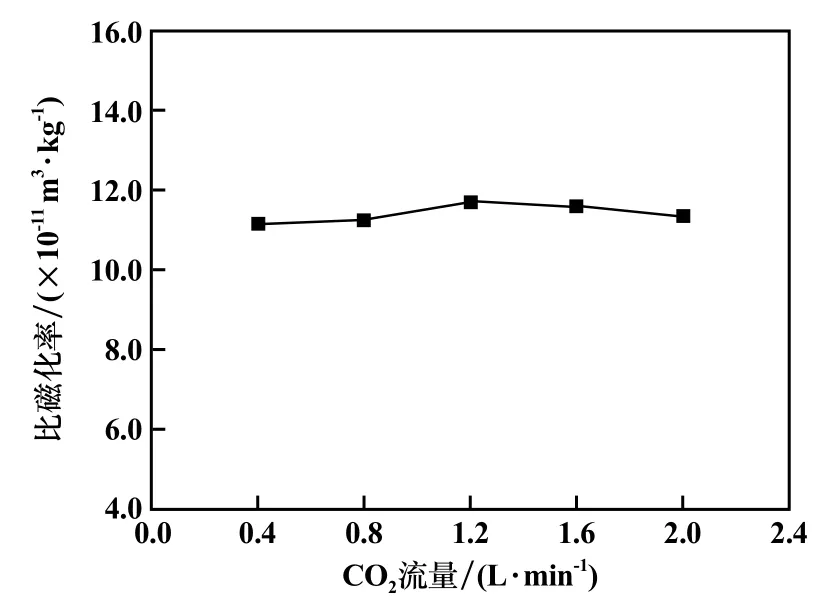
圖9 氧化焙砂比磁化率隨CO2 濃度變化曲線
根據各單因素試驗結果,得到還原焙燒優化工藝條件為:CO 濃度20%、還原溫度750 ℃、VCO/(VCO+VCO2)比67%、焙燒時間90 min,此時鐵酸鋅充分還原為氧化鋅和氧化亞鐵,鐵酸鋅分解率達到96.63%;氧化焙燒優化工藝條件為:氧化溫度600 ℃、氧化時間75 min、CO2氣體流量1.2 L/min,此時方鐵礦轉化為磁鐵礦,氧化焙砂比磁化率達到1.17×10-10m3/kg。
最佳工藝條件下,還原焙燒后焙砂的XRD 圖譜見圖10,還原焙砂再氧化焙燒后的焙砂XRD 圖譜見圖11。圖10 顯示只有氧化鋅和方鐵礦的峰,表明鐵酸鋅分解完全,且沒有過還原為單質鐵,有利于后續方鐵礦的磁化。 圖11 顯示只有氧化鋅和磁鐵礦的峰,說明氧化亞鐵基本轉化為磁鐵礦,氧化效果明顯。
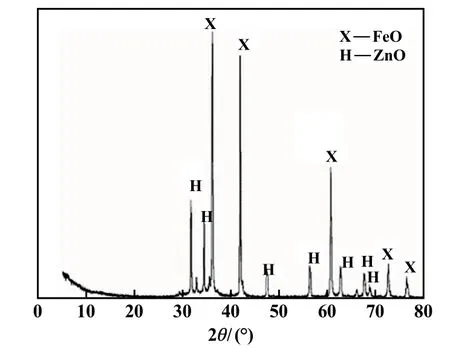
圖10 還原焙砂XRD 圖譜
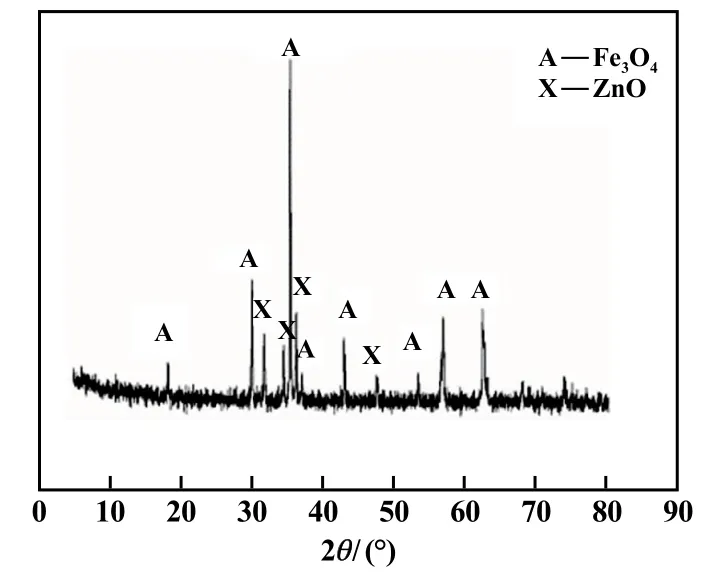
圖11 氧化焙砂XRD 圖譜
3 結 論
1) 提出了一種選擇性分解鐵酸鋅方法,即在較高溫度下使鐵酸鋅充分還原為氧化鋅和氧化亞鐵,然后在較低溫度、CO2弱氧化氣氛下將氧化亞鐵轉化為磁鐵礦。
2) 熱力學分析結果表明,鐵酸鋅在分解過程中不可避免地會過還原為FeO,且升高溫度不僅有利于鐵酸鋅分解,還促進FeO 的生成。 CO2在低溫環境下可將方鐵礦轉化為磁鐵礦,且溫度越低,越有利于反應的進行,但降低溫度會減緩反應速度、延長氧化時間和增加CO2流量均在一定程度上促進方鐵礦的轉化。
3) 最佳還原焙燒條件為:VCO/(VCO+VCO2) 比67%、CO 濃度20%、焙燒時間90 min、溫度750 ℃,此時可溶鋅率可達到96.63%。 對還原焙砂進行氧化焙燒,當氧化溫度600 ℃、氧化時間75 min、CO2濃度1.2 L/min時,氧化焙砂比磁化率達1.17×10-10m3/kg。

