基于MR T2WI的影像組學對直腸癌新輔助治療療效的評估
劉明璐, 沈浮, 陸建平
直腸癌(rectal cancer,RC)是世界范圍內最常見的消化道惡性腫瘤之一,得益于早期篩查和對確診患者的規范性治療,全球范圍內直腸癌的發病率、死亡率近20年來有不斷下降的趨勢,但在我國卻呈升高趨勢,多數患者發現時已經為局部進展期直腸癌(locally advanced rectal cancer,LARC)[1-2]。新輔助放化療(neoadjuvant chemoradiotherapy,nCRT)后手術治療可以降低LARC術后局部復發率,并提高長期生存率及保肛率,是目前的主流治療方式。病理的腫瘤退縮分級(tumor regression grade,TRG)通過對腫瘤組織中纖維化及殘存腫瘤比例的評判,對新輔助治療療效進行術后評估。目前傳統影像學主要依靠高分辨T2WI序列對新輔助治療的療效進行術前mrTRG分級,僅在形態學上評估療效,與病理TRG缺乏對應,無法滿足精準醫學的要求[3]。影像組學(radiomics)是將影像數據定量分析并與機器學習(machine learning,ML)方法相結合,篩選出具有診斷價值的影像組學特征,建立診斷模型,為影像診斷及治療決策提供更精準的信息。
本研究采用影像組學的方法,在磁共振高分辨T2WI圖像上分別提取治療前基線檢查的組學特征及治療前和治療后改變的組學特征,探討基于這兩種特征提取方法的影像組學模型對LARC新輔助治療的療效評估價值。
材料與方法
1.患者資料
回顧性分析2018年1月-2018年12月在本院經手術病理證實,行新輔助放化療的80例LARC患者(cT3/T4N0M0或cTxN+M0),男60例,女20例,年齡28~74歲,平均56.2±9.9歲。納入標準:①術后病理類型為直腸腺癌;②直腸單發病灶;③基線檢查及nCRT后術前評估均行直腸高分辨T2WI序列掃描;④術前檢查后行根治性手術治療,有TRG分級的詳細病理報告結果。排除標準:①圖像質量欠佳,如明顯偽影導致無法對圖像進行分割及提取影像組學特征;②術前MRI檢查距手術間隔時間超過12周[4-5];③病程中另外接受其他局部治療、靶向治療或免疫治療。
2.MR檢查方法
采用Siemens 3.0T Skyra MR成像系統,腹部相控陣線圈。所有患者檢查前禁食4 h。檢查前使用一支開塞露(20 mL甘油)清潔患者腸道。直腸MR掃描主要序列包括:脂肪抑制T2WI(矢狀面),T1WI(橫軸面)、高分辨T2WI(斜橫軸面)、DWI及增強掃描。高分辨T2WI平面垂直于病灶處腸管的長軸。掃描參數:TR 4000 ms,TE 108 ms,FOV 180 mm,矩陣320×320,層厚3 mm,無層間距,層數28,翻轉角150°,帶寬108 Hz/像素,無脂肪抑制技術,GRAPPA并行采集模式,加速因子為3,采集時間為4 min 10 s。
3.治療方案及病理標準
所有患者術前均行長程適形調強盆腔放療,處方劑量為45~50 Gy,共25~28次,5周到5周半完成。化療于第一次盆腔放療開展時口服卡培他濱或靜滴5-氟尿嘧啶(5-fluorouracil,5-FU)[4-5]。新輔助放化療結束后間隔5~12周行直腸癌根治性切除術[6]。術后病理判斷腫瘤退縮分級(tumor regression grade,TRG),根據美國癌癥聯合委員會(American Joint Committee on Cancer,AJCC)第八版的分類標準[7]分為0~3級共4類。TRG 0級(完全消退):鏡下無腫瘤細胞殘留;TRG 1級(中等退縮):鏡下僅見單個或小灶性腫瘤細胞殘留;TRG 2級(輕微退縮):可見腫瘤細胞殘留但少于纖維化間質;TRG 3級(無退縮):無或僅少量腫瘤細胞壞死,可見廣泛的腫瘤細胞殘留。據此將TRG 0和TRG 1級歸類為療效良好組,將TRG 2和TRG 3級歸類為療效不良組。
4.圖像VOI選取和特征提取
分別將nCRT前、后采集到的DICOM圖像導入后處理平臺(大數據智能分析云平臺,慧影醫療科技有限公司,北京),由兩名具有5年以上經驗的放射科醫師采用手動方式在T2WI圖像上分別沿病變邊緣逐層勾畫興趣區(region of interest,ROI),自動生成病灶的三維容積興趣區(volume of interest,VOI),見圖1。分為兩種模型提取特征,Model 1:僅提取基線影像組學特征;Model 2:提取治療前基線和治療后改變的影像組學特征,代表nCRT后的組學變化。分為以下兩類特征:①基于特征類:一階統計量特征(first order statistic),形狀特征(shape-based),紋理特征(texture),包括:灰度級共生矩陣(gray level co-occurrence matrix,GLCM)、灰度級長度矩陣(gray level run length matrix,GLRLM)、灰度級形狀矩陣(gray level size zone matrix,GLSZM)和領域灰度差分矩陣(neighborhood gray-tone difference matrix,NGTDM);②基于過濾器類:小波分析(wavelets)、拉普拉斯轉換(laplacian transforms)、對數特征(logarithm)、指數特征(exponential)、明可夫斯基函數(minkowski functionals)、分形維數(fractal dimensions)等方式處理后再提取的高階特征,共1409組,Model 1:1409個特征,Model 2:2818個特征。
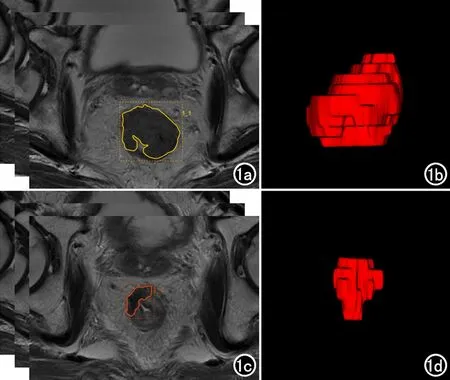
圖1 直腸癌病灶分割示意圖。a)基線高分辨T2WI,逐層勾畫ROI;b)治療前病灶重建VOI;c)治療后復查高分辨T2WI,逐層勾畫ROI;d)治療后病灶重建VOI。
5.模型構建及統計學分析
首先將上述獲取到的兩種方法的所有特征分別進行組內相關系數(intraclass correlation coefficient,ICC)分析,選擇ICC>0.8的特征,最后采用最小絕對收縮算子算法(least absolute shrinkage and selection operator,LASSO)進行降維,分別選擇對TRG分級最有價值的特征。隨機選取70%的病例作為訓練集構建隨機森林(random forests,RF)模型,剩余30%的病例作為測試集,兩種方法分別進行驗證。兩種模型分別繪制受試者操作特征(receiver operating characteristic,ROC)曲線,計算曲線下面積(area under curve,AUC)、敏感度、特異度、95%置信區間(95% CI)、符合率、陽性似然比、陰性似然比、陽性預測值、陰性預測值。采用Delong檢驗比較組間差異。采用決策曲線分析(decision curve analysis,DCA)評估不同風險閾值下的臨床獲益。
結 果
1.病理結果
最終共納入80例LARC直腸癌患者(臨床分期T3-4,N0,M0或任何T,N1-2,M0),nCRT后臨床評估49例患者降期(61.25%)。根據術后病理報告:TRG 0級15例(圖2),TRG 1級14例,TRG 2級32例(圖3),TRG 3級19例。療效良好組29例(36.25%),療效不良組51例(63.75%)。療效良好組男、女性別比為21:8,平均年齡55.6±9.3歲;療效不良組男、女性別比為39:12,平均年齡56.8±10.1歲,兩組間性別及年齡差異無統計學意義(χ2=0.162,P=0.790;t=0.525,P=0.601)。
2.影像組學特征
Model 1初始1409個組學特征,其中121個特征ICC<0.8;Model 2初始2818個特征,272個特征ICC<0.8,兩種方法差異無統計學意義(χ2=1.262,P=0.286)。去除ICC<0.8的特征后Model 1降維得到28個相關特征;Model 2降維得到3個相關特征(圖4)。
3.隨機森林分類器模型的建立及診斷效能評價
降維后的兩組影像組學特征與TRG分級建立隨機森林(RF)分類器模型。Model 1和Model 2的訓練集AUC分別為0.698、0.708,Model 1和Model 2的測試集AUC分別為0.943、0.950,組間比較Delong檢驗P值為0.848(表1,圖5)。決策曲線顯示總體上兩種預測模型均有臨床獲益(圖6)。
討 論
1.傳統影像學對直腸癌nCRT療效評估的局限性
TRG作為新輔助治療后的一個預后獨立因子,廣泛應用于評估直腸癌新輔助治療的療效[6]。但是,TRG作為金標準依靠術后病理進行分級,因此如何應用影像學方法來術前準確評估直腸癌新輔助治療的療效便成了一個非常迫切的問題。目前利用MR腫瘤消退分級(MR imaging tumor regression grade,mrTRG)進行術前療效評估受到廣泛關注,但是mrTRG分級系統基于高分辨T2WI,對腫瘤大小及信號變化進行評價,根據主觀判斷分為五個等級(mrTRG1-5),而病理TRG分為0~3共4個等級(NCCN指南推薦根據Ryan R等的分級系統)[3],兩種分級系統無法對應。因此本研究希望引入影像組學的方法來分析組學特征與病理TRG的關系。
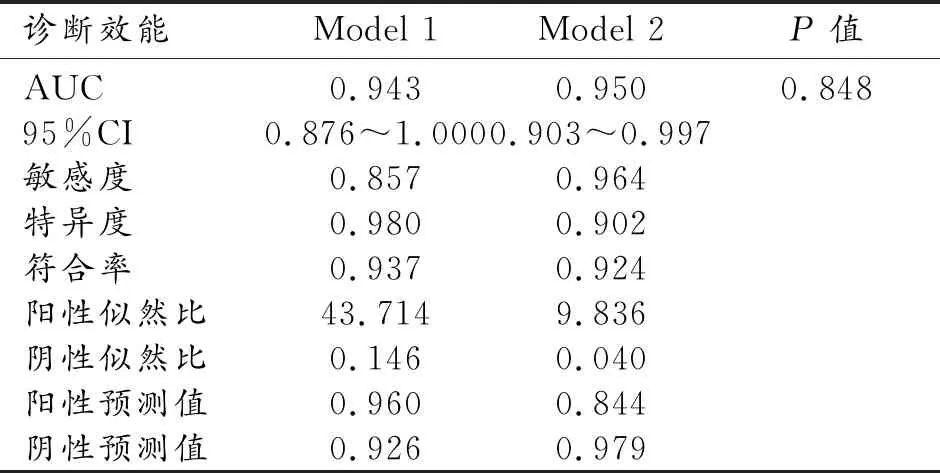
表1 兩種模型測試集ROC曲線分析

圖2 男,64歲,大便帶血1年余。a)基線高分辨T2WI示直腸前壁不均勻增厚占管腔3/4圈(箭);b)nCRT后復查高分辨T2WI示直腸前壁見低信號疤痕殘留,提示病灶明顯退縮(箭);c)病理示(直腸)新輔助治療后,未見癌組織,符合直腸癌新輔助放化療后腫瘤完全退縮,TRG 0級(HE,×1)。 圖3 男,38歲,無明顯原因大便次數增多6個月余。a)基線高分辨T2WI示腸壁增厚占管腔1/4圈(箭);b)nCRT后復查高分辨T2WI示病灶體積較前縮小(箭);c)病理示(直腸)中分化腺癌,新輔助治療后輕微退縮,TRG 2級(HE,×20)。
影像組學是應用高通量運算提取并整合醫學影像中海量的肉眼無法識別的數字化信息,規避了觀察者本身對于影像特征解讀的主觀偏向,從而擁有了能夠量化分析腫瘤異質性的能力[8],輔助醫師做出治療決策[9-11],有望成為精準影像醫學的重要基石[12]。目前,一些國內外學者已開始進行影像組學對結直腸腫瘤nCRT后療效評價的相關研究[13-17]。本研究采用RF分類器,屬于監督式學習,是一種包含多棵決策樹的集成學習方法,每棵分類樹通過Boot strapping算法(自助法)訓練子分類器,通過組合子分類器的投票結果獲得最終分類結果[18],能夠減少問題的復雜性和節省訓練時間,增強了分類模型的泛化能力,不容易過擬合,且具有較強的抗噪能力。
2.影像組學模型對直腸癌nCRT療效評估的效能
本研究對接受新輔助治療的LARC患者分別提取治療前基線檢查的影像組學特征以及治療前后的組學特征,建立這兩種不同維度的模型。Model 1的特征提取方法僅納入腫瘤本身的基線組學特征,更直接反應腫瘤負荷[13],傾向于體現模型對療效的預測能力,而Model 2聯合了治療前后的組學特征,特征的改變更接近于術后病理特征,建立的模型側重于治療后的再評價能力[15-16]。

圖4 TRG相關影像組學特征。a)Model 1,28個特征;b)Model 2,3個特征。

圖5 兩種模型測試集ROC曲線。 圖6 決策曲線評估臨床獲益。Y軸是凈收益,通過獲得真陽性然后減去假陽性來計算的;X軸表示風險因素的概率閾值。當概率閾值為10%~80%時,采用影像組學方法預測TRG分級優于將所有患者都看作療效良好,也優于將所有患者看作療效不良。兩種預測模型的曲線于約55%的風險閾值處相交,此時兩種模型的臨床獲益相仿,在此之前Model 2的臨床獲益略高。
兩個模型ROC曲線分析均有較好的診斷效能,且差異無統計學意義(Model 1的AUC為0.943,Model 2的AUC為0.950,P>0.05)。其中Model 1(98.0%)的特異度高于Model 2(90.2%),且陽性似然比較高(>10),提示該模型能夠較準確地識別真正的對新輔助治療敏感的患者(模型預測療效好時真陽性的概率大)。而Model 2(85.7%)的敏感度高于Model1(96.4%),陰性似然比也較低(<0.1),表明該模型發現新輔助治療效果不佳的患者的可能性增加(模型評估療效不良時真陰性的可能性大)。同時兩種模型的陽性預測值和陰性預測值都較高,不會導致過度治療或治療延誤。
DCA結果顯示,當概率閾值為10%~80%時,兩種模型均有較大的臨床獲益。兩曲線于約55%的風險閾值處相交,此時兩種模型的凈收益相仿,在此之前Model 2優于Model 1。本組研究療效良好組占36.25%,此時Model 2的曲線位于Model 1之上,凈獲益更好。
3.局限性
本次研究仍存在以下局限性:第一,單中心回顧性的研究納入的樣本量相對較小,需設計前瞻性多中心研究,擴大樣本量以減少數據量對模型的影響;第二,由于直腸癌病灶形態欠規則,本研究采用的傳統手動勾畫興趣區的方法分割耗時久,工作量大,不適用于大規模的數據處理,且可重復性及穩定性差,這可能會影響紋理特征的準確性,基于深度學習的興趣區半自動/自動分割方法將是未來的一個重要研究內容;第三,本研究分析影像組學特征沒有結合相關臨床風險因素,有待下一步驗證研究。
綜上所述,采用MRI基線檢查的影像組學模型與治療前后改變的影像組學模型均可以判斷直腸癌新輔助治療后的腫瘤退縮程度。因此,應用影像組學模型可以對直腸癌新輔助治療的療效進行有效評估,從而實現個體化精準醫療。