細菌抗凍蛋白研究進展及其應用潛力分析
高山惠 廖麗 胥義 陳波
研究進展
細菌抗凍蛋白研究進展及其應用潛力分析
高山惠1,2廖麗2,3胥義1陳波2,3
(1上海理工大學, 醫療器械與食品學院, 上海 200093;2中國極地研究中心, 自然資源部極地科學重點實驗室, 上海 200136;3南方海洋科學與工程廣東省實驗室(珠海), 廣東 珠海 519000)
抗凍蛋白是一類在低溫下抑制冰晶生長從而保護細胞免受冰晶傷害的特殊蛋白質。抗凍蛋白來源廣泛, 包括魚類、昆蟲、植物、細菌、藻類和真菌等。相比動植物來源的抗凍蛋白, 目前針對細菌來源抗凍蛋白缺乏系統性綜述與分析。因此重點描述了細菌來源抗凍蛋白的研究進展, 并以其中活性較高、研究較多的4個抗凍蛋白來源種屬為代表, 詳細介紹了細菌抗凍蛋白目前的研究現狀、發展前景和應用潛力。
細菌 抗凍蛋白 極地 研究進展 應用
0 引言
冰凍圈約占地球總表面積的13%, 主要分布在南北兩極及高山冰川等區域, 絕大部分時間均處于零度以下低溫。此外, 地球上其他地區也會季節性經歷低溫冰凍, 而冰凍會導致冰晶的形成, 影響細胞滲透壓并對細胞產生物理損傷, 給生命帶來致命損害。然而, 即便在極端低溫下仍然孕育著豐富多樣的生命, 其中微生物是冰凍圈的重要生命類群。目前, 已知細菌在–20℃甚至更低的溫度下仍然能保持代謝和生命活動[1]。因此, 為了適應冰點以下低溫環境, 生物從生理、生化與基因等層面進化出了多種生存策略和機制, 其中一種重要的生存策略便是合成抗凍蛋白(antifree-ze protein, AFP)。
抗凍蛋白是一類能夠與冰晶吸附結合而改變冰晶生長狀態、抑制重結晶的蛋白質, 在降低溶液冰點的同時不改變熔點, 具有熱滯活性(thermal hysteresis, TH)、抑制冰重結晶性(ice recrystallization inhibition, IRI)、修飾冰晶形態等3個特性[2]。其中, 熱滯活性是區分抗凍蛋白活性高低的重要指標之一, 指抗凍蛋白以非依數性形式改變水溶液的冰點, 而導致冰點和熔點產生差值, 這個活性被稱為熱滯活性(TH)。在文獻中, 冰結合蛋白(ice-binding protein, IBP)、抗凍蛋白(antifreeze protein, AFP)和冰核蛋白(ice-nuclea-ting protein, INP)存在一定的混淆。一般情況下抗凍蛋白和冰核蛋白統稱為冰結合蛋白。與抗凍蛋白作用幾乎相反, 冰核蛋白能促進零度低溫下非均相成核, 因為冰核蛋白往往存在于細菌外表面, 因此能把冰晶形成位置控制在胞外, 從而防止細胞內部因冰晶導致的損傷[3]。抗凍蛋白和冰核蛋白同樣都是細胞在冰凍環境中的生存策略, 而且報道有些抗凍蛋白也具有較低的冰核活性, 反過來有些冰核蛋白也具有一定的抗凍活性[3-5]。
抗凍蛋白最先由加拿大科學家Devries和Wohlschlag[6]從南極海域中一種名為的魚類血清中分離。隨后從昆蟲[7]、植物[8-9]、真菌[10]、酵母[11-12]、藻類[13]和細菌[14]中均分離鑒定了不同類型的抗凍蛋白。除了對生物本身抵抗寒冷環境具有重要意義外, 抗凍蛋白也具有廣泛的應用空間, 例如在冷凍食品行業[15]、低溫生物醫學領域[16]、農業[17]、航天[18]等領域具有廣泛的應用潛力。
經過幾十年的積累, 科學家在抗凍蛋白的基因工程操作、活性檢測、抗凍機制等方面取得了諸多進展, 并且仍然不斷有新的抗凍蛋白及其基因報道。細菌抗凍蛋白的發現比魚類抗凍蛋白晚30多年, 但因為細菌抗凍蛋白具有良好的可操作性、較高的抗凍活性以及可規模化放大等特征, 逐漸成為抗凍蛋白的重要來源。
1 細菌抗凍蛋白的發現歷程
最初在細菌中發現的抗凍蛋白, 其活性低于已經發現的昆蟲來源高活性抗凍蛋白[19-21], 但后續研究發現, 細菌也可以產生高活性的抗凍蛋白。例如從南極Ace湖分離得到的菌株能產生一種高活性抗凍蛋白AFP, 其熱滯活性在2.9 μM時能達到最大(2.0°C)[14]。接著, 在細菌中陸續發現多種具有較高熱滯活性的抗凍蛋白, 這表明細菌來源的抗凍蛋白可以和高活性昆蟲抗凍蛋白媲美, 甚至在其他方面更具優勢, 意味著細菌可能蘊藏了豐富多樣的抗凍蛋白。考慮到細菌種類的高度多樣性以及大量尚未分離培養的細菌, 細菌抗凍蛋白可能成為今后抗凍蛋白, 尤其新抗凍蛋白的主要來源。
2 細菌抗凍蛋白及其來源菌株
2.1 細菌抗凍蛋白基本特征
目前研究較多的細菌抗凍蛋白約10種(見表1), 已知的分子量范圍跨度很大, 為25 ~1 500 kDa,多數集中在50~80 kDa范圍。由此可見細菌抗凍蛋白的大小差異很大, 但跟冰結合相關的結構域大小比較接近, 見圖1a。
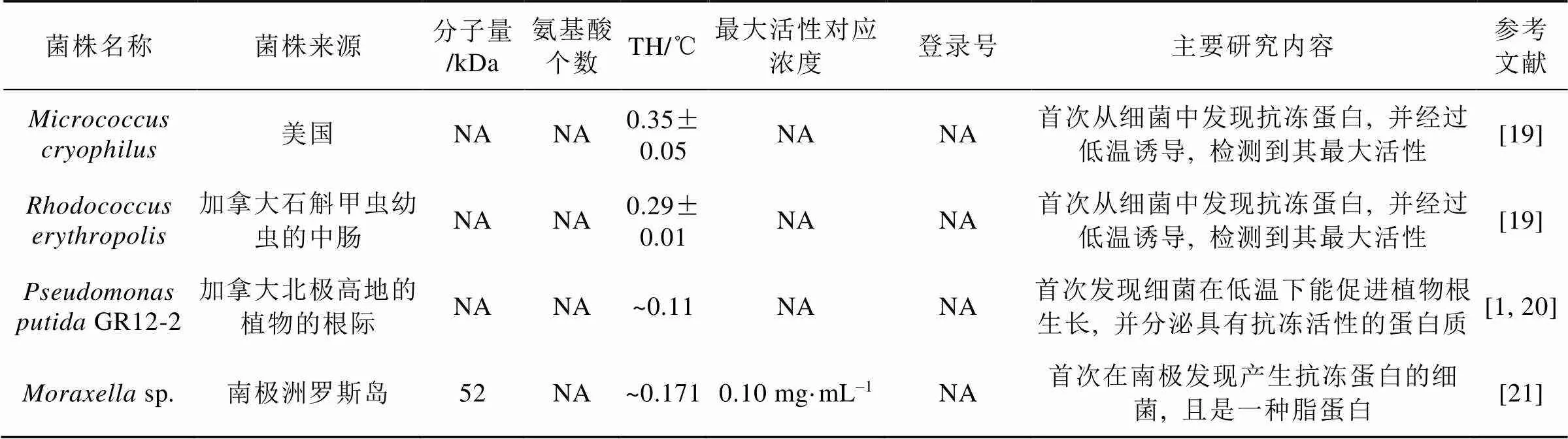
表1 細菌抗凍蛋白
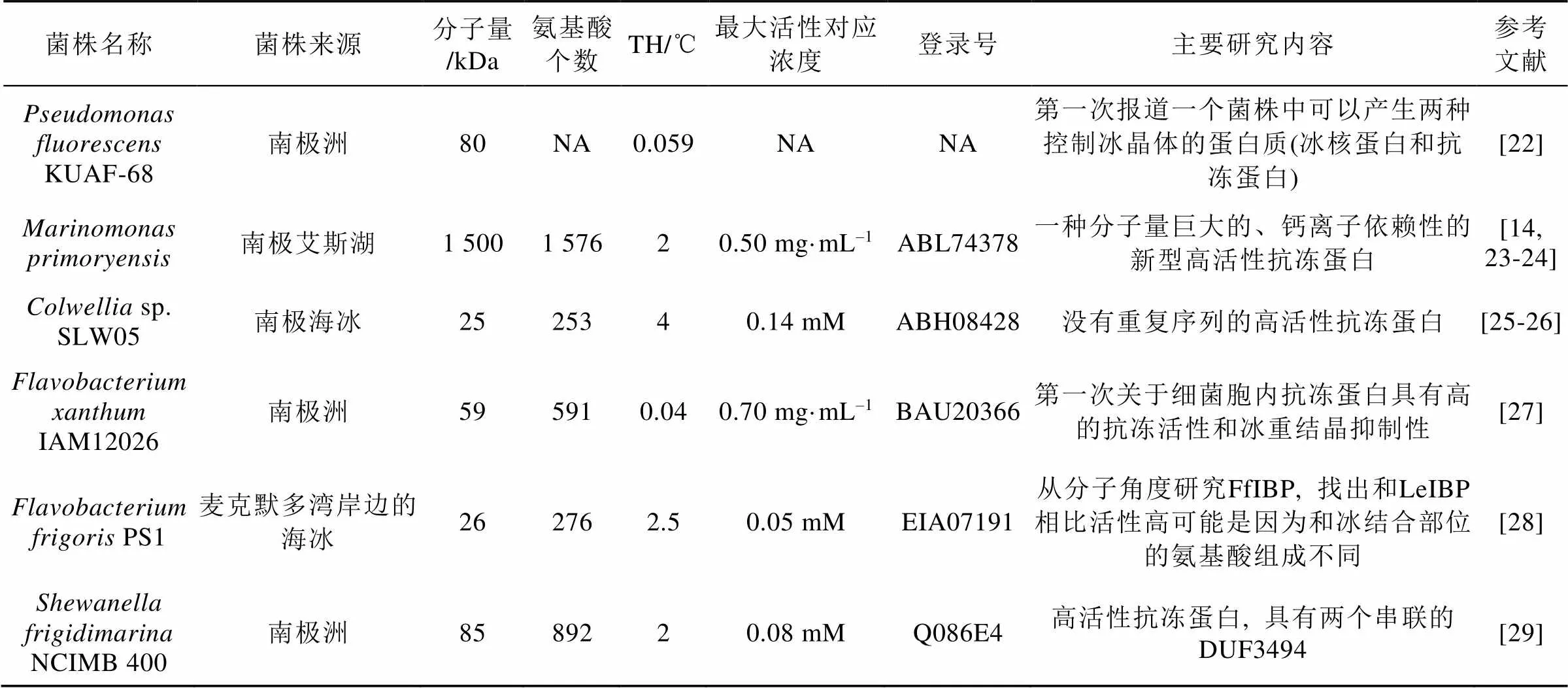
續表1
注: NA means not available.
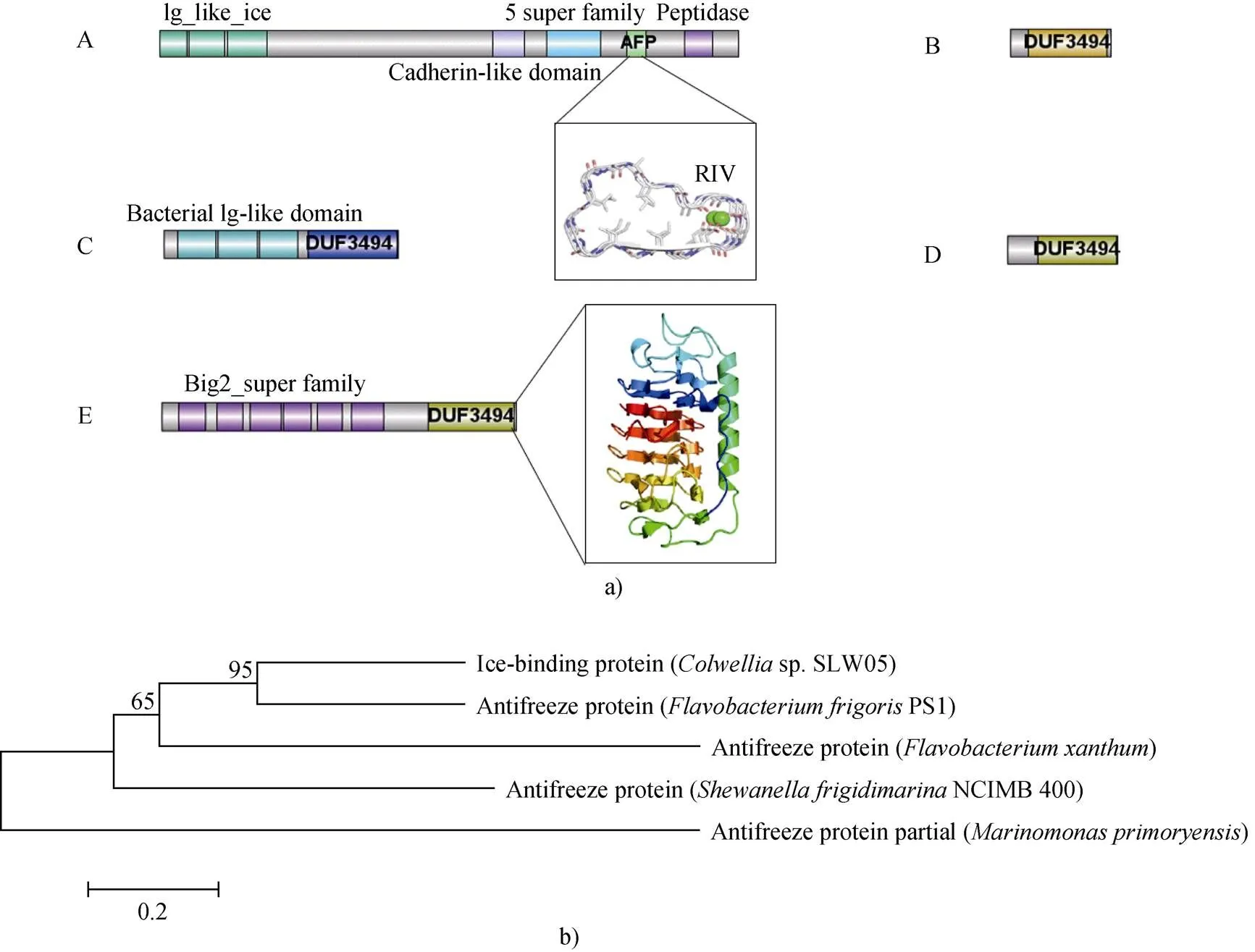
圖1 細菌抗凍蛋白結構及進化樹. a)5種主要細菌抗凍蛋白結構域示意圖;b)進化關系分析. A—E分別代表Marinomonas primoryensis來源的抗凍蛋白MpAFP、Colwellia sp.SLW05來源的抗凍蛋白ColAFP、Flavobacterium xanthum IAM12026來源的抗凍蛋白、Flavobacterium frigoris PS1來源的抗凍蛋白FfAFP和Shewanella frigidimarina NCIMB 400來源的抗凍蛋白SfIBP_1
Fig.1. Structure and phylogenetic tree of bacterial antifreeze proteins. a) schematic diagram of antifreeze protein domains of five bacterial species; b) analysis of evolutionary relationship. A to E standards for AFPs from(AFP),sp.SLW05 (AFP),IAM12026,PS1 (AFP) andNCIMB 400 (IBP_1), respectively
其中來自的巨型抗凍蛋白因為有長串的結構域II而導致分子量巨大, 但跟冰結合的結構域僅為300多個氨基酸, 該抗凍蛋白在后面進行了詳細介紹。而其他的抗凍蛋白均含有DUF3494這個未知功能結構域, 該結構域可能在抗凍蛋白中廣泛存在并與冰結合, 是冰結合蛋白(IBP)中分布最廣泛的一個結構域[30]。
DUF3494結構域通常屬于黃桿菌和類桿菌屬的細菌, 但由于其數量太多, 因此不確定含有這個結構域的蛋白是否都與冰結合有關。在Pfam數據庫中, 預測865個蛋白含有DUF3494, 其中單個DUF3494結構域具有代表性, 含有一個N末端信號肽, 可以分泌到周圍環境中, 為生物開辟一個新的適宜環境, 且多與別的結構域結合共同發揮作用, 如圖1a中的E。有趣之處在于, 同樣含有DUF3494結構域的抗凍蛋白呈現出了不同范圍的TH活性, Vance等[31]推測抗凍蛋白的TH不能由單一的DUF3494結構決定, 而取決于全部結構域的組合。
將這些抗凍蛋白中和冰結合有關的結構域部分的氨基酸序列采用軟件MEGA-X中的鄰接法構建系統進化樹, 并進行比較分析(見圖1b), 發現和這兩個屬的抗凍蛋白在進化上較為接近, 而且經過保守結構域分析也可以發現它們都含有DUF3494結構域, 而不含DUF3494結構域的屬抗凍蛋白在進化上也同其余抗凍蛋白關系較遠。
此外, NCBI蛋白數據庫中還有很多尚未發表但公布了序列的疑似抗凍蛋白序列, 有些序列是通過基因組測序后預測得到的。從這些尚未驗證的序列來看, 最小的抗凍蛋白可能只有10 kDa左右, 平均約400 kDa大小。由此可見, 抗凍蛋白可能具有一定的普遍性和多樣性, 這些未知的序列可能將為抗凍蛋白的研究帶來新的認識。
從抗凍蛋白的熱滯活性分析,、sp. SLW05、PS1和NCIMB 400菌株產生的抗凍蛋白均屬于高活性。根據抗凍蛋白的熱滯活性, 將0~2℃認為中活性, 而高活性抗凍蛋白在同等TH下, 濃度僅為十分之一, 甚至最高TH, 可達2~13℃[3, 31](表1)。其中以的抗凍蛋白熱滯活性最高。熱滯活性的大小跟蛋白質分子量沒有直接的相關性, 但有研究[29]表明熱滯活性大小和冰結合結構域的數量有正相關性。
從蛋白質空間結構特征分析, 與冰結合面常常形成β折疊片組成的β螺旋扁平狀結構, 這種結構特征似乎在包括魚類、昆蟲和微生物在內的抗凍蛋白都普遍存在, 暗示著抗凍蛋白的抗凍機制可能具有普遍性。
[5] Hillary Rodham Clinton, Secretary of State, Interview With Greg Sheridan of The Australian, Melbourne, Australia, November 8, 2010, http://www.state.gov/secretary/rm/2010/11/150671.htm.
2.2 抗凍蛋白來源菌株
生產抗凍蛋白的菌株往往為嗜冷菌, 大多數分離自南極或者北極等常年寒冷地區。實際上, 南北極成為產抗凍蛋白菌株的主要來源。例如從南極拉絲曼丘陵(Larsemann Hills)和西福爾丘陵(Vestfold Hills)湖泊中分離了866個菌株, 其中187株具有可能的抗凍蛋白活性(占比22%), 進一步檢測發現其中19株具有顯著的冰重結晶抑制活性, 主要屬于γ變形桿菌綱, 其次為α變形桿菌綱[32]。從北極冰塵中分離的14個菌株中有8個具有抗凍蛋白活性(占比一半以上), 分別來自和兩個屬, 其中一株能產高熱滯活性的抗凍蛋白[33]。此外, 從南極發草()的葉際分離得到的菌株中, 32個(占比21%)菌株的蛋白質粗提物具有抑制重結晶的功能[34]。從南極島嶼與大陸的多處樣品中, 分離獲得103株菌, 經過反復凍融處理獲得17株能產生冷凍保護劑的菌株, 經過熱滯活性檢測后, 8株菌顯示了0.3~0.5℃的熱滯活性, 對其中3株熱滯活性最高的菌株進行了進一步分析, 鑒定為,和屬的細菌, 并從這3個菌株中分離純化了4個抗凍蛋白, 分子量在34~51 kDa; 作者還進一步測序了這3個菌株的基因組, 從中鑒定了4個抗凍蛋白編碼基因。除了針對抗凍蛋白合成菌株進行廣泛篩選外, 目前已經對代表性細菌抗凍蛋白進行了較為詳細和深入的研究, 詳見表1。產生這10個抗凍蛋白的菌株也基本都來自南極或者北極的多種環境樣品, 包括海冰、湖冰、植物根際等, 只有一株分離自未知來源的甲蟲腸道例外。這些前期的菌株分離與抗凍活性分析表明, 南北極確實具有合成抗凍蛋白的豐富菌株資源, 也表明有更多未知的抗凍蛋白有待發現。
從系統發育上分析, 產生抗凍蛋白的菌株主要分布在放線菌門, γ、β和α變形桿菌綱, 擬桿菌門等類群(表1), 從屬的分布來看, 最常見的產抗凍蛋白的細菌屬為, 其次為, 另外在和等屬也有產抗凍蛋白的菌株報道。如果加上尚未驗證的抗凍蛋白序列, 屬水平的多樣性會更高(見圖2)。可見抗凍蛋白合成菌株在屬水平具有良好的多樣性, 表明利用抗凍蛋白來防止冰晶的損傷從而適應極端低溫環境是一種比較普遍的機制, 同時也表明細菌來源的抗凍蛋白具有來源廣、多樣性高的優勢。細菌抗凍蛋白以這4個屬研究最多, 下面以這4個屬的代表性抗凍蛋白為例來詳細闡述細菌抗凍蛋白的研究進展。
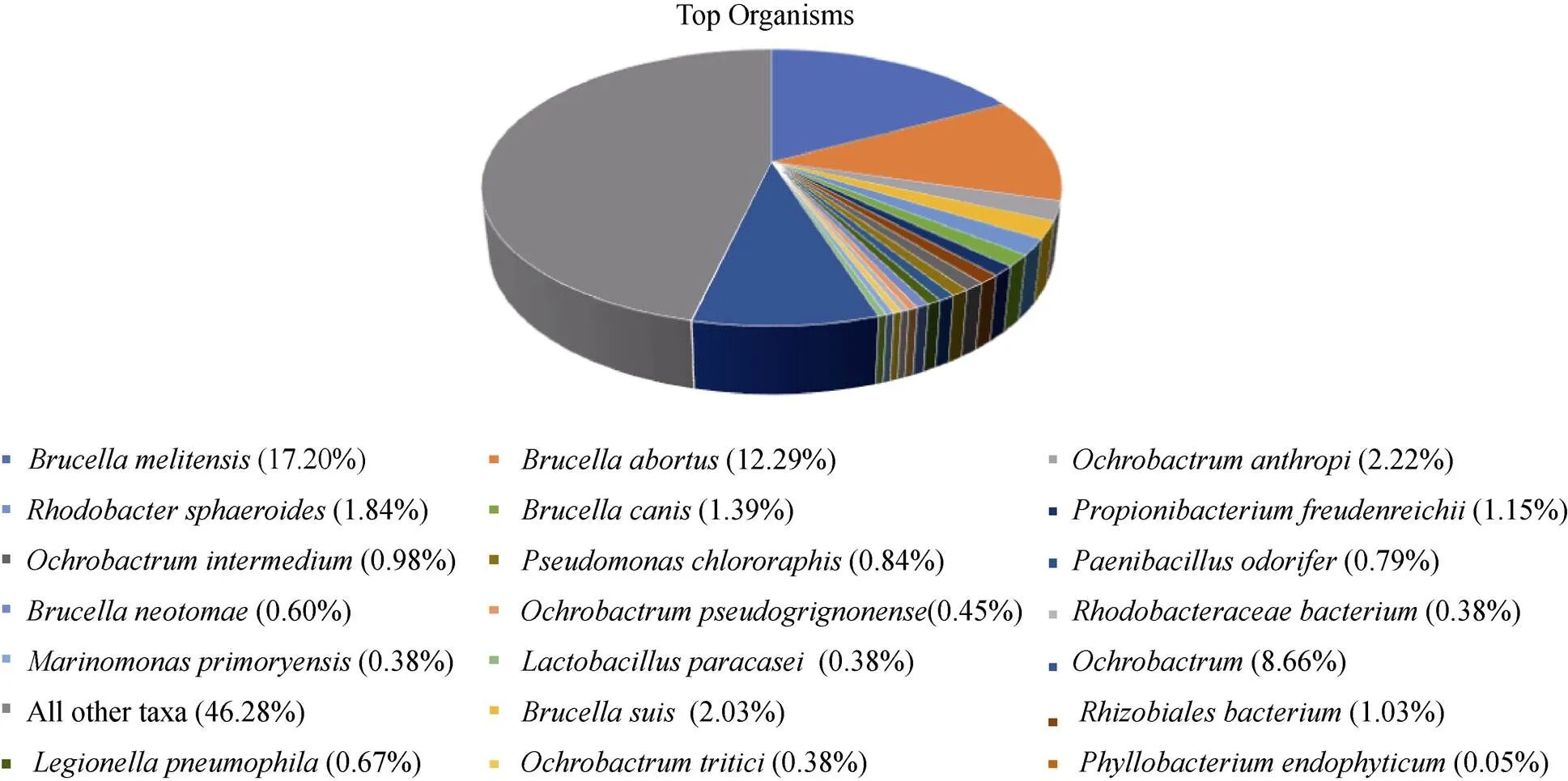
圖2 疑似抗凍蛋白主要種屬分布圖
Fig. 2. Distribution of putative antifreeze protein-producing species
3 代表性細菌抗凍蛋白
3.1 Marinomonas屬抗凍蛋白
屬研究最多的抗凍蛋白來自南極Ace湖的菌株所產生的巨型抗凍蛋白。2005年, Gilbert等[23]首次在細菌中發現了巨型抗凍蛋白AFP, 其分子量高達1.5 MDa, 屬于一種鈣離子依賴性蛋白, 熱滯活性高達2℃, 這是首次從細菌中發現高活性的抗凍蛋白。隨后通過構建λ基因組文庫獲得AFP部分序列, Guo等[35]通過序列分析確定該AFP包含5個不同分區, 并完成冰結合結構域的克隆與表達, 共包含322個氨基酸, 建模分析表明冰結合區呈現β-螺旋結構, 重組蛋白在0.5 mg·mL–1濃度下即可達到2℃熱滯活性。
2011年, Guo等[35]闡明了AFP的冰結合機制, 確定為“包合物錨定”機制。通過確定抗凍蛋白的X射線晶體結構, 解釋了這個抗凍蛋白的鈣離子依賴性, 并且提供了直接的實驗證據, 表明固定的包合物將抗凍蛋白和冰結合。在此之前, 關于冰結合中氫鍵和疏水作用的貢獻已經爭論了30多年, 該研究確定了冰結合結構域折疊成結合了鈣離子的平行β-螺旋, 通過疏水作用將水分子排列成冰狀晶格并通過氫鍵直接結合到多肽骨架和相鄰的側鏈上, 由此表明這兩種作用在冰結合中不可或缺。而且AFP能同時結合冰的主棱面和基面, 這也是其高活性的主要原因, 尤其和基面結合的能力是抗凍蛋白活性高低的關鍵決定因素, 中度活性的抗凍蛋白能夠使水分子吸附到多個冰平面, 但不包括基面[35]。關于冰結合面的示意圖如圖3所示。
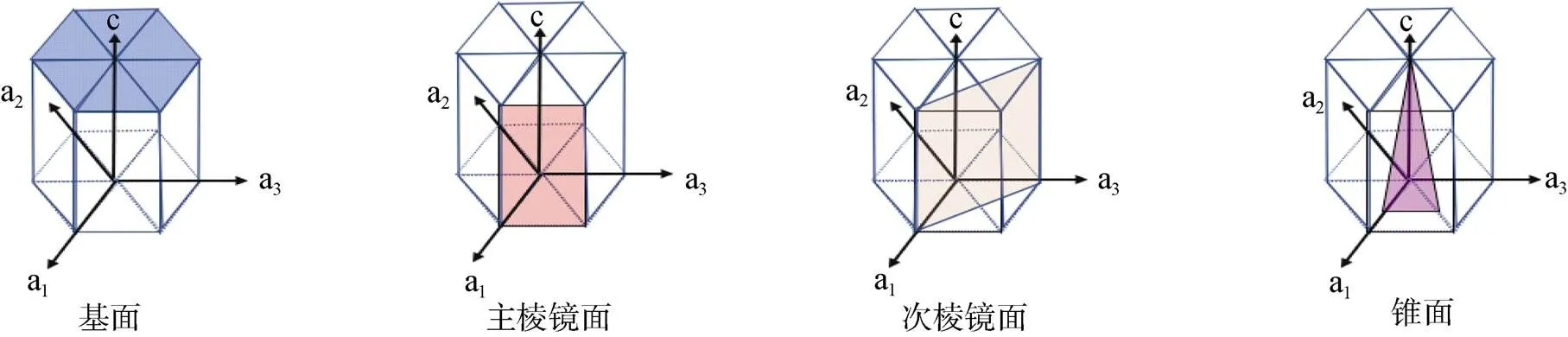
圖3 六邊形冰的不同晶面(修改自Voets[36])
Fig.3. Different crystal planes of hexagonal ice(Modified from Voets[36])
由于AFP分子量巨大, 結構域又多, 完整結構的解析非常具有挑戰, 在多個團隊[24, 27, 35, 37-38]共同努力下最終鑒定了組成AFP的5個區域的空間結構。N端區域Ⅰ負責將整個蛋白錨定到細胞外膜; 區域Ⅱ為最長最大的部分(占據整個蛋白質量的90%), 包括大約120個左右的免疫球蛋白類似的β-三明治結構域, 類似于一個長長的手臂將蛋白的余下區域投射到胞外; 區域Ⅲ包含配體結合結構域, 由5個β-三明治結構域組成一個“Y”形狀, 負責將藻類和細菌本身結合起來, 起到黏附劑的作用; 區域Ⅳ為唯一的冰結合結構域, 類似毒素重復結構(RTX, repeats-in-toxin), 跟之前解析的結構一致, 除了抑制冰結晶外, 同時也能將細菌通過區域Ⅰ和Ⅱ錨定到冰面; 區域Ⅴ有兩個結構部分, 包括可能從區域Ⅳ重復和分化而來的RTX結構域和作為Ⅰ型分泌信號系統(T1SS)的結構域。AFP不僅能使該菌在冰凍的南極湖泊中免受冰凍損傷, 還有利于細菌固定到冰面或藻類尋求更好的氧氣和營養供應。
除了菌株外, 在多個菌株中也發現該蛋白類似序列, 但不確定是否具有冰結合和抗凍活性, 但這個屬沒有發現DUF3494這個廣泛存在于抗凍蛋白中的結構域。
3.2 Colwellia屬抗凍蛋白
屬目前發現可以產生抗凍蛋白的細菌來自南極海冰菌sp. SLW05。2007年, Raymond等[25]首次從南極海冰菌sp. SLW05中發現了一種分泌在細胞外的, 可以改變冰生長形態的物質。sp. SLW05是從海冰中的鹽水通道中分離出來的[25], 在海冰中, 研究者[39]認為IBP對維持生物體的生存至關重要, 在細胞外空間僅分泌少量具有有效活性的AFP, 不僅可以支持細菌本身, 而且可以支持海冰環境中的共存生物。初步鑒定分子量為25 kDa左右后, 通過基因測序, 發現這是一個編碼253個氨基酸的蛋白質。序列分析顯示該蛋白同此前發現的兩種來自海冰硅藻和雪霉所分泌的冰結合蛋白相似度較高, 分別為59%和60%。重組蛋白顯示了冰結合活性和重結晶抑制性。
在Raymond等人鑒定了AFP和多種嗜冷微生物產生的抗凍蛋白有同源性的研究基礎上, Hanada等[26]對該抗凍蛋白的基因進行了克隆與異源表達, 重組的抗凍蛋白在0.14 mM濃度下表現出4℃的熱滯活性, 并利用了熒光對其冰平面親和力進行分析, 觀察到這個抗凍蛋白和冰的多個平面相結合, 其中包括基面。這表明AFP是一種高活性的抗凍蛋白, 對其晶體結構的解析表明該抗凍蛋白和冰結合的部分同已知的抗凍蛋白同系物類似, 是一個不規則的β螺旋結構。通過分子對接和同系物突變研究證明,AFP具有兩個冰結合位點, 分別為β螺旋區和相鄰的環區, 并且這兩個區域看似相連接, 但是卻相對獨立的和冰的多個平面結合, 發揮抗凍特性。在環境選擇壓力下, 有多個冰結合位點(IBS)對微生物是有益的, 當一個發生突變而失活的時候, 由于存在另一個活性IBS, 蛋白質的抗凍活性能夠繼續發揮作用。該研究表明, 嗜冷微生物通過抗凍蛋白以一種新的方式和冰結合來保護自身免受低溫傷害。
AFP除了通過位于β螺旋平面和相鄰環區的兩個活性復合位點來與冰結合之外, 最突出的一個特征是與冰結合區域的序列中并沒有重復序列, 而此前發現的高活性抗凍蛋白中均有特有的(TXT)重復序列出現。且AFP會在垂直于c軸的6個方向上引起冰的爆發性生長, 表明該抗凍蛋白對冰晶的基面和棱鏡面具有較好的親和力, 而冰晶在垂直于c軸方向破裂的現象是所有高活性AFP的關鍵特征[40], 同時映證了AFP具有較高的TH活性。且該細菌的結構域中存在高活性抗凍蛋白結構域DUF3494。
3.3 Flavobacterium屬抗凍蛋白
2012年, Raymond和Kim[41]偶然從細菌PS1菌株中發現了抗凍蛋白, 并發現該抗凍蛋白在系統發育樹上和藻類抗凍蛋白較為接近, 其氨基酸序列相似性達47%, 表明兩者存在基因水平轉移現象。在此之前, 人們認為不同生物之間的水平基因轉移很少發生, 但是如果不同生物共享同一個棲息地, 那這種轉移發生的概率會大大增加。 Do等[42]對此蛋白做了異源表達, 其熱滯活性在50 mM時為2.5℃。同時, 研究者發現與其氨基酸序列相似度為56%的北極酵母抗凍蛋白IBP的熱滯活性卻只有lBP的十分之一。為了探究其活性差異的原因, Do等[42]對IBP進行了結晶和初步的X射線晶體衍射分析, 發現IBP在C端有個疏水環, 促使其形成二聚體, 而IBP的C端則沒有這個結構, 因此在溶液中以單體存在。對IBP而言, C端截短體比野生型蛋白具有更高的熱滯活性, 因此猜測蛋白質在單體狀態下更能自由地與冰結合, 有更高的TH活性。
在進一步結構優化和建立模型的基礎上, Do等[28]在2014年對其結構進行了一個詳細的介紹。通過對IBP和IBP兩者的結構比較, 研究者認為IBP具有高活性的原因至少有兩方面, 其一與C端的環區結構有關。IBP有較短的C端環區, 在溶液中以單體形式存在, 能更自由地與冰結合而相互作用。減少IBP的C端環區序列后, TH活性提高了13%。通過多序列比對結果顯示, 這個C端環區結構在抗凍蛋白中是最多變的區域, 沒有很好的保守性, 因此可能是IBP的獨特結構。其二在于IBP具有不同的更規則的冰結合殘基, 并且在冰結合部位有較大的表面積。IBP的冰結合位點是由一個T-a/G-X-T/N模塊組成的, 和高活性抗凍蛋白的氨基酸殘基組成類似。因此, Do等[28]認為IBP和IBP之間TH活性的差異可能是由冰結合位點的氨基酸組成不同所引起的, 由此導致了蛋白質對冰晶體的親和力和表面互補性的差異, 進而使得TH活性不同。且FfIBP的結構中發現有分子內二硫鍵的存在, 這在別的抗凍蛋白中尚未發現。
Kim等[43]利用大腸桿菌作為生物反應器, 生產重組的IBP, 以檢驗擴大生產規模的可行性。在發酵過程中, 氧氣轉移是影響細胞生長和重組抗凍蛋白產生的最重要的因素。帶有pET28a-IBP載體系統的大腸桿菌產生的重組抗凍蛋白的最終產量為1.6 g·L–1, 比先前使用pCold I-IBP載體系統發表的報告中產量高3.8倍, 最高熱滯活性為2.5℃, 對應的蛋白質濃度為9.7 μM。該研究成功實現了IBP的中試規模生產。
3.4 Shewanella屬抗凍蛋白
DUF3494是分泌性抗凍蛋白中存在的保守結構域, 廣泛分布在嗜冷菌和經常出現在寒冷環境中的細菌物種中。屬發現的抗凍蛋白是一個含有DUF3494蛋白的多結構域的代表。
Vance等[29]將之前已經發現的來自南極的細菌, 通過生物信息學的分析預測到其中含有兩個DUF3494結構域的假定蛋白(IBP)的存在。IBP具有兩個串聯的DUF3494結構域, 且這兩個結構域編碼序列間隔292 bp, 含有兩個典型的細菌啟動子, 分別屬于兩個不同的操縱子控制區。下游區域有一個C末端結構域, 與已知的含DUF3494結構域的抗凍蛋白AFP和IBP有大約50%的序列同源性, 與上游的C-末端片段約有30%的序列同源性。該報告中將上游的蛋白質稱為IBP_1,下游的稱為IBP_2, 并對其結構進行了細致的分析。在信號肽后這兩個蛋白都包含了串聯排列的β-三明治結構, 但IBP_1包含7個,IBP_2包含2個, 彼此間具有相當高的序列同源性。但是這兩個大的亞型間的相似性則較小。
迄今為止, 并沒有對含有DUF3494這個大結構域的蛋白做冰活性分析, 因此該研究對IBP_1的DUF3494結構域作為重組蛋白表達, 分析了其活性。其熱滯活性介于IBP和IBP之間, 同AFP相比,IBP_1能達到與其相當的活性(~2℃)。冰親和熒光平面分析結果顯示, 這兩個蛋白質都結合了整個冰球, 包括冰的基面, 且有抗凍蛋白結合的冰在融化期間會形成獨特的形狀, 這是高活性抗凍蛋白的典型表現。因此, 這個抗凍蛋白被認為是高活性抗凍蛋白。通過X射線研究了其冰結合區的三維結構, 進一步證實了IBP_1和冰結合的表面是一個穩定的螺線管結構, 而這個特殊的螺線管結構是由串聯的脯氨酸和靜電作用力共同介導下形成的兩個環在相互作用, DUF3494結構域和膜之間的相互作用能夠讓它們的宿主菌結合到冰上。
Vance等[29]發現, DUF3494家族的TH活性范圍較廣, 與它們在冰結合面上的多樣性有關, 這些冰結合面的氨基酸組成和與之形成的空間拓撲結構導致它們和冰面有不同的親和力。IBP_1很可能是一個新的冰黏附素家族,具有黏附蛋白特有的3個特征, 參與細胞與環境之間的接觸。這點同AFP的結構十分類似, 且功能區可直接進行比較。通過對DUF3494和冰黏附素的研究可以進一步了解生物在寒冷環境下的生存策略。
4 細菌抗凍蛋白的應用潛力
目前, 隨著低溫生物技術、轉基因技術等的快速發展, 亟需對稀有菌毒種資源(如鼠疫桿菌、霍亂弧菌、埃博拉病毒等)、人類細胞、器官和組織, 以及各類種質資源實現高質量保存, 就需要探索安全、高效、綠色的低溫保護劑方案。而抗凍蛋白作為新型低溫保護劑, 在低溫生物行業、食品、農業等領域的應用潛力巨大。因此, 獲得廉價、功能優良、具有生產潛力的抗凍蛋白的意義重大。
根據調研結果, 目前已經投入市場的抗凍蛋白主要來源于魚類, 但存在以下幾個不足之處: (1)從魚類中提取抗凍蛋白, 其成本過于高昂且來源不穩定, 不具有可持續性; (2)從魚類體內提取抗凍蛋白, 作為食品添加劑使用, 會干擾添加食品的風味; (3)魚類與昆蟲的抗凍蛋白在基因操作與放大培養等方面難度大。相比之下, 細菌抗凍蛋白的分離純化具有可操作性強, 便于量產, 來源廣泛、穩定的特點, 其市場應用潛力巨大。
迄今為止, 細菌抗凍蛋白在基礎分析方向發展較快, 但實際應用方面較匱乏, 其原因在于現有細菌抗凍蛋白的抗凍機理研究并不透徹, 分離純化到高活性的細菌抗凍蛋白較困難, 利用生物反應器大量生產的實驗研究較少。Sun等[20]在初次從植物根系的細菌中分離出抗凍蛋白, 并發現此細菌由于分泌抗凍蛋白不僅能維持自身的良好生長, 還能促進共生植物的生長。Kim等[43]利用大腸桿菌作為生物反應器異源表達IBP發酵生產抗凍蛋白, 成效不錯。Song等[44]將分離自南極細菌的不同細菌抗凍蛋白溶液和魚類Ⅲ型抗凍蛋白添加到黃瓜和西葫蘆的切片中, 同對照組相比, 未添加任何抗凍蛋白溶液的黃瓜和西葫蘆的細胞壁受到嚴重破壞, 而添加了抗凍蛋白后觀察到了保護作用, 顯示了抗凍蛋白在冷凍食品中的應用潛力。總體來講, 盡管細菌抗凍蛋白的應用潛力較大, 但尚未得到充分發揮, 亟需加大相關基礎研究工作的力度。
5 結論
關于抗凍蛋白的研究由來已久, 特別是魚類、昆蟲的抗凍蛋白研究已經比較透徹, 而細菌抗凍蛋白關注較晚。目前對細菌抗凍蛋白的結構、功能研究較全面的種屬只有和關于細菌抗凍蛋白應用部分, 則研究較少, 目前僅限于實驗室階段, 僅有一則報告利用大腸桿菌作為生物反應器異源表達IBP發酵生產抗凍蛋白, 成效不錯[43]。
南北極作為地球上環境最復雜的區域, 其極端寒冷、高輻射的氣候使得生活在南北兩極的細菌具有特殊的功能, 目前發現的所有產生抗凍蛋白的細菌均來自于兩極及其附近地區。從極地微生物中發掘高活性抗凍蛋白, 并利用大腸桿菌大量生產是一種較為可行的思路。抗凍蛋白良好的應用前景能產生巨大的經濟效益, 這對于我國利用、開發海洋與極地資源具有重要意義。
1 XU H, GRIFFITH M, PATTEN C L, et al. Isolation and characterization of an antifreeze protein with ice nucleation activity from the plant growth promoting rhizobacterium Pseudomonas putida GR12-2[J]. Canadian Journal of Microbiology, 1998, 44(1): 64-73.
2 王羽晗, 李子豪, 李世彪, 等. 植物抗凍蛋白研究進展[J]. 生物技術通報, 2018, 34(12): 16-26.
3 BAR DOLEV M, BRASLAVSKY I, DAVIES P L. Ice-binding proteins and their function[J]. Annual Review of Biochemistry, 2016(85): 515-542.
4 WILSON P W, OSTERDAY K E, HENEGHAN A F, et al. Type I antifreeze proteins enhance ice nucleation above certain concentrations[J]. J Biol Chem, 2010, 285(45): 34741-34745.
5 KOBASHIGAWA Y, NISHIMIYA Y, MIURA K, et al. A part of ice nucleation protein exhibits the ice-binding ability[J]. FEBS Letters, 2005, 579(6): 1493-1497.
6 DEVRIES A L, WOHLSCHLAG D E. Freezing resistance in some Antarctic fishes[J]. Science, 1969, 163(3871): 1073-1075.
7 于淑惠. 白蠟蟲低溫適應分子機制及抗凍蛋白功能研究[D]. 北京: 中國林業科學研究院, 2016.
8 GRIFFITH M, ALA P, YANG D S, et al. Antifreeze protein produced endogenously in winter rye leaves[J]. Plant Physiology, 1992, 100(2): 593-596.
9 SIDEBOTTOM C, BUCKLEY S, PUDNEY P, et al. Heat-stable antifreeze protein from grass[J]. Nature, 2000, 406(6793): 256.
10 NEWSTED W J, POLVI S, PAPISH B, et al. A low molecular weight peptide from snow mold with epitopic homology to the winter flounder antifreeze protein[J]. Biochemistry and Cell Biology, 1994, 72(3/4): 152-156.
11 LEE J H, PARK A K, DO H, et al. Structural basis for antifreeze activity of ice-binding protein from arctic yeast[J]. The Journal of Biological Chemistry, 2012, 287(14): 11460-11468.
12 LEE S G, KOH H Y, LEE J H, et al. Cryopreservative effects of the recombinant ice-binding protein from the arctic yeast leucosporidium sp. on red blood cells[J]. Applied Biochemistry and Biotechnology, 2012, 167(4): 824-834.
13 YU O H, KIM S J, PARK J K, et al. Identification of ice binding proteins from Antarctic Marine Algae, AnF0046 and AnF0048[J]. Journal of Bioscience and Bioengineering, 2009(108): S109.
14 GARNHAM C P, GILBERT J A, HARTMAN C P, et al. A Ca2+-dependent bacterial antifreeze protein domain has a novel beta-helical ice-binding fold[J]. The Biochemical Journal, 2008, 411(1): 171-180.
15 YIN M, GUO L, CUI H, et al. Progress in Application Research on Antifreeze Proteins [J]. Journol of Agricultural Biotechnology, 2002, 10(4): 390-396.
16 KAMIJIMA T, SAKASHITA M, MIURA A, et al. Antifreeze protein prolongs the life-time of insulinoma cells during hypothermic preservation[J]. PLoS One, 2013, 8(9): e73643.
17 VENKETESH S, DAYANANDA C. Properties, potentials, and prospects of antifreeze proteins[J]. Critical Reviews in Biotechnology, 2008, 28(1): 57-82.
18 RYKACZEWSKI K, ANAND S, SUBRAMANYAM S B, et al. Mechanism of frost formation on lubricant-impregnated surfaces[J]. Langmuir, 2013, 29(17): 5230-5238.
19 DUMAN J G, OLSEN T M. Thermal hysteresis protein activity in bacteria, fungi, and phylogenetically diverse plants[J]. Cryobiology, 1993, 30(3): 322-328.
20 SUN X, GRIFFITH M, PASTERNAK J J, et al. Low temperature growth, freezing survival, and production of antifreeze protein by the plant growth promoting rhizobacterium Pseudomonas putida GR12-2[J]. Canadian Journal of Microbiology, 1995, 41(9): 776-784.
21 YAMASHITA Y, NAKAMURA N, OMIYA K, et al. Identification of an antifreeze lipoprotein from moraxella sp. of Antarctic origin[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(2): 239-247.
22 KAWAHARA H, NAKANO Y, OMIYA K, et al. Production of two types of ice crystal-controlling proteins in Antarctic bacterium[J]. Journal of Bioscience and Bioengineering, 2004, 98(3): 220-223.
23 GILBERT J A, DAVIES P L, LAYBOURN-PARRY J. A hyperactive, Ca2+-dependent antifreeze protein in an Antarctic bacterium[J]. FEMS Microbiology Letters, 2005, 245(1): 67-72.
24 GUO S, GARNHAM C P, WHITNEY J C, et al. Re-evaluation of a bacterial antifreeze protein as an adhesin with ice-binding activity[J]. PLoS One, 2012, 7(11): e48805.
25 RAYMOND J A, FRITSEN C, SHEN K T. An ice-binding protein from an Antarctic sea ice bacterium[J]. FEMS Microbiology Ecology, 2007, 61(2): 214-221.
26 HANADA Y, NISHIMIYA Y, MIURA A, et al. Hyperactive antifreeze protein from an Antarctic sea ice bacterium Colwellia sp. has a compound ice-binding site without repetitive sequences[J]. The FEBS Journal, 2014, 281(16): 3576-3590.
27 KAWAHARA H, IWANAKA Y, HIGA S, et al. A novel, intracellular antifreeze protein in an Antarctic bacterium, Flavobacterium xanthum[J]. Cryo Letters, 2007, 28(1): 39-49.
28 DO H, KIM S J, KIM H J, et al. Structure-based characterization and antifreeze properties of a hyperactive ice-binding protein from the Antarctic bacterium Flavobacterium frigorisPS1[J]. Acta Crystallographica Section D, 2014, 70(4): 1061-1073.
29 VANCE T D R, GRAHAM L A, DAVIES P L. An ice-binding and tandem beta-sandwich domain-containing protein in Shewanella frigidimarina is a potential new type of ice adhesin[J]. The FEBS Journal, 2018, 285(8): 1511-1527.
30 CID F P, RILLING J I, GRAETHER S P, et al. Properties and biotechnological applications of ice-binding proteins in bacteria[J]. FEMS Microbiology Letters, 2016, 363(11): fnw099.
31 VANCE T D R, BAYER-GIRALDI M, DAVIES P L, et al. Ice-binding proteins and the ‘domain of unknown function’ 3494 family[J]. The FEBS Journal, 2019, 286(5): 855-873.
32 GILBERT J A, HILL P J, DODD C E R, et al. Demonstration of antifreeze protein activity in Antarctic lake bacteria[J]. Microbiology, 2004, 150(1): 171-180.
33 SINGH P, HANADA Y, SINGH S M, et al. Antifreeze protein activity in Arctic cryoconite bacteria[J]. FEMS Microbiology Letters, 2014, 351(1): 14-22.
34 CID F P, INOSTROZA N G, GRAETHER S P, et al. Bacterial community structures and ice recrystallization inhibition activity of bacteria isolated from the phyllosphere of the Antarctic vascular plant Deschampsia Antarctica[J]. Polar Biology, 2017, 40(6): 1319-1331.
35 GUO S, GARNHAM C P, PARTHA S K, et al. Role of Ca2+in folding the tandem β-sandwich extender domains of a bacterial ice-binding adhesin[J]. FEBS Journal, 2013, 280(22): 5919-5932.
36 VOETS I K. From ice-binding proteins to bio-inspired antifreeze materials[J]. Soft Matter, 2017, 13(28): 4808-4823.
37 VANCE T D, OLIJVE L L, CAMPBELL R L, et al. Ca2+-stabilized adhesin helps an Antarctic bacterium reach out and bind ice[J]. Bioscience Reports, 2014, 34(4). DOI:10.1042/bsr20140083.
38 GUO S, STEVENS C A, VANCE T D R, et al. Structure of a 1.5-MDa adhesin that binds its Antarctic bacterium to diatoms and ice[J]. Science Advances, 2017, 3(8): e1701440. DOI:10.1126/sciadv.1701440.
39 RAYMOND J A. Algal ice-binding proteins change the structure of sea ice[J]. PNAS, 2011, 108(24): E198.
40 SCOTTER A J, MARSHALL C B, GRAHAM L A, et al. The basis for hyperactivity of antifreeze proteins[J]. Cryobiology, 2006, 53(2): 229-239.
41 RAYMOND J A, KIM H J. Possible role of horizontal gene transfer in the colonization of sea ice by algae[J]. PLoS One, 2012, 7(5): e35968.
42 DO H, LEE J H, LEE S G, et al. Crystallization and preliminary X-ray crystallographic analysis of an ice-binding protein (FfIBP) from Flavobacterium frigoris PS1[J]. Acta Crystallographica, 2012(68): 806-809.
43 KIM E J, KIM J E, HWANG J S, et al. Increased productivity and antifreeze activity of ice-binding protein from flavobacterium frigoris PS1 produced using escherichia coli as bioreactor[J]. Applied Biochemistry and Microbiology, 2019, 55(5): 489-494.
44 SONG D H, KIM M, JIN E S, et al. Cryoprotective effect of an antifreeze protein purified from Tenebrio molitor larvae on vegetables[J]. Food Hydrocolloids, 2019(94): 585-591.
REVIEW OF BACTERIAL ANTIFREEZE PROTEIN RESEARCH AND ITS POTENTIAL APPLICATIONS
Gao Shanhui1,2, Liao Li2,3, Xu Yi1, Chen Bo2,3
(1School of Medical Devices and Food, Shanghai University of Technology, Shanghai 200093, China;2Polar Research Institute of China, Key Laboratory of Polar Science, Ministry of Natural Resources, Shanghai 200136, China;3Guangdong Provincial Laboratory of Southern Marine Science and Engineering (Zhuhai), Zhuhai 519000, China)
Antifreeze proteins (AFPs) are special proteins that inhibit the growth of ice crystals at low temperatures to protect cells from damage by ice crystals. They come from a wide range of sources, and have been found in fish, insects, plants, bacteria, algae and fungi. In contrast to research on AFPs derived from animals and plants, research on AFPs derived from bacteria has yet to be systematically reviewed and analyzed. Therefore, this review reports on the latest research findings on bacterial AFPs, focusing on four bacteria species and their AFPs. We also discuss the prospects and potential applications of bacterial AFPs.
bacteria, antifreeze protein, polar regions, research progress, application
2020年3月收到來稿,2020年5月收到修改稿
國家重點研發計劃(2018YFC1406702)資助
高山惠,女,1995年生。碩士,主要從事極地微生物、新型冷凍保護劑的研究。E-mail: 838130650@qq.com
廖麗,E-mail: liaoli@pric.org.cn;胥義,E-mail: xuyi@usst.edu.cn
10. 13679/j.jdyj.20200046

