IFN-γ誘導A549細胞表達PD-L1的機制研究
徐真諦 李潤芝 李元寬 楊小生
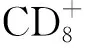
1 材料與方法
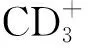
1.2 細胞株 人非小細胞肺癌細胞系A549購自中國科學院。
1.3 方法
1.3.1 細胞培養:A549細胞用含10%胎牛血清的RPIM 1640培養基置于37℃、5%的CO2孵箱中進行培養。
1.3.2 細胞刺激:A549細胞以5×105個/孔鋪于24孔板中,加入10 ng/ml的細胞因子IFN-γ、IL-17A、TNF-α或GM-CSF進行刺激24 h,或加入10 μmol/L的BAY 11-7082(NF-κB抑制劑組)、STAT5-IN-1(STAT5抑制劑組)、AS1517499(STAT6抑制劑組)、Fludarabine(STAT1抑制劑組)、FLLL32(STAT3抑制劑組)或DMSO(與抑制劑中的DMSO含量相當,DMSO組)以及培養基(對照組)預先孵育1 h,然后清洗掉孔中的培養基,再加入新的RPMI 1640培養基,同時利用10 ng/ml 的IFN-γ進行刺激24 h,收集A549細胞,用于PD-L1的水平檢測。
1.3.3 流式細胞術:胰酶消化培養的A549細胞,利用無菌PBS清洗2次,然后加入PE標記的抗人PD-L1抗體及相應的同型IgG抗體,于4℃孵育30 min,隨后用PBS清洗2次,加入4%的多聚甲醛固定20 min,再用PBS清洗2次后重懸細胞,利用流式細胞儀檢測A549細胞表達PD-L1的情況。
1.3.4 外周血單個核細胞的分離:取體檢健康人的外周血,用無菌PBS按照1∶1的體積比進行稀釋,50 ml離心管中加入淋巴細胞分離液,并將稀釋后的血液輕柔的加在淋巴細胞分離液的上層,放入離心機中,以2 000 r/min的速度離心20 min,吸取中間的白膜層細胞即為所需的單個核細胞。

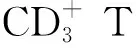
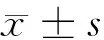
2 結果
2.1 IFN-γ誘導PD-L1表達的檢測 體外培養的A549細胞經重組人細胞因子IFN-γ、IL-17A、TNF-α或GM-CSF刺激后,檢測PD-L1的表達水平。與同型對照染色比較,PD-L1抗體染色顯示未刺激細胞中PD-L1陽性細胞比例為(39.6±5.8)%,提示A549細胞可組成性的表達PD-L1分子;當利用IFN-γ刺激后,可觀察到PD-L1陽性細胞比例為(94.3±4.9)%,與未刺激組比較差異有統計學意義(P<0.05),提示IFN-γ可誘導A549細胞上調表達PD-L1;A549細胞經IL-17A、TNF-α或GM-CSF刺激后,PD-L1陽性的細胞比例分別為(40.5±14.3)%、(43.7±16.1)%和(41.3±10.4)%,與未刺激組比較差異無統計學意義(P>0.05),提示IL-17A、TNF-α或GM-CSF刺激未能有效改變A549細胞中PD-L1的表達水平。見圖1,表1。
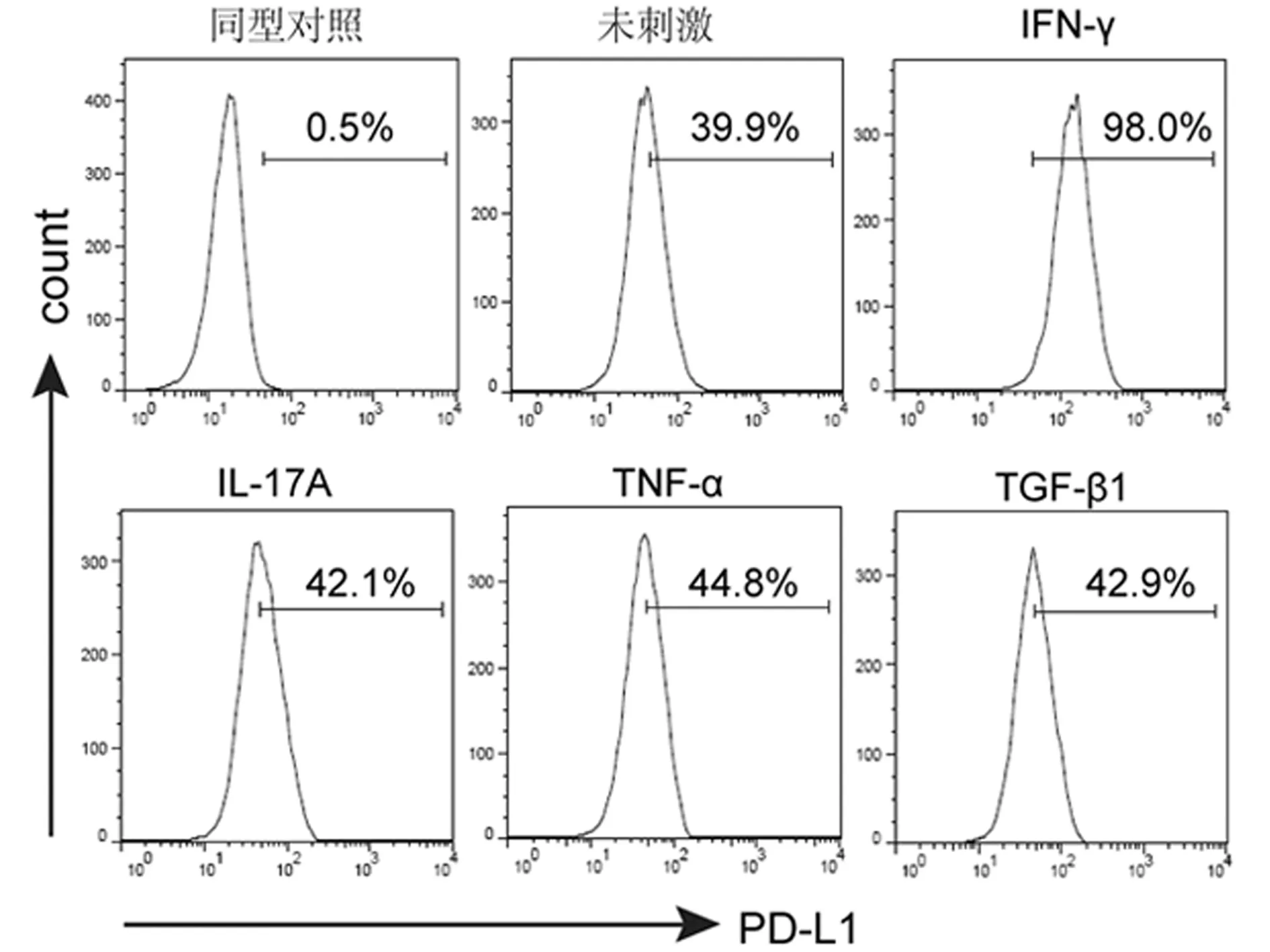
圖1 流式細胞術染色檢測不同細胞因子刺激A549細胞表達PD-L1的水平
表1 不同細胞因子刺激A549細胞表達的PD-L1水平
2.2 IFN-γ經STAT1信號參與誘導PD-L1的表達 基于IFN-γ能夠誘導A549細胞上調表達免疫抑制性分子PD-L1,我們進一步利用信號通路抑制劑預先處理A549細胞,然后再加入IFN-γ進行刺激以探討其中的信號機制。結果顯示:在IFN-γ刺激的情況下,STAT1抑制劑Fludarabine組中PD-L1的表達水平顯著低于DMSO組,差異有統計學意義(P<0.01);而NF-κB抑制劑BAY 11-7082組、STAT3抑制劑FLLL32組、STAT5抑制劑STAT5-IN-1組和STAT6抑制劑AS1517499組中PD-L1的表達水平與DMSO組基本持平,差異無統計學意義,由此提示IFN-γ通過STAT1信號通路誘導A549細胞中PD-L1的表達上調。見表2,圖2。
表2 不同信號通路抑制劑對IFN-γ誘導A549細胞表達PD-L1的影響
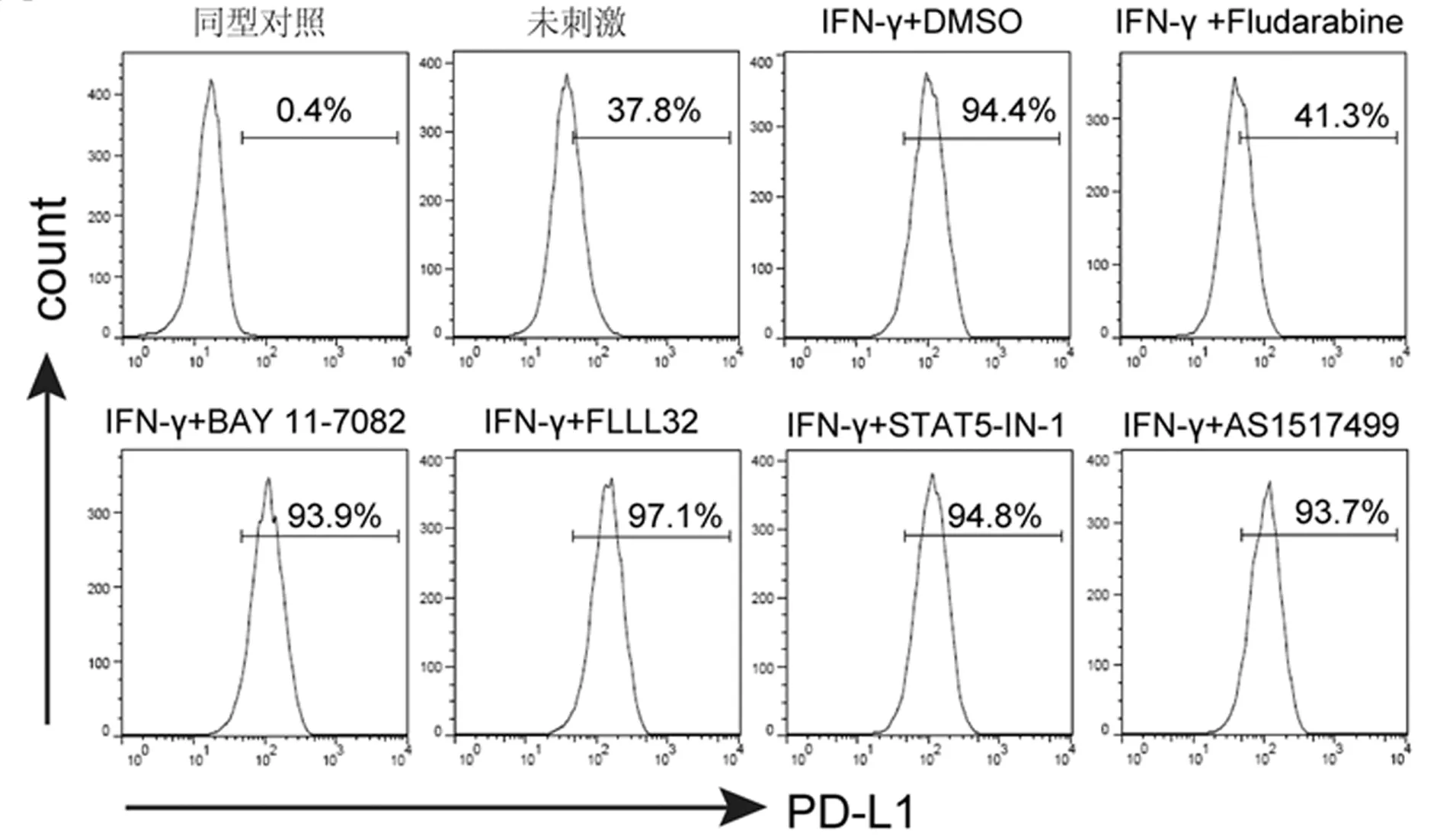
圖2 不同信號通路抑制劑對IFN-γ誘導A549細胞表達PD-L1的水平比較
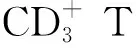
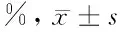
表3 IFN-γ誘導的PD-L1抑制T細胞增殖
3 討論
自PD-L1被鑒定發現后,其在腫瘤中的生物學功能得到了廣泛的研究和探討[11-13]。大量研究證實:腫瘤微環境中惡變的上皮細胞、浸潤的巨噬細胞以及中性粒細胞等多個細胞均可上調表達PD-L1分子[14,15],并通過與其特異性的受體PD-1結合抑制抗腫瘤免疫細胞的效應功能,進而有助于腫瘤的發生發展。本研究利用A549細胞作為非小細胞肺癌來源的腫瘤細胞模型,探討PD-L1分子在腫瘤細胞中的表達調控及其對T細胞增殖的影響。發現A549細胞可組成性的表達PD-L1,而促炎性因子IFN-γ則進一步通過STAT1信號誘導其表達上調,進而通過結合PD-1分子以抑制T細胞的增殖,最終促使腫瘤細胞得以躲避免疫監視。
PD-L1是1個大小為40 kD的跨膜蛋白,最早由華人科學家陳列平教授所發現并將其命名為B7-H1。當時的研究顯示其能夠影響T細胞的活性和分化功能,但并不結合CD28、細胞毒性T淋巴細胞抗原4(CTLA-4)以及誘導性共刺激子(ICOS),因此,他認為PD-L1是1個新的共刺激分子,在T細胞的活化中起著正調控作用。然而,后續的研究鑒定出PD-L1是免疫抑制分子PD-1的特異性配體,功能學實驗顯示PD-L1與PD-1結合后能夠抑制T細胞的功能,從而有助于腫瘤細胞的免疫逃逸,由此證實PD-L1為免疫抑制性分子[16]。目前,PD-L1已被發現廣泛表達于腫瘤細胞表面,且其在腫瘤細胞中的上調表達受到組織炎性微環境的影響。早期文獻報道,Wang等[17]發現在體外利用炎性細胞因子IL-17A或TNF-α刺激前列腺癌細胞系LNCaP和結腸癌細胞系HCT116,兩種細胞中的PD-L1表達水平均顯著上調;此外,Concha-Benavente等[18]在頭頸癌的研究中顯示IFN-γ亦可誘導腫瘤細胞上調PD-L1的表達,而GM-CSF則被報道能夠誘導胃癌組織浸潤的中性粒細胞上調表達PD-L1,由此提示腫瘤微環境中PD-L1的表達水平可由多個炎性因子所介導。然而,這些炎性細胞因子是否能夠直接作用于肺癌細胞,進而上調PD-L1的表達水平并不清楚。因此,本研究以A549細胞作為研究對象,在體外利用IFN-γ、IL-17A、TNF-α或GM-CSF分別刺激細胞,然后檢測其表面的PD-L1水平。結果發現:IFN-γ能夠刺激A549細胞上調表達PD-L1,但IL-17A、TNF-α或GM-CSF對PD-L1的表達則無明顯影響,由此提示非小細胞肺癌中腫瘤細胞的PD-L1高表達很可能由IFN-γ所調控。此外,最新研究顯示,腫瘤組織中共表達IFN-γ和PD-L1的肺癌患者臨床預后優于僅表達IFN-γ或PD-L1的肺癌患者[19],進一步證實肺癌微環境中IFN-γ與PD-L1的表達密切相關。盡管IL-17A、TNF-α及GM-CSF在誘導其他腫瘤細胞系或中性粒細胞的PD-L1表達過程中至關重要,但它們并不參與影響A549細胞中PD-L1的表達,這可能與細胞的類型不同或腫瘤細胞的組織來源不同有關,抑或是A549細胞未能表達這些細胞因子的相應受體,后續研究將深入分析A549細胞中炎性細胞因子相關的特異性受體表達情況。
IFN-γ通過作用于其相應的受體,進而激活下游的級聯信號,最終誘導目的基因的轉錄并翻譯成蛋白質后發揮生物學作用。文獻報道包括STAT家族和NF-κB在內的多個信號不僅能夠介導IFN-γ的下游信號傳遞,而且可以參與調控PD-L1的表達[20,21],然而,IFN-γ誘導肺癌細胞表達PD-L1的信號機制仍不清楚。因此,本研究利用多個信號通路抑制劑預先處理A549細胞,結果發現在均有IFN-γ刺激的條件下,預先加入STAT1抑制劑Fludarabine的處理組中,表達PD-L1的A549細胞陽性細胞比例顯著低于未加信號抑制劑組,而NF-κB抑制劑BAY 11-7082組、STAT3抑制劑FLLL32組、STAT5抑制劑STAT5-IN-1組和STAT6抑制劑AS1517499組中表達PD-L1的A549細胞陽性細胞比例則與未加信號抑制劑組相當,由此提示IFN-γ可刺激非小細胞肺癌A549細胞上調表達PD-L1,其功能的實現依賴于STAT1信號通路。因此,雖然IFN-γ可經其受體活化下游多個信號通路,但是針對某一特定腫瘤細胞中的PD-L1表達則很可能由單一的信號轉錄因子所介導。研究表明腫瘤細胞中PD-L1的表達上調可體現為其基因水平DNA的擴增、染色質的修飾、轉錄水平mRNA的增加、翻譯水平蛋白表達的增加以及翻譯后的修飾等多個層次的改變[22]。那么,當IFN-γ經其特異性受體激活STAT1信號后,是通過哪一個或哪幾個層次的改變以上調PD-L1的表達水平仍有待進一步證實。
PD-L1作為免疫抑制性的表面分子,已被公認為與其受體PD-1結合后抑制T細胞產生效應因子以及分泌細胞毒性顆粒[23],然而,該免疫抑制信號對T細胞增殖能力的影響仍不十分清楚。因此,本研究繼續探討了IFN-γ誘導的PD-L1是否參與抑制了T細胞的增殖效果。體外實驗顯示,相較于未刺激的A549細胞,IFN-γ刺激的A549細胞能夠顯著抑制T細胞的增殖,而當加入抗PD-L1抗體阻斷PD-L1與PD-1的結合后,T細胞的增殖能力得以恢復,由此表明IFN-γ通過誘導A549細胞上調表達的PD-L1分子參與抑制了T細胞的功能。然而,既往的研究業已證實IFN-γ本身是T細胞來源的抗腫瘤效應細胞因子,其在靶向殺傷腫瘤細胞的同時,為什么會誘導免疫抑制性分子PD-L1的表達以協助腫瘤細胞的免疫逃逸呢[24]?這可能是在腫瘤的演變進化過程中,腫瘤細胞利用免疫細胞的效應因子IFN-γ上調表達PD-L1,進而結合免疫細胞表面的PD-1分子,以負反饋的形式抑制免疫細胞釋放IFN-γ,從而避免了被免疫細胞殺傷和清除。我們將在后期的研究中,進一步探討IFN-γ在非小細胞肺癌中抗腫瘤和促腫瘤平衡中的兩面性。此外,A549是體外建立的非小細胞肺癌細胞系,雖然能夠作為細胞模型探討肺癌細胞在腫瘤微環境中的生物學功能,但其仍然不能完全替代非小細胞肺癌患者腫瘤組織中的原代肺癌細胞,后續的實驗將通過收集臨床非小細胞肺癌患者的腫瘤組織,并分離純化出腫瘤細胞加以培養和刺激,深入研究PD-L1分子在肺癌細胞中的表達調控及其臨床意義。
總之,本研究發現IFN-γ可通過激活下游STAT1信號途徑誘導非小細胞肺癌A549細胞表達PD-L1,進而通過結合PD-1以抑制T細胞的增殖能力,為全面闡明PD-L1在非小細胞肺癌微環境中的表達調控提供了新的實驗證據,將為臨床更加有效地靶向設計阻斷PD-L1及其相關調控信號STAT1提供了新思路。

