長壽地區73例結節性甲狀腺腫患者MTHFR基因C677T和A1298C多態性研究*
沈良賢,范原銘,李 泉,陳祖翼,邱孝蘭,周學剛,陶 鳳△
重慶市長壽區人民醫院:1.科教科;2.普外二科;3.檢驗科,重慶 401220;4.遵義醫科大學附屬醫院檢驗科,貴州遵義 563000;5.重慶市長壽區人民醫院超聲科,重慶 401220
結節性甲狀腺腫(NG)是單純性甲狀腺腫的后期表現形式。據報道,NG的發病率為6%~7%,且病史較長的NG可發生癌變[1-2]。有研究表明,瑞典長期實施的補碘計劃并沒有影響缺碘或碘豐富地區甲狀腺腫及甲狀腺癌的發生趨勢[3]。因而除碘外,仍有其他多種因素參與NG的發生與發展。亞甲基四氫葉酸還原酶(MTHFR)是葉酸和同型半胱氨酸代謝的一個關鍵酶。目前研究最多,且與疾病關系密切的MTHFR基因單核苷酸突變位點為C677T和A1298C,可導致熱不穩定性和(或)酶活性降低[4]。相關研究認為,這個基因的遺傳變異會影響DNA合成、修復及甲基化過程,從而影響甲狀腺癌及自身免疫性甲狀腺疾病(AITD)的易感性[5-7]。然而,MTHFR基因多態性與NG的相關研究鮮見報道,為此本研究旨在尋找MTHFR C677T和A1298C基因多態性與NG的相關性,為NG的預防及治療提供理論依據。現報道如下。
1 資料與方法
1.1一般資料 收集重慶市長壽區人民醫院2018年8月至2019年11月經術后病理確證的甲狀腺功能正常的NG患者73例作為病例組。另選取經高清晰超聲檢查甲狀腺組織正常及甲狀腺功能正常的76例體檢健康者作為對照組。納入標準:根據2015年最新出版的美國甲狀腺協會關于甲狀腺結節和分化型甲狀腺癌的管理指南進行病理診斷。排除標準:(1)代謝性疾病(高血壓、糖尿病、血脂異常);(2)甲狀腺疾病(甲狀腺炎、甲狀腺良惡性腫瘤);(3)其他惡性腫瘤;(4)精神障礙。本研究符合人體試驗倫理學標準,并得到重慶市長壽區人民醫院倫理委員會的批準及患者知情同意。
1.2儀器與試劑 Hema3200PCR擴增儀、HemaTGL-16R冷凍離心機購自珠海黑馬公司;一次性乙二胺四乙酸二鈉(EDTA-Na2)真空抗凝管;血液基因組DNA抽提試劑盒升級款和PCR擴增試劑購自上海生工生物工程股份有限公司。
1.3方法
1.3.1基因組DNA提取 抽取外周靜脈血2 mL,EDTA-Na2抗凝,-80 ℃保存待用。采用Ezup柱式血液基因組DNA抽提試劑盒升級款提取DNA。
1.3.2引物設計及合成 引物由上海生工生物工程股份有限公司合成,rs1801133上游引物5′-AACAATGTTTAATCCGGTGCC-3′,下游引物5′-ATCCTTTGGGATCTTT-3′;rs1801131上游引物5′-CACTCCAGCATCACTCACTTTG-3′,下游引物5′-AAGAAGTTTGCATGCTTGTGG-3′。
1.3.3PCR擴增 反應體系25.0 μL,ddH2O 18.3 μL、10.0×緩沖液(含MgCl2)2.5 μL、dNTP (10 mmol/L)1.0 μL、模板DNA 1.0 μL、Taq酶0.2 μL、Primer mix 2.0 μL。反應條件:95 ℃預變性5 min,然后按94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,循環38次,末次循環后72 ℃延伸10 min。
1.3.4基因測序 PCR產物送上海生工生物工程股份有限公司,利用一代Sanger測序的方法,對PCR產物進行測序。
1.3.5基因型分析 通過sequence analysis軟件對序列質量進行初步分析,并通過DNAMAN6.0.3.99軟件與GenBank(MTHFR NG_013351)的基因序列進行比較。
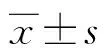
2 結 果
2.1兩組年齡、性別情況比較 病例組中,男11例,女62例;年齡21~80歲,平均(51.37±10.92)歲,其中年齡>30歲的占96.05%,>60歲的占23.68%。對照組中,男40例,女36例;年齡17~92歲,平均(52.29±16.46)歲,其中年齡>30歲的占97.56%,>60歲的占19.51%。病例組與對照組年齡、性別比較,差異無統計學意義(P>0.05)。
2.2兩組男女基因型分布比較 病例組、對照組及NG組+對照組基因型C677T、A1298C男女分布比較,差異均無統計學意義(P>0.05)。見表1。

表1 兩組男女基因型分布比較(n)
2.3MTHFR C677T和A1298C基因型或等位基因的分布情況 兩組MTHFR C677T和A1298C基因型頻數均符合Hardy-Weinberg平衡(P>0.05)。病例組A1298C多態性CC基因型頻數及C等位基因頻數與對照組比較,差異均有統計學意義(P<0.05)。病例組和對照組C677T多態性比較,差異無統計學意義(P>0.05)。見表2。

表2 MTHFR C677T和A1298C基因型或等位基因的分布情況[n(%)]
3 討 論
MTHFR位于第1號染色體1p36.22,全長27.374 kb,共有外顯子12個,其編碼656個氨基酸殘基組成的蛋白,負責催化5,10-亞甲基四氫葉酸不可逆地還原為5-甲基四氫葉酸。自2003年人類基因組計劃發現MTHFR以來,在世界范圍內已發表許多關于MTHFR的分子和流行病學研究,但其與甲狀腺功能不全之間的關系的相關研究較少,且結果存在爭議。
甲狀腺激素是酪氨酸碘化物,當MTHFR基因突變時,MTHFR酶活性降低,可通過影響酪氨酸合成,從而影響甲狀腺激素的合成;其還可通過影響甲狀腺互向三碘甲狀腺原氨酸的轉化,導致甲狀腺功能減退。促甲狀腺激素(TSH)是主要的有絲分裂因子,任何使TSH水平升高的物質都會刺激結節的形成[8],提示MTHFR基因多態性有可能是NG形成的原因之一。ARAKAWA等[5]研究表明,在日本人群中未發現C677T或A1298C多態性與導致甲狀腺功能減退或亢進的AITD相關;且C677T和A1298C的基因型和等位基因頻率也不影響AITD的預后。ABU-HASSAN等[7]研究發現,約旦女性人群C677T多態性與甲狀腺功能減退或亢進的AITD無關,而A1298C多態性可能是影響甲狀腺功能減退或亢進的AITD發生的因素,且CC、TA和TC單倍型可能是甲狀腺功能減退發生的影響因素。CHEN等[6]的薈萃分析顯示,MTHFR C677T多態性與甲狀腺疾病之間沒有相關性,MTHFR C677T純合子TT基因型多態性與白種人和亞洲人的甲狀腺癌發生風險明顯相關。而本研究發現C677T多態性與NG沒有相關性,提示C677T多態性與甲狀腺癌相關,而與NG可能沒有相關性。本研究結果顯示,A1298C基因多態性可降低NG發生的風險,與ABU-HASSAN等[7]和ARAKAWA等[5]的結果相反。上述研究中的研究對象是自身免疫性甲狀腺疾病患者,因此,導致結果不一致的原因可能跟種族、地理及納入、排除標準等因素的不同有關[9],而本研究中的NG是不伴有甲狀腺功能異常的非毒性甲狀腺腫的后期表現形式,可能與甲狀腺激素水平降低,TSH水平反饋性升高及TSH長期慢性刺激甲狀腺組織有關[2],表明MTHFR基因A1298C位點多態性可能通過影響甲狀腺激素的合成、轉化來降低NG發生的風險。
本研究中NG患者年齡>30歲的占96.05%,>60歲的占23.68%,全國自1996年開始普遍實行食鹽碘化,說明大部分患者可能在中青年時期缺碘,甲狀腺已發生病理改變或已經有結節形成,在食鹽碘化后NG可能仍舊在發生,或并未得到治療,或也沒有向惡性發展。因此,除碘外,還可能有其他因素影響NG的發生、發展。也有研究表明,補碘后結節性甲狀腺腫DNA指數、異倍體率、增殖指數均明顯增高[10]。而MTHFR除了可以影響甲狀腺激素的合成及轉化外,還可以為體內嘌呤、嘧啶的合成及DNA甲基化提供甲基,從而影響DNA的合成、修復及DNA甲基化,而甲基化和DNA合成在癌癥的發展中起著至關重要的作用[11]。本研究發現,MTHFR基因A1298C位點多態性與對照組比較差異有統計學意義,表明A1298C位點多態性對NG可能是一種保護因子。
本研究對照組中C677T的T等位基因頻率、A1298C的等位基因頻率(分別為36.18%、23.03%)與YANG等[9]報道的中國人群的等位基因頻率(分別為36.9%、22.4%)接近,說明對照組選擇無偏差。病例組、對照組及病例組+對照組C677T、A1298C基因型男女分布比較,差異均無統計學意義(P>0.05),這與李丹丹等[12]、VIDUDALA等[13]報道的變異頻率沒有性別特異性的結果一致。
本研究的局限性在于:(1)樣本量相對較小,單核苷酸多態性位點少且只選擇了兩個單核苷酸多態性位點進行分析;(2)環境風險因素的缺乏限制了基因與環境相互作用的分析;(3)排除標準中,除了通過甲狀腺超聲影像檢查及血清學檢測甲狀腺功能外,僅依靠其既往病史、空腹血糖排除代謝性疾病。在今后的研究中還應擴大樣本量,評估基因、基因環境和同一基因中不同單核苷酸多態性位點之間的相互作用,執行更嚴格的納入、排除標準,將MTHFR多態性納入易感個體的篩選和檢查。
綜上所述,MTHFR基因A1298C位點單核苷酸多態性可能通過影響甲狀腺激素的合成轉化及DNA甲基化、合成修復等影響NG發生風險,而C677T位點單核苷酸多態性與NG的發生無相關性。

