合成類胡蘿卜素細胞工廠的快速構建和定向進化
王穎,曲俊澤,梁楠,郝鶴,元英進
(1 天津大學教育部合成生物學前沿科學中心,天津300072;2 天津大學系統生物工程教育部重點實驗室,天津300072;3 天津大學化工學院,天津300072)
類胡蘿卜素(carotenoids)是一類由類異戊二烯聚合物構成的天然色素,較為常見的是C40骨架的番茄紅素、β-胡蘿卜素、玉米黃質、蝦青素、辣椒紅素等四萜類化合物[1]。由于類胡蘿卜素碳骨架結構中的共價多烯結構不穩定,極易通過非特異性(光氧化、化學氧化)和特異性的方式發生裂解,進而又可以生成許多脫輔基類胡蘿卜素[2],例如β-紫羅酮、β-環檸檬醛、藏紅花酸等[3-4]。同時,這種共價多烯結構還賦予了類胡蘿卜素產品豐富的顏色(紅色、橘色、黃色)和超強的抗氧化活性,因此多被應用于功能營養品、化妝品、食品添加劑、動物飼料等領域[5]。據報道[5-6],類胡蘿卜素全球市場價值在2018 年已達到15 億美元,預計2022 年將增至20 億美元。隨著類胡蘿卜素市場需求的急劇增長,直接提取的產率低以及化學合成產品結構特異性差的問題也越來越凸顯[5]。而微生物發酵法可利用廉價的碳源合成構型、活性同天然提取的類胡蘿卜素一致的產物,是傳統生產模式的重要補充。此外,由于類胡蘿卜素具有顏色這一特征,還可作為篩選和指示標簽在合成生物學方法和工具開發中得以應用,例如,顯示類異戊二烯合成路徑和競爭路徑的通量[7-8]、示蹤病原體[9]、監控血液中鋅離子的濃度[10]等。因此,構建微生物細胞工廠合成類胡蘿卜素逐漸成為合成生物學的研究熱點。
合成生物學技術的不斷發展也極大推動了類胡蘿卜素及脫輔基類胡蘿卜素等產品在大腸桿菌(Escherichia coli)、 釀 酒 酵 母(Saccharomyces cerevisiae)、耶氏解脂酵母(Yarrowia lipolytica)等常用底盤中的高效合成(表1)。類胡蘿卜素的生物合成路徑以最基本的C5單元異戊烯焦磷酸(isopentenyl diphosphate, IPP)/二甲基烯丙基焦磷酸(dimethylallyl diphosphate,DMAPP)為節點,分為上游和下游路徑。上游路徑包含來自于真核生物和古細菌的甲羥戊酸(mevalonate, MVA)路徑及來源于原核微生物和植物質體的2-C-甲基-D-赤蘚糖醇-4- 磷酸(2-C-methy1-D-erythrito1-4-phosphate,MEP)路徑。下游路徑以IPP 和DMAPP為起始,通過多步異戊二烯基轉移反應縮合生成C20的牻牛兒基牻牛兒基焦磷酸(geranylgeranyl pyrophosphat,GGPP)。兩分子GGPP繼續縮聚形成C40的四萜骨架,之后經過連續多步脫氫、環化、羥基化、酮基化、氧化裂解等修飾反應合成多種類胡蘿卜素及其衍生物(圖1)。在異源底盤中構建類胡蘿卜素合成路徑,常采用過表達MVA 或MEP途徑蛋白[11-13]、表達N 端截短的羥甲基戊二酰輔酶A 還原酶(tHMGR1)[14-15]、改造內源中心代謝[16-18]等萜類產物合成的通用策略,以提高前體IPP/DMAPP 的供給。值得注意的是,有別于其他萜類產品,類胡蘿卜素的合成需要強化前體GGPP的供應和利用。而多數IPP/DMAPP 下游路徑蛋白具有較為寬泛的底物選擇性和催化多步連續反應的能力[19],易于形成代謝瓶頸,積累代謝中間體。且類胡蘿卜素產品強還原性[20-21]和質膜插入積累[22]的特點常給底盤細胞帶來脅迫壓力,成為提高該類產品合成水平的重要限制因素。
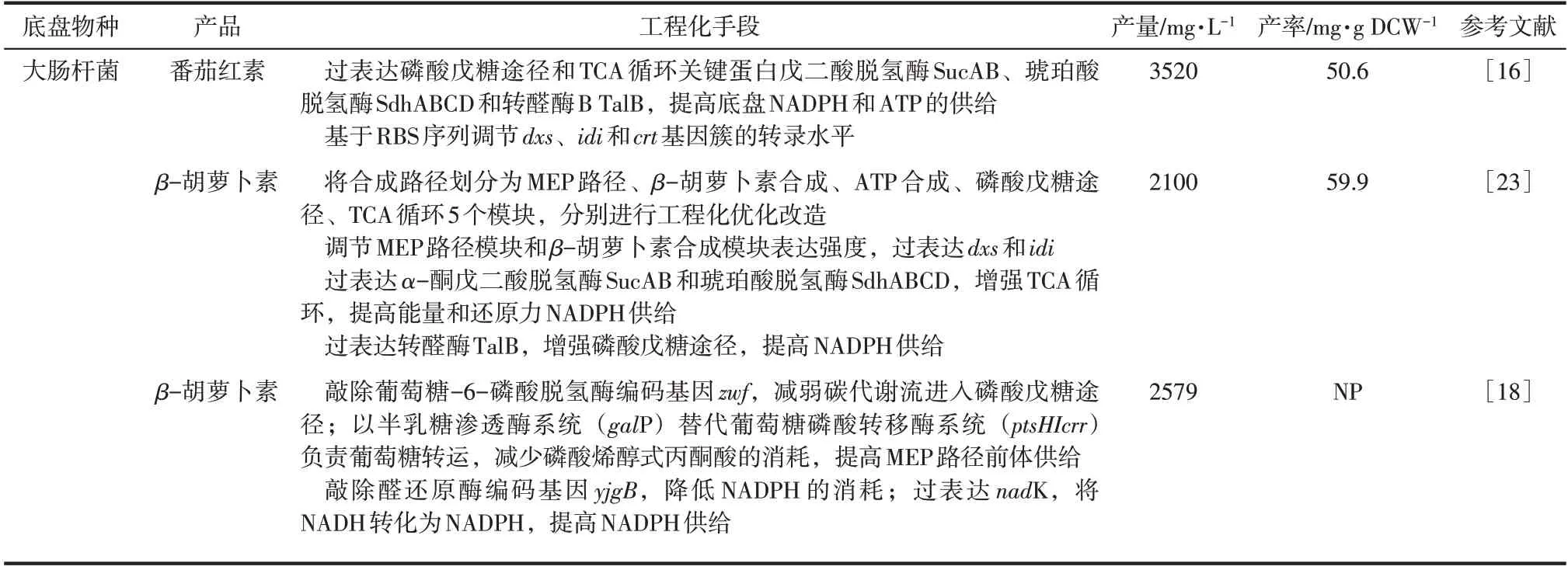
表1 構建類胡蘿卜素細胞工廠示例
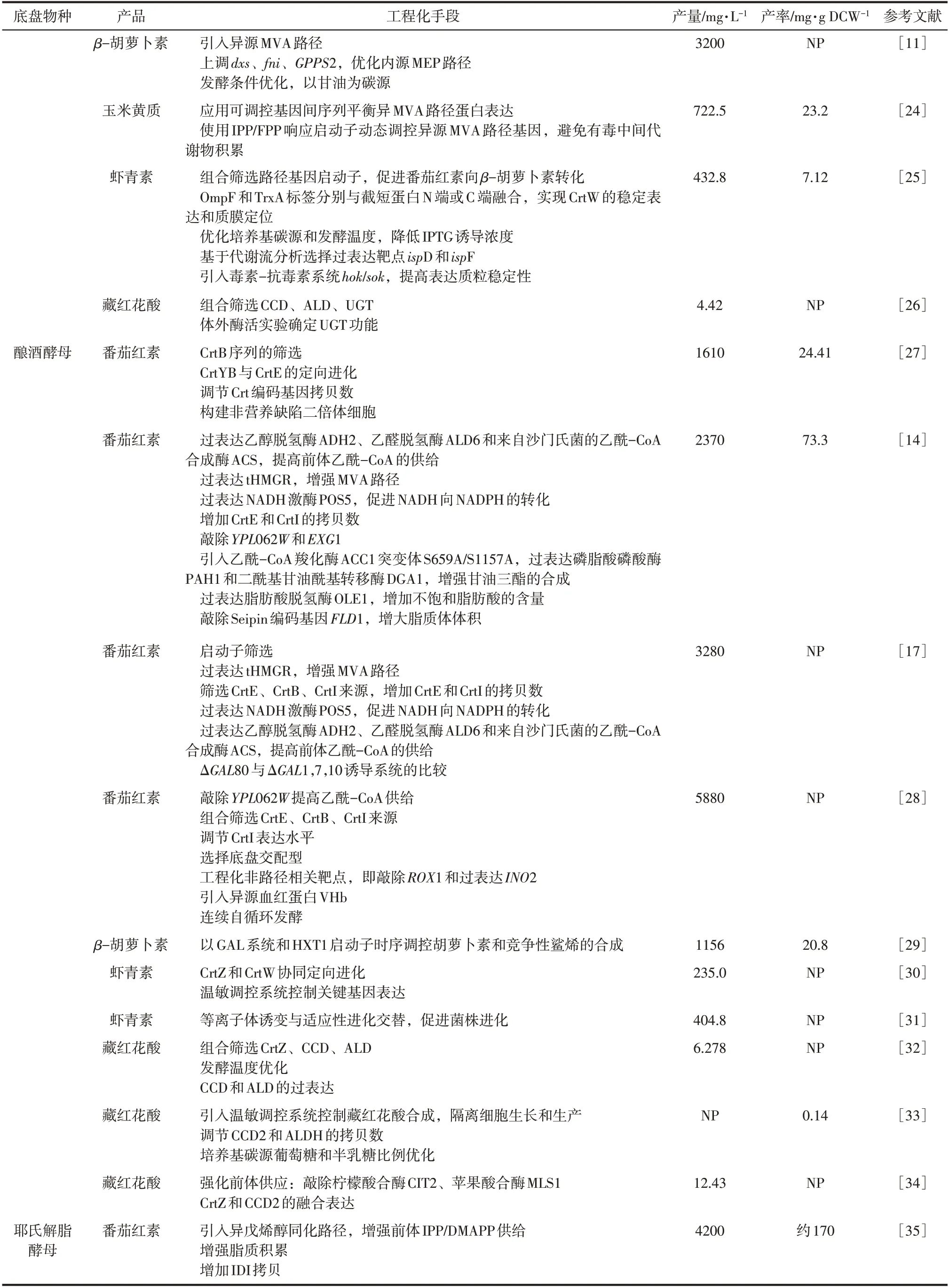
續表1

續表1
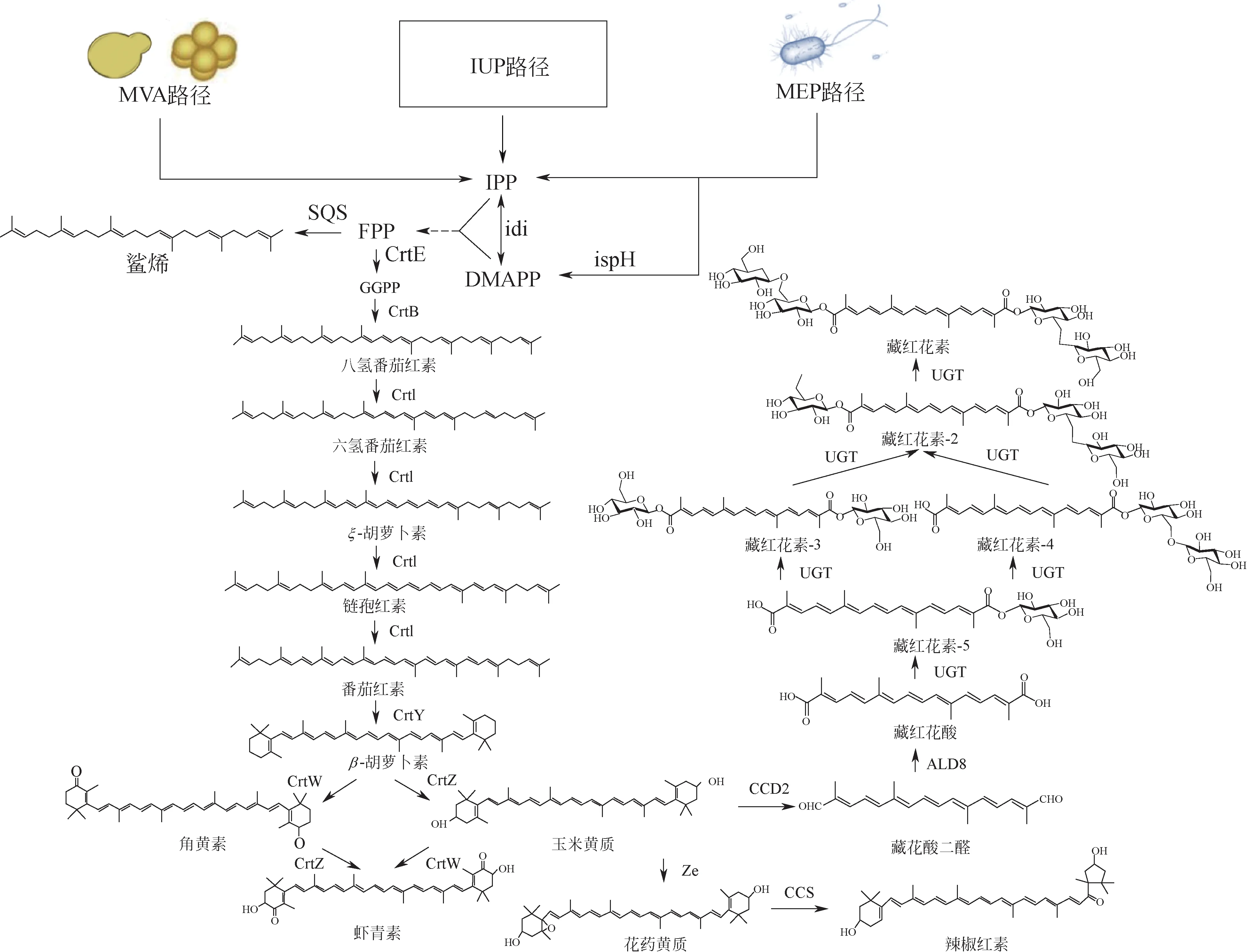
圖1 類胡蘿卜素生物合成路徑
由于類胡蘿卜素具有顏色,可直接通過觀察菌落表型[39]、檢測發酵產物吸光度[40]、拉曼光譜分析等手段[41],挑選出高產菌株。且類胡蘿卜素的強還原性使其具有拮抗活性氧(reactive oxygen species,ROS)的能力[42],從而使過氧化氫添加成為篩選高產量的選擇壓力。因此,通過在元件、模塊以及底盤水平上產生遺傳多樣性,并結合顏色篩選或氧化壓力選擇,可以便捷地挑選或富集利于產物積累的個體。這一策略的實施減少了理性設計的工作量,有效加速了類胡蘿卜素細胞工廠的構建進程和對產物合成瓶頸問題的突破,并為后續理性優化策略提供靶點信息。本文將從路徑的快速構建和底盤的定向進化兩個角度,系統綜述類胡蘿卜素細胞工廠的非理性設計策略在調控代謝流和緩解產物脅迫壓力中的應用,以期為微生物細胞工廠中合成其他高附加值產物提供指導和借鑒。
1 合成路徑的快速構建
構建類胡蘿卜素細胞工廠涉及多模塊的組裝。除根據目標產品選擇GGPP 合成酶(CrtE 或GGPPS)、八氫番茄紅素合成酶(CrtB)、八氫番茄紅素脫氫酶(CrtI)、番茄紅素環化酶(CrtY)、β-胡蘿卜素羥化酶(CrtZ)、β-胡蘿卜素酮化酶(CrtW)等催化元件,有時還需引入異源MVA 路徑[43-44]、 構建非天然異戊烯醇利用途徑(isopentenol utilization pathway, IUP)[45]和類異戊二烯醇合成途徑(isoprenoid alcohol pathway,IPA)[46],以解除代謝中間體的反饋抑制,增強NADPH 和ATP 的合成,提高前體的供給。類胡蘿卜素產品的高水平合成需要最大限度地增加從底物到目標化合物的代謝通量,同時盡量減少不必要的副產品或代謝中間體的積累。因此,需獲得最優的催化元件,并從催化特性和表達水平兩個維度進行模塊與模塊的組合適配(圖2)。
1.1 路徑模塊間催化性能的適配
1.1.1 關鍵催化元件的篩選和定向進化
類胡蘿卜素產品的高水平合成需要最大限度地增加從底物到目標化合物的代謝通量,同時盡量減少不必要的副產品或代謝中間體的積累。CrtE、CrtI、CrtZ和CrtW是公認的途徑限速酶。上述蛋白因具有較為寬泛的底物選擇性常催化多步連續反應。而不同物種來源的催化元件在催化活性和底物選擇性上存在較大差異[47]。例如,多數GGPPS以法尼基焦磷酸(farnesyl pyrophosphate,FPP)為底物,而少數GGPPS 可以直接利用IPP 和DMAPP 生成GGPP[38,48]。在酵母底盤中,后者可以有效避免與內源固醇合成競爭FPP 而具有更多的底物來源。不同生物源的CrtI在催化多步連續脫氫反應時,會展現出不同的反應步數,最終影響目標化合物在總類胡蘿卜素產品中的占比[49]。CrtZ 和CrtW 分別催化兩步羥基化和兩步酮基化反應,形成β-胡蘿卜素到蝦青素的復雜代謝網絡。此二者催化元件的底物選擇差異決定了反應網絡中代謝中間體的轉化速率[50]。因此,組合篩選不同來源的路徑催化元件是提高類胡蘿卜素合成路徑通量、減少代謝中間體積累的有效手段[17,51]。通過對篩選結果的分析,還可獲得影響路徑整體通量和代謝瓶頸產生的關鍵催化元件,為后續路徑的進一步優化提供了工程化的靶標。例如,Wang 等[52]從高等植物、藻類、真菌、細菌中選擇蝦青素合成路徑上的關鍵酶CrtZ/CrtW進行復配組裝,并表達于β-胡蘿卜素高產的酵母底盤中。通過挑選平板上顏色深紅的菌株并輔以發酵驗證,獲得最佳的CrtZ/CrtW 來源組合,使蝦青素在釀酒酵母中的發酵罐水平產量達到了81mg/L,為當時最高產量。在此基礎上對CrtZ/CrtW 的進化距離與蝦青素產量間的關系進行分析,發現CrtW的進化距離越短,蝦青素的產量越高(R2=0.6755),因此CrtW是影響β-胡蘿卜素到蝦青素轉化的關鍵蛋白。
以靶標催化元件的DNA 序列為模板進行易錯PCR,形成突變文庫并在宿主底盤中予以表征。通過顏色篩選,可獲得符合預期催化活性和反應特異性的突變體,以用于路徑組裝(圖2)。例如,Xie等[27]通過易錯PCR對CrtE和雙功能酶CrtYB進行協同進化。利用顏色篩選出紅色更深的菌株,獲得了環化功能失活保留八氫番茄紅素合成功能的CrtYB突變體,并增強了CrtE 對番茄紅素合成的促進能力,最終番茄紅素在釀酒酵母中的產量達到了1.61g/L(24.41mg/g DCW)。Zhou 等[53]通過CrtW 的定向進化,加速β-胡蘿卜素向角黃素的轉化,最終使蝦青素在釀酒酵母中的產量達到了47.18mg/L(8.10mg/g DCW)。同樣通過易錯PCR 協同進化CrtZ 和CrtW,使蝦青素在釀酒酵母中的發酵罐產量進一步提升至235mg/L[16]。
1.1.2 調節催化路徑
自然界中存在一些用于類胡蘿卜素合成的雙功能酶,按催化順序銜接的兩個酶,其活性中心之間構成底物通道。在底物通道的作用下可使局部底物濃度趨于飽和,使得在連續催化反應過程中加速反應底物與酶的接觸,消除底物的競爭性消耗,減少旁路副反應[54]。借鑒這種天然的催化路徑調控機制構建蛋白復合體,可拉近兩個催化單元的蛋白活性中心,增強底物可獲得性,調控催化路徑。類胡蘿卜素的合成通常涉及多個異源蛋白的共表達,構建IDI和CrtE的蛋白復合體,可增加IPP和DMAPP直接向GGPP 的轉化,減少競爭性FPP 的合成[55];構建CrtE/CrtB/CrtI 的蛋白復合體,可加速多酶級聯反應速率,促進GGPP 向番茄紅素轉化[56];構建CrtY 和CrtZ 的蛋白復合體,則有利于玉米黃質的合成[24]。蛋白融合[57]、蛋白支架[56]和蛋白自組裝[55,58]等是構建蛋白復合體的常用手段。其中蛋白融合方向、linker 的類型、蛋白的比例等均是可工程化操作產生遺傳多樣性文庫的靶標,直接影響催化路徑的調控效果(圖2)。例如,Nogueira 等[59]通過在大腸桿菌中對不同柔性linker 長度下CrtZ-CrtW 正反向融合進行篩選,獲得最佳的CrtZ-CrtW融合蛋白以用于煙草中蝦青素的合成。
1.2 路徑模塊間表達水平的適配
1.2.1 最適表達方式的篩選
通過調節模塊的表達水平來平衡模塊間代謝流的通量,也可達到弱化途徑瓶頸的目的[23]。在調整表達強度時,多考慮調控模塊拷貝數[60]、染色體整合位置[61]、啟動子強度[62]、模塊排列的位置和方向[63]等因素。其中,工程化模塊在宿主中的質粒表達和染色體整合是篩選模塊最佳拷貝數的主要手段(圖2)。多拷貝質粒在不同的底盤個體中拷貝數存在較大差異。利用這一特點,將路徑中每一模塊分別克隆到不同質粒進行表達,可較為便捷地建立強度多樣化的模塊表達文庫,平衡不同模塊的表達水平[64-65]。在此基礎上復配強度不同的啟動子可增加文庫的多樣性[66]。通過調控質粒的復制起始位點,可調控質粒的拷貝數,以增加所克隆模塊表達強度的動態范圍[67]。為增強質粒的穩定性,可在表達載體上引入毒素-抗毒素系統[25]或回補基因組缺陷的必需基因[68],并通過調控上述功能標簽的轉錄水平調節質粒拷貝數。
為實現路徑模塊的穩定表達,類胡蘿卜素合成途徑的構建仍多采用底盤基因組整合的方式。模塊在基因組的插入位置和拷貝數,決定了路徑模塊整體表達水平的高低,從而直接影響類胡蘿卜素合成路徑的通量。因此,通過進行染色體多位點隨機整合可以產生路徑模塊表達文庫,結合高通量篩選也可得到類胡蘿卜素高產菌株[圖3(a)]。其中,δ-位點整合是釀酒酵母中最常用的基因組多位點隨機整合方法[52]。Yamada 等[69]通過依次進行CrtE、CrtYB和CrtI的δ-位點整合,構建β-胡蘿卜素合成路徑。CRISPR 技術的引入可通過靶向雙鏈斷裂來顯著提高同源整合的效率,避免選擇性標簽的使用。Ronda 等[70]開發了一種名為CrEdit(CRISPR/Cas9 mediated genome editing)的方法,以一步轉化實現模塊的多拷貝整合,應用于釀酒酵母中β-胡蘿卜素的合成路徑組裝。Hou 等[71]設計了一個名為“wicket”的DNA 表達盒。該表達盒在經核酸酶處理后可接受外源基因,并將其整合到釀酒酵母基因組的指定位點,以實現β-胡蘿卜素的合成路徑中各個模塊在基因組的隨機拷貝數整合。在耶氏解脂酵母中應用CRISPR技術需敲除KU70,以抑制非同源末端連接(non-homologous end joining,NHEJ),提高同源重組效率[13]。而Cui 等[72]則利用耶氏解脂酵母較強的NHEJ,開發了非同源性依賴的多模塊隨機整合的方式,以建立模塊表達水平文庫,篩選β-胡蘿卜素的高產菌株。
1.2.2 最適啟動子序列的篩選
篩選不同強度的天然啟動子[25],或者通過啟動子工程人工構建強度不同的啟動子文庫[73],可用于路徑模塊相對表達強度的平衡(圖2)。例如,Wu等[74]通過操縱基因啟動子RBS序列和起始密碼子序列,建立路徑基因表達文庫,平衡模塊間的表達水平,在大腸桿菌中構建玉米黃質的生產路徑(產量為6.33mg/L, 1.24mg/g DCW)。Larroude 等[62]通過篩選每個轉錄單位的最佳啟動子-基因對,最終使耶氏解脂酵母中β-胡蘿卜素的產量達到了6.5g/L(89.6mg/g DCW)。大腸桿菌啟動子中通常可用于編輯產生啟動子強度多樣性文庫的順式元件,包括核 糖 體 結 合 位 點 (ribosome binding site,RBS)[16,39]、RBS 序列與基因翻譯起始位點之間的間隔序列(aligned spacing sequence,AS)[75]、起始密碼子序列[74]等。此外,對于原核底盤,可通過設計“可調控基因間序列”(tunable intergenic regions,TIGRs),獲得長度、GC含量、莖環結構多樣性的原核操縱子內基因間序列;還可以通過篩選mRNA二級結構,調控轉錄單元的穩定性,同時獲得一個操縱子內多個基因的最優表達水平[76-77]。Shen等[24]應用可調控基因間序列,在大腸桿菌中平衡異源MVA 路徑蛋白表達,最終使玉米黃質的產量達到722.46mg/L(23.16mg/g DCW)。
酵母中則通過不同啟動子核心區序列和上游激活序列(upstream activating sequence,UAS)的雜合以及不同拷貝數UAS 的串聯,形成表達強度梯度更精細的啟動子文庫[78-79]。引入正交化的異源轉錄因子調控系統也可構建不同表達強度的啟動子文庫[80]。例如,Cuperus等[81]基于大腸桿菌tet操縱子,使用與轉錄激活因子TetR-VP16親和力不同的tetO序列構建啟動子文庫,優化番茄紅素合成路徑中CrtE、CrtB 與CrtI 的表達。在篩選路徑模塊的最佳啟動子序列時,常采用Ⅱ型限制性內切酶介導的組裝策略[圖3(b)],例如,Golden Gate DNA 組裝[37]、YeastFab 組裝[82]等。COMPASS 方法(combinatorial pathway assembly)利用營養缺陷標記和抗性標記分別在大腸桿菌和釀酒酵母中建立正交化的克隆篩選體系,以克隆片段中的啟動子開啟載體上標簽序列的轉錄[圖3(b)],從而在迭代轉化篩選的過程中避免了反復進行PCR 驗證和測序驗證等一系列繁瑣的操作過程,有效縮短了組裝周期[80]。
1.3 模塊間的多因素組合適配
理論上若要取得模塊與模塊的最佳適配效果,需對每個催化元件的序列、拷貝數、表達水平以及所有元件的排列方式進行多因素的篩選。這需要相當龐大的構建工作量以滿足文庫所需的覆蓋度。基于Cre/loxp 位點特異性重組系統所建立的一系列SCRaMbLE (synthetic chromosome rearrangement and modification by LoxPsym-mediated evolution)方法可有效解決這一問題。體外基因重排[體外SCRaMbLE,圖3(c)],在體外由Cre 重組酶介導多個含LoxPsym位點的外源模塊任意隨機組合,形成質粒文庫導入底盤細胞進行目標產品的顏色篩選。該方法可同時對催化元件的來源、拷貝數以及排列位置與方向進行篩選,并成功應用于β-胡蘿卜素合成途徑通量的優化[83]。SCRaMbLE-in[圖3(c)]同時具有體外正交化的重組酶工具包與體內基因組重組系統,體外重組系統建立模塊多樣化的啟動子文庫,體內重組系統產生基因組不同位置的整合[84]。Qi等[85]綜合上述兩種方法的優勢建立體外和體內重組系統,以篩選CrtZ/CrtW 的最佳來源組合、拷貝數和染色體整合位置,使釀酒酵母中蝦青素搖瓶水平產量達到了6.05mg/g DCW。
模塊化代謝工程 (modular metabolic engineering,MME)[86]將路徑中所涉及的催化單元按一定規則聚類分組,將每一組中所有的催化單元的表達盒子視為一個模塊。該方法只涉及平衡模塊間的表達水平,以降低路徑構建的復雜性。多維啟發 式 過 程 (multidimensional heuristic process,MHP)不僅按MME 的思想通過篩選表達載體和不同強度的啟動子對整個模塊的表達水平進行適配,還增加對模塊內部關鍵催化元件的序列優化(物種來源篩選和酶工程改造) 及啟動子順式元件(RBS、5'-UTRS)的篩選,以實現同時從催化活性和表達強度兩個角度進行模塊與模塊的多因素適配[87]。Zhang 等[87]基于該思想將從乙酰-CoA 起始的蝦青素合成路徑以MVA、DMAPP、β-胡蘿卜素為結點分為四個模塊進行模塊間適配,并對由CrtZ/CrtW 組成的第四個模塊進行內部催化元件的再次適配,使大腸桿菌中蝦青素產量達到320mg/L(15.1mg/g DCW)。
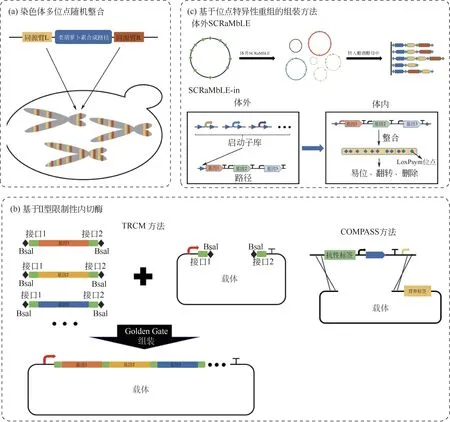
圖3 模塊間適配的組裝策略
2 底盤細胞不同尺度的DNA變異與進化
類胡蘿卜素的長鏈異戊二烯基結構使其具有強疏水性。除蝦青素被報道在兩相培養時會有部分產物富集于胞外油相[88],大多數缺乏親水基團的類胡蘿卜素(例如番茄紅素、β-胡蘿卜素等)在胞內積累后會附著在生物膜上,并以線性形式嵌入磷脂雙分子結構中,進而破壞膜結構、干擾細胞膜的正常生理功能[89]。作為儲存類胡蘿卜素的主要場所,有限的細胞膜結構還限制了目標產品產量的提升空間。此外,類胡蘿卜素的強還原性還會觸發底盤脅迫響應,提高胞內活性氧(reactive oxygen species,ROS)的產生,進一步危害細胞生長[20,90]。利用誘導性啟動子的時序調控解耦生產菌株的生長與生產[29,63,91]、工程化轉運蛋白[92]和膜囊泡轉運系統[93]促進類胡蘿卜素外排、調節質膜磷脂組分弱化膜系統壓力[94-95]、促進原核底盤聚β-羥丁酸顆粒(PHB)[96]和真核底盤脂質體[14,36-37]對類胡蘿卜素的存儲與隔絕等理性設計手段可以在一定程度上緩解類胡蘿卜素合成對底盤生長的影響。例如,通過脂質工程與傳統代謝工程結合,構建的工程菌番茄紅素單位細胞產量通過高密度培養后可達到73.3mg/g DCW[14]。但對類胡蘿卜素最終產物的產出仍具有局限性的問題。
細胞內復雜的內環境,如基因網絡和對應的代謝網絡的存在,決定了目標產物的產出必然會受到底盤細胞內的其他各方面因素的影響。越來越多的研究表明底盤內源非必需基因對異源類胡蘿卜素的合成水平有著不可忽視的影響[40,47,97]。調控非必需基因可對底盤內環境造成擾動,有助于增加外源模塊和底盤細胞內環境的適配,增強細胞對產物的耐受,強化代謝流向目標路徑的流動。但理性的非必需基因調控往往受限于可操縱的靶點數目和對內源環境的擾動范圍。因此需輔以非理性的底盤擾動策略,增加細胞的基因多樣性和相應的表型多樣化,從而加快生產菌株的進化過程。對底盤的非理性擾動包含單核苷酸水平、基因水平以及基因組大片段水平不同尺度的DNA變異(圖4)。
2.1 不同尺度的DNA變異
2.1.1 單核苷酸水平下的DNA變異
單核苷酸水平的DNA 變異即為DNA 序列的堿基突變。這種突變常通過易錯PCR、誘變或攜帶堿基突變的寡聚核苷酸鏈產生[圖4(a)]。其中,易錯PCR 的靶點多為內源調控因子。這種全轉錄工程(global transcription machinery engineering,gTME)策略旨在從轉錄組重構的角度對底盤內源環境進行擾動。例如,耶氏解脂酵母中脂質積累與β-胡蘿卜素產量相關。Wang 等[98]利用易錯PCR 構建轉錄因子Yl-SPT15 的突變文庫調控胞內脂質積累,并從中篩選出高產β-胡蘿卜素的菌株(產量較原始菌株提高了4.7 倍)。Huang 等[99]則通過篩選易錯PCR 產生的大腸桿菌全局性轉錄調控因子CRP 突變文庫,獲得了可平衡改善菌體代謝的突變體,增強底盤對番茄紅素細胞毒性的耐受。實驗過程中常規使用的誘變手段包括物理誘變(紫外照射、γ射線等)和化學誘變(如堿基類似物、烷化劑)。近年來新興發展的常壓室溫等離子體(atmospheric and room temperature plasmas,ARTP)誘變技術具有更高的突變效率和更多的隨機突變位點[100]。Jin等[101]利用ARTP誘變技術獲得高產蝦青素的釀酒酵母,其產量達到了217.9mg/L(13.8mg/g DCW),并獲得促進蝦青素積累的新靶標基因。多元自動化基因組工程(multiplex automated genome engineering,MAGE)通過設計含有突變的寡聚核苷酸鏈進行基因組多位點同步替換,以實現精確的基因組多靶點定位以及局部堿基的精準變異,該技術成功應用于提高番茄紅素在大腸桿菌中合成水平的研究中[102]。但在釀酒酵母中,MAGE技術由于寡聚核苷酸鏈同源重組的問題,無法精確進行靶點定位和基因編輯。Barbieri 等[103]所開發的改進版真核生物多重基因組工程(eukaryotic multiplex genome engineering,eMAGE)基于酵母DNA 復制機制,設計與復制叉中滯后鏈互補的寡聚核苷酸鏈引入堿基突變,從而在避免雙鏈斷裂的情況下實現精確的堿基變異。利用該方法對β-胡蘿卜素合成路徑每一個催化元件的啟動子、編碼序列、終止子引入遺傳變異,進而篩選影響八氫番茄紅素、番茄紅素、β-胡蘿卜素等積累水平的突變。

圖4 底盤定向進化策略
2.1.2 基因水平的DNA變異
基因水平的DNA 變異是指基因轉錄的激活、抑制以及因插入、刪除而造成的基因失活。表達底盤cDNA 文庫[104]、使用非必需基因單敲文庫[40]、轉座子[105]以及CRISPR-Cas9系統[12],均可實現基因水平的DNA 變異,從而篩選底盤中影響類胡蘿卜素積累的靶點。但上述策略大多只能實現一種基因調控效果。Lian 等[106]基于CRISPR 組裝策略所開發的CRISPR-AID (CRESPR combining transcriptional activation, transcriptional interference, and gene deletion)同時具備轉錄激活、轉錄干擾和基因刪除三種正交化功能,可實現平行的模塊化和高通量代謝網絡調控[圖4(a)]。利用這一策略成功將β-胡蘿卜素在釀酒酵母中的產量提高了3 倍。此外,Liu等[107]將釀酒酵母中的基因轉移到與其具有較近親緣的耶氏解脂酵母中進行體內組裝表達,以構建的“嵌合途徑”擾動解脂酵母底盤的內源代謝,并結合篩選“嵌合途徑”元件的序列、組合、定位順序和拷貝數,最終將番茄紅素在解脂酵母中搖瓶水平產量提高到了259mg/L(約80mg/g DCW)。
2.1.3 基因組大片段水平的DNA變異
基因組大片段水平的DNA 變異主要指基因組結構變異(structure variation,SV),即大片段DNA的缺失、重復、移位、倒置等。上述根據自然界單核苷酸多態性變異(single nucleotide polymorphism,SNP)和插入缺失變異(Insertion/deletion,InDel)而設計開發的單核苷酸水平和基因水平人工變異策略并不能實現基因組結構變異或重排。基于人工酵母合成型染色體非必需基因兩端的LoxP 位點,建立體內SCRaMbLE技術,可以設計實現由單基因及區段缺失、復制、易位、倒置而產生的基因組重排,從而對釀酒酵母進行表型進化,獲得多樣化的功能底盤細胞[圖4(a)]。Jia等[108]以β-胡蘿卜素的合成為示例,提出以“與”門開關控制基因組重排的方法,并建立多輪迭代基因組重排策略,以精準動態可控的重排技術實現了基因組多樣化和持續快速進化,經過了5輪重排,β-胡蘿卜素的產量提高了38.8 倍。Wang 等[109]以玉米黃質的合成作為示例,提出環形染色體重排的新體系,揭示染色體結構變異與生產菌株功能強化的對應關系。
2.2 適應性進化
適應性進化是目前通過在特殊條件下篩選并積累具有目標表型細胞的常見有效方法[圖4(b)]。為了適應特殊的條件,菌株會在選擇壓力的脅迫下富集有益突變。這種突變并不局限于上述從單堿基到基因再到基因組大片段的變異尺度。近些年來,許多成功的案例表明[110-113],適應性進化可被應用于改善微生物的生長并同時促進微生物中高附加值化合物的生產。科學家們通過適應性進化策略,獲得了適應高濃度碳源培養條件的一系列突變工程菌株, 如高度耐葡萄糖的寇氏隱甲藻(Crypthecodinium cohnii)和高度耐甘油的混濁紅球菌(Rhodococcus opacus),它們被證實分別在高葡萄糖濃度和高甘油濃度的培養條件下表現出生長改善與目標產品脂質積累[53,114]。
除營養脅迫外,適應性進化實驗通常還會采用諸如高氧[111]、高溫[112]、高鹽[113]等環境脅迫因素來改善微生物性能。利用類胡蘿卜素強還原性的特性,通過在連續傳代培養的過程中定期向培養基中添加過氧化氫產生氧化脅迫,可以迫使菌體增加類胡蘿卜素的產量以對抗氧化壓力,從而提高菌株生產類胡蘿卜素能力的上限。Reyes 等[42]利用該方法使釀酒酵母中類胡蘿卜素的產率從6mg/g DCW 提高到18mg/g DCW。Jiang等[31]將適應性進化與ARTP誘變相結合,以ARTP誘變加速菌株變異速度,以過氧化氫壓力驅動有益突變體的適應性富集,并通過多輪迭代誘變進化穩定生產菌株的高產表型,最終使釀酒酵母中蝦青素發酵罐水平產量達到404.8mg/L,并觀察到胞內ROS 積累降低,菌株時序壽命增加的現象。
3 結語
因具備便于篩選的特性,非理性設計策略適用于類胡蘿卜素細胞工廠的構建和開發,與理性設計策略相輔相成,將極大地推動類胡蘿卜素的生物合成進程。通過理性設計策略篩選路徑基因、優化基因表達、改造底盤細胞調控靶點實現類胡蘿卜素的異源合成[47,97],進一步通過非理性設計策略實現關鍵基因元件和底盤細胞的快速進化,平衡代謝流,實現類胡蘿卜素產品產量的穩步提升[31,85]。其中以番茄紅素為代表的類胡蘿卜素產品在微生物中的合成產量已突破g/L級別(表1),有望實現大規模工業化生產。然而,為降低路徑調控和底盤優化的復雜性、應用多種碳源、應對復雜非理想化的工業發酵過程并盡可能縮減生產成本,研究者越來越傾向于使用大腸桿菌、釀酒酵母之外的微生物作為生產番茄紅素等類胡蘿卜素產品的底盤(表2)。這些物種或具有天然的類胡蘿卜素合成路徑[115],或善于表達異源蛋白[116],或可光能自養[117],或具備對高溫和有機溶劑的耐受性[114]等性狀。同時,煙草[59]等植物底盤也擴展到類胡蘿卜素產品的合成,以便從蛋白表達、翻譯后修飾以及催化環境上更加貼近產物的天然宿主。例如,在水稻胚乳中引入異源類胡蘿卜素合成路徑,生產富含β-胡蘿卜素的黃金大米(golden rice)[118-119]、橙紅色的角黃素大米和蝦青素大米[120],獲得了一批營養價值高、色彩豐富的水稻新物種。
天然類胡蘿卜素除常見的C40骨架外,還存在C30、C50骨架[115]。類胡蘿卜素合成酶具有較為寬泛的底物選擇性[122],對其中八氫番茄紅素脫氫酶進行定向進化,可獲得不同飽和度的C40類胡蘿卜素產品[49];而對異戊烯基轉移酶、縮聚酶和延伸酶等進行定向進化和組合表達,還可獲得C50[123]、C60骨架[124]的非天然類胡蘿卜素[圖5(a)]。此外,對基本C5骨架單元IPP 和DMAPP 的甲基化修飾[125]以及β-環2'-羥基化修飾[126],也進一步豐富了非天然胡蘿卜素的種類和功能[圖5(b)]。
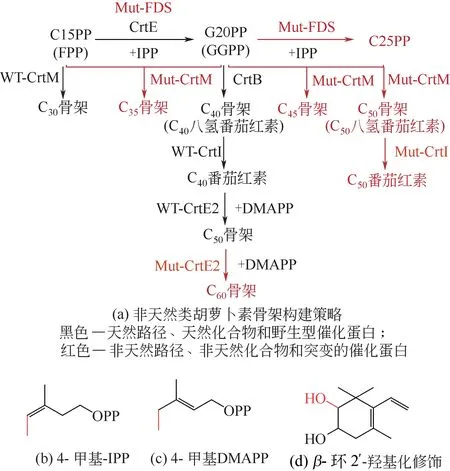
圖5 合成非天然類胡蘿卜素
合成類胡蘿卜素細胞工廠使用非常用底盤和合成非天然產物的發展趨勢,增加了路徑構建和底盤適配的難度,也更加彰顯了發展非理性設計策略的必需性。為了在大規模的突變文庫中快速高效地篩選出理想的微生物菌株,在自動化設備與快速測定方法不斷發展和完善的背景下,基于光信號與傳感器的高通量篩選策略應運而生。研究人員開發了自動挑菌儀、移液工作站、多功能酶標儀等自動化設備以及流式細胞術和微流控技術等高通量篩選方法[127],它們能夠實現微定量實驗和大規模分析,以其高效、精確的特點將在合成類胡蘿卜素細胞工廠的構建與開發中發揮巨大作用。這些自動化設備與高通量篩選技術手段的發展,也將進一步豐富元件-路徑-底盤的遺傳多樣性,使研究者能夠輕松構建并篩選多因素多維度的模塊適配文庫和底盤突變文庫。此外,計算機輔助設計[128]和機器學習[129]的引入,實現了異源代謝途徑設計和構建流程的快速優化。通過多輪的設計、構建、測試與學習,即根據機器學習算法,計算機基于已有數據產生模型,從而對目標生物過程提供預測與判斷,將傳統的實驗過程搬入電腦中,有助于加速了解生物系統及元件間的相互作用,構建出更高效、更穩定的人工細胞工廠。而結合了機器學習算法的全自動機器人平臺[130],可以執行實驗操作并即時分析數據,以迭代的方式優化指定的生物過程,從時間、人力、物力三方面降低了實驗成本,有助于解決傳統分析方法應對大規模數據采集和分析在實驗成本、多變性、偏差和認知不全等方面的障礙。多學科的交叉融合,必定會促使路徑構建和底盤進化向著更加自動化、智能化的方向發展。

表2 非常規微生物底盤合成類胡蘿卜素示例

