RNA:藥物開發的“新鑰匙”
楊冬
自從新冠肺炎暴發并在全世界蔓延以來,人們急切盼望科學家能夠第一時間研制出高效的疫苗。一些生物制藥公司使用RNA技術在很短的時間內開發出了新冠疫苗。隨著越來越多的國家批準新冠疫苗進入臨床應用,并開始組織大規模疫苗接種,RNA技術也走進了大眾視野。那么,RNA技術到底與傳統藥物研發有什么不同?如何利用RNA技術開發新藥呢?
克里克的“中心法則”
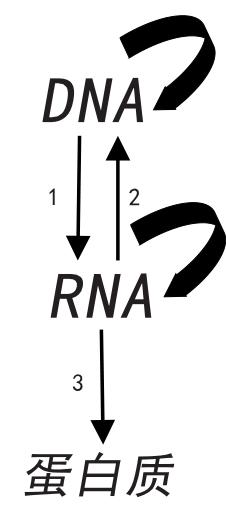
與詹姆斯·沃森于1953年共同提出了DNA的雙螺旋模型后,弗朗西斯·克里克在1956年提出了“中心法則”。“中心法則”認為,遺傳信息的流動是從DNA到RNA然后到蛋白質的。在細胞中,遺傳信息被永久地儲存在DNA里面,等到細胞需要使用某一條信息(即需要表達某個基因)時,相應的信息(即相應的基因的序列)就會被臨時寫到RNA上(稱為轉錄)。這條RNA被稱為信使RNA,即mRNA。然后,細胞內的核糖體根據這條mRNA上記錄的信息合成相應的蛋白質(稱為翻譯)。合成后的蛋白質直接在細胞內發揮各種作用,其中最重要的作用就是作為生物催化劑(酶)完成各種生物化學反應。
在之后的60多年里,科學家對“中心法則”進行了多次修正。比如,在某些情況下,RNA的信息可以被轉移到DNA中,這個過程被稱為逆轉錄。很多病毒,如導致艾滋病的人類免疫缺陷病毒,就是逆轉錄病毒。它們在其生活史中有一個階段就是把RNA中的信息復制到DNA上。之后,這段DNA會被病毒插入它們感染的人體細胞的DNA之中,從而永久地保留在細胞里面。這也是艾滋病難以被徹底治愈的原因之一。此外,有很多病毒的遺傳信息是保存在RNA中的,它們沒有DNA,流感病毒、狂犬病毒、新冠病毒都屬于此類。
目前的科學研究還表明,在真核生物(即擁有細胞核的生物,比如動物、植物、真菌等)的細胞里,通過轉錄合成的往往是mRNA的前體。它們還需要經過剪接去除特定的序列(內含子)以形成可以翻譯的mRNA。在很多情況下,一種基因的轉錄產物可以被剪接成不同的mRNA,并被翻譯成不同的蛋白質。因此,一種基因所攜帶的遺傳信息并不一定是唯一的。后來,又有研究表明,細胞里面有很多RNA并不直接攜帶合成蛋白質的信息,也就是說它們不是mRNA。這些RNA的作用并不是指導核糖體如何合成蛋白質,而是調控其他基因的表達。另外,作為最終的“效力分子”之一的生物催化劑也不僅僅局限于蛋白質。在有些情況下,RNA也可以作為生物催化劑來發揮作用。所以,隨著研究的深入,科學家們發現,RNA的地位日趨重要,真可以稱作“中心法則的中心”了。事實上,不少科學家猜測,在生命起源的最初階段,生命的主要形式就是各種自我復制、自我催化的RNA分子,他們把這個階段稱為“RNA世界”,而DNA以及蛋白質都是后來才進化出來的。
從“小分子”到“大分子”
在藥物開發過程中,研究人員要首先發現一個靶點,也就是鎖。因此,藥物開發就有點像給一把鎖配一把合適的鑰匙。例如,如果你要治療艾滋病,那么人類免疫缺陷病毒中催化逆轉錄反應的逆轉錄酶就是一個很好的靶點。如果你有一種藥物,能夠像鑰匙插入鎖中一樣精確地結合到這個酶上面,那么酶就會失去活性,人類免疫缺陷病毒也就無法復制了。


大多數藥物的靶點都是蛋白質。從藥物本身而言,大部分藥物都是小分子化合物。進入細胞后,小分子藥物可以與靶點上的特定部位結合,從而發揮藥效。近年來,生物制藥公司又開發了基于蛋白質或者小肽的大分子藥物。最常見的大分子藥物是抗體。例如,很多癌細胞需要表皮生長因子受體才能保持生長,所以,相應的抗體可通過阻遏表皮生長因子受體的功能來阻止癌細胞生長。與小分子藥物相比,大分子藥物與靶點特異性結合的能力更強,但是由于大分子藥物無法通過腸道吸收,通常依賴于注射,無法開發成口服藥物。
RNA也能當“鑰匙”
隨著科學家對RNA的認知逐步深入,藥物研發人員又把目光投到了RNA上。能不能將RNA分子開發為藥物呢?正如前面所講,藥物的本質是一把鑰匙,如果想拿RNA作為鑰匙,那鎖又是什么呢?
首先,研究者想到的是,RNA可以用來調控基因表達。我們要做的就是以一種RNA為鑰匙去開一把由DNA或者RNA構成的鎖。比如,有一種反義寡核苷酸技術,即通過設計一段可以和DNA或者其轉錄產物(mRNA或者mRNA前體)的部分序列互補配對的RNA序列,這樣就有可能阻斷相應基因的轉錄或者翻譯。它也可能影響到mRNA前體的剪切,甚至促進mRNA的降解。目前,在這個領域投入較多研發力量的是伊奧尼斯制藥公司(Ionis)。該公司開發的諾西那生(Nusinersen)是治療遺傳病脊髓性肌萎縮癥(SMA)的有效藥物,在2016年作為罕見藥物被批準上市。

對于mRNA這把鎖,目前更有希望的鑰匙是小干擾核酸(siRNA)技術。這個技術利用了一種名為RNA干擾(RNAi)的現象。一個比較成功的例子是Inclisiran,這種藥物是PCSK9的小干擾核酸。PCSK9又被稱為前蛋白轉化酶枯草溶菌素,它起著升高血液中低密度脂蛋白膽固醇的作用。因此,從控制膽固醇水平角度出發,減少PCSK9顯然是一個可行的策略。通過誘導降解PCSK9的mRNA,Inclisiran可以有效達到治療效果。2020年4月發表在《新英格蘭醫學雜志》的三期臨床試驗表明,該藥只需要每6個月皮下注射一次,就可以使低密度脂蛋白膽固醇下降約50%。因此,如果Inclisiran未來能夠被批準上市,它很有可能成為一種可有效治療高膽固醇血癥的藥物。
利用RNA技術開發疫苗
前面的例子都是將RNA作為鑰匙,如果我們想讓一個蛋白質成為鑰匙,是不是還可以利用RNA技術呢?答案是肯定的。
我們可以回想一下mRNA。在細胞內,mRNA通過翻譯可以合成它所編碼的蛋白質。我們可以給細胞輸送一條mRNA,讓它在細胞內合成用來作為鑰匙的蛋白質,讓這把鑰匙在細胞內打開它的鎖,不就達到治療效果了嗎?
現在,有很多公司在研究如何利用mRNA技術開發藥物。不過,出人意料的是,這個技術目前最成功的例子(從嚴格意義上講)并不是藥物,而是疫苗。2020年,全球新冠肺炎流行后,如何能夠快速開發一種高效的疫苗成了當務之急。兩家生物制藥公司—拜恩泰科和輝瑞,不約而同地使用了mRNA技術。藥物研發者的做法是用mRNA編碼新冠病毒的刺突蛋白。這個蛋白對于病毒識別人體細胞上的受體起關鍵作用,因此也是抗體識別的主要位點。通過向人體細胞輸入編碼該蛋白的mRNA,人體細胞就可以自己合成病毒的刺突蛋白,從而刺激免疫系統產生抗體,以達到免疫效果。目前,三期臨床試驗的初步數據顯示,此類疫苗有很好的保護效果,因此一些國家已經批準了該藥的緊急使用授權。從理論上講,由于只需要改變RNA的序列就可以使疫苗適應不同的病毒突變體,所以mRNA疫苗對于應付快速突變的病原體有一定的優勢。當然,由于mRNA疫苗目前還屬于最新技術,因此它的生產、副作用等諸多問題還需要進一步優化。
所有的RNA藥物技術都面臨一個無法回避的問題:要讓RNA發揮作用,首先得把RNA送到細胞里面去。這個問題目前并沒有一個“一錘定音”的解決方案。一個比較常用的方法是用脂質體納米顆粒把RNA包裹在里面,然后利用這種顆粒將其送入細胞內。比如,針對新冠肺炎的mRNA疫苗就使用了這種技術。另一個技術是通過把RNA與GalNac(N-乙酰基-D-半乳糖胺)偶聯,這種方法可以有效地把RNA遞送到肝臟細胞內(但是僅限于肝細胞)。比如,前面講的治療高膽固醇血癥藥物Inclisiran就使用了這一技術。總之,如何有效遞送RNA藥物是當前一個被積極探索的方向。目前,雖然有很多方法,但是都有各自的局限性,未來應該會有更好的解決方案。
藥物從小分子化合物到大分子的蛋白質,又到RNA,經歷了漫長的演變過程。作為藥物,RNA只是一個新來者,但是可以預見,RNA藥物會與它的前輩一樣,為人類的健康做出前所未有的貢獻。

